黄连木种群性比格局研究
2010-06-04赵亚洲张春雨马钦彦赵秀海
赵亚洲,张春雨,张 琰,马钦彦,赵秀海
(1. 上海农林职业技术学院,上海 201600;2. 北京林业大学,北京 100083)
雌雄异株植物在自然界广泛存在,大约占被子植物的6%[1]。热带地区雌雄异株植物更普遍,占开花植物的 21%以上[2]。雌雄异株植物自然种群性比理论值应为 1:1[3],但大量研究显示雌雄异株植物性比显著偏离1:1[4~7]。导致性比偏离均衡状态的原因很多,雌雄受精卵构成比例、花粉粒或花粉管存活率[8~9]、性别表达的遗传决定性[10]等都会导致种群性比偏离平衡状态。此外,植物生长速率[11~12]、种子发育和萌芽率[13]、死亡率[8,14]以及雌雄植株寿命差异也会导致种群性比偏离。雌雄异株植物雌树和雄树资源需求不同[15,19]。当环境压力增大时,种群性比偏雄性[17~19]。如海拔增加[20]、湿度降低[21]、盐度增大[22~23]、氧气缺乏[24]、土壤P/N比减小及Ca/Al比增大[25]、光照强度降低[26~27]都会显著地影响雄树比例。
黄连木(Pistacia chinensis)是重要的木本能源植物,为典型雌雄异株树种[28]。对黄连木的研究主要集中在生长规律、栽培技术、造林、生理学、病虫害防治及综合利用等方面[29~35]。国外学者对黄连木属雌雄异株树种Pistacia lentiscus种群性比格局及种群特征做了大量研究。目前关于黄连木种群性比格局研究尚无报道。本文研究了黄连木种群性比与种群密度和林分密度的关系,分析了生境因子对黄连木种群性比的影响。

图1 黄连木植株在140 m×100 m样地中的空间分布Figure 1 Spatial distribution of P. chinensis trees in the permanent sample plot
1 材料与方法
1.1 研究区域概况
研究区域位于河南省济源市邵源林场,地处太行山南端,海拔478 m,35° 06′ N,112° 07′ E,属于温暖带大陆性季风气候,年平均气温12 ~ 15 ℃;7月平均气温27.7℃,1月平均气温0.15℃;无霜期180 ~ 220 d;年降水量400 ~ 600 mm,季节分配极不均匀,夏季雨量常超过常年降水的50%,而冬季则不足5%,春季一般少于秋季,故而冬春多干早;平均坡度25°;土壤多属碳酸盐褐土和红黏土,土壤有机质含量低,供氮能力低,速效磷极缺。植被乔木树种主要包括刺槐(Robinia pseudoacacia)、侧柏(Platycladus orientalis);灌木主要包括黄刺玫(Rosa xanthina)、卵叶鼠李(Rhamnus bungeana)、荆条(Vitex negundo var. heterophylla)、酸枣(Ziziphus jujube var. spinosa)、黄栌(Cotinus coggygria)、胡枝子(Lespedeza bicolor)等。
1.2 数据采集
2009年在研究区域建立1.4 hm2(140 m×100 m)固定样地,利用全站仪将其进一步划分为35个20 m×20 m连续样方。记录样地内所有胸径(DBH)1 cm以上植株种名、胸径。黄连木雌雄植株在3-4月先叶开花。雄花序排列紧密,长6 ~ 7 cm;雌花序排列疏松,长15 ~ 20 cm。果期9-11月,核果径约6 mm,红色果均为空,绿色果内含成熟种子。于2009年3-10月通过花和果实调查样地内黄连木性别。黄连木雌树在枝上宿存果柄或果序,因此当年未开花的成熟植株可通过果柄判断性别。
为检验种群性比与微环境因子关系,对样地土壤养分、土壤湿度、土层深度及枯落物厚度等环境因子进行调查。将研究样地依次划分为140个10 m×10 m连续小样方,在每个样方土壤表层(0 ~ 20 cm)各取5个500 g的土壤样品进行混合,并取适量带回实验室进行分析。用开氏消煮法测定土壤中全氮含量,碳酸钠熔融法测定土壤中全磷含量,氢氧化钠熔融法测定土壤中全钾含量,高温外热重铬酸钾氧化-密度法测定土壤中有机质含量,用pH计测定土壤pH值,实验重复3次。在每个10 m×10 m样方内挖土壤剖面,测量土层深度及枯落物厚度。
本文将所有 DBH ≥ 4 cm的黄连木个体分为雌树、雄树以及由于观察期间缺少繁殖器官而暂时无法判断性别的未繁殖植株,并将黄连木成熟植株的性比定义为种群性比。为了便于理解,将单位面积上黄连木DBH ≥ 4 cm植株数定义为种群密度;单位面积上黄连木所有繁殖植株数(雌树与雄树和)定义为繁殖植株密度;单位面积上所有树种DBH≥4 cm植株数定义为林分密度。研究样地内DBH≥4 cm植株空间分布如图1所示。
1.3 研究方法
1.3.1 构建性比—取样面积关系 参考张春雨等[36]随机区块抽样技术,建立不同取样面积下的性比统计量:在研究样地(140 m×100 m)内随机抽取10 000个边长为l(5、6、…、200 m)的正方形区块,统计分布在每个正方形区块内的雌、雄植株数,以10 000次随机抽样平均值,作为边长为l的取样面积内雌、雄植株数。将随机区块边长换算为取样面积,构建性比与取样面积关系。黄连木种群性比随取样面积变化波动不大,趋势基本稳定(图2)。
1.3.2 性比—株数密度关系 根据种群性比与取样面积关系,随机产生10 000个面积为0.25 hm2(边长为50 m)的正方形区块,统计落到每个区块内的雌、雄植株数。以此为基础,建立种群性比与繁殖植株密度、种群密度及林分密度关系。
1.3.3 GLM模型检验性比密度依赖性 采用GLM模型(GLM with binomial errors)检验雌雄异株树种种群性比的密度依赖性。将雌树和雄树株数作为响应变量,分别将繁殖植株密度、种群密度及林分密度作为自变量,构建回归模型。本文采用两个常用的雌雄株性别配比指标:性比=雄树株数/雌树株数;雄株比例=雄树株数/繁殖植株数(雄树+雌树)[37]。
1.3.4 检验性比与微生境因子之间关系 将研究样地依次划分为140个10 m×10 m小样方,并统计落在每个小样方内的雌、雄植株数,利用 Pearson相关分析检验雌树株数、雄树株数及雄性比例与微生境因子的关系。

图2 黄连木种群性比(雄/雌)与取样面积关系Figure 2 Relationship between sex ratio and sampling area
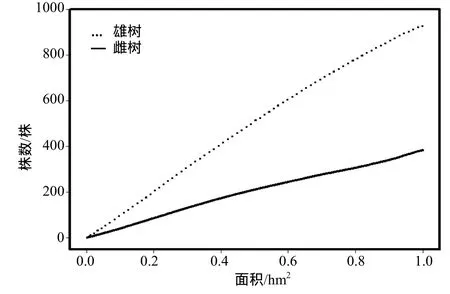
图3 黄连木种群繁殖植株数与取样面积关系Figure 3 Relationship between number of the reproductive trees and sampling area
2 结果分析
2.1 黄连木雌雄植株数与取样面积关系
黄连木种群性比受取样面积大小影响。黄连木雌、雄植株个体数随取样面积的增大而增多,且雄树明显多于雌树,性比大于1。当取样面积小于0.016 9 hm2时,由于雌、雄植株个体出现的随机性较大,性比不显著偏离 1:1( x2检验,p > 0.05);随着取样面积增大,黄连木种群性比显著偏离1:1。当取样面积大于0.016 9 hm2时,性比显著偏雄性( x2检验,p<0.05)。
2.2 黄连木性比与植株密度关系
利用GLM模型检验种群性比与繁殖植株密度、种群密度及林分密度之间的相关性(表1)。结果表明,黄连木种群性比与繁殖植株密度、种群密度及林分密度之间均呈显著正相关(p < 0.001),即种群性比具有显著的密度依赖性。

表1 黄连木种群性比与植株密度之间的回归分析Table 1 Regression analysis on population sex ratio and stand density
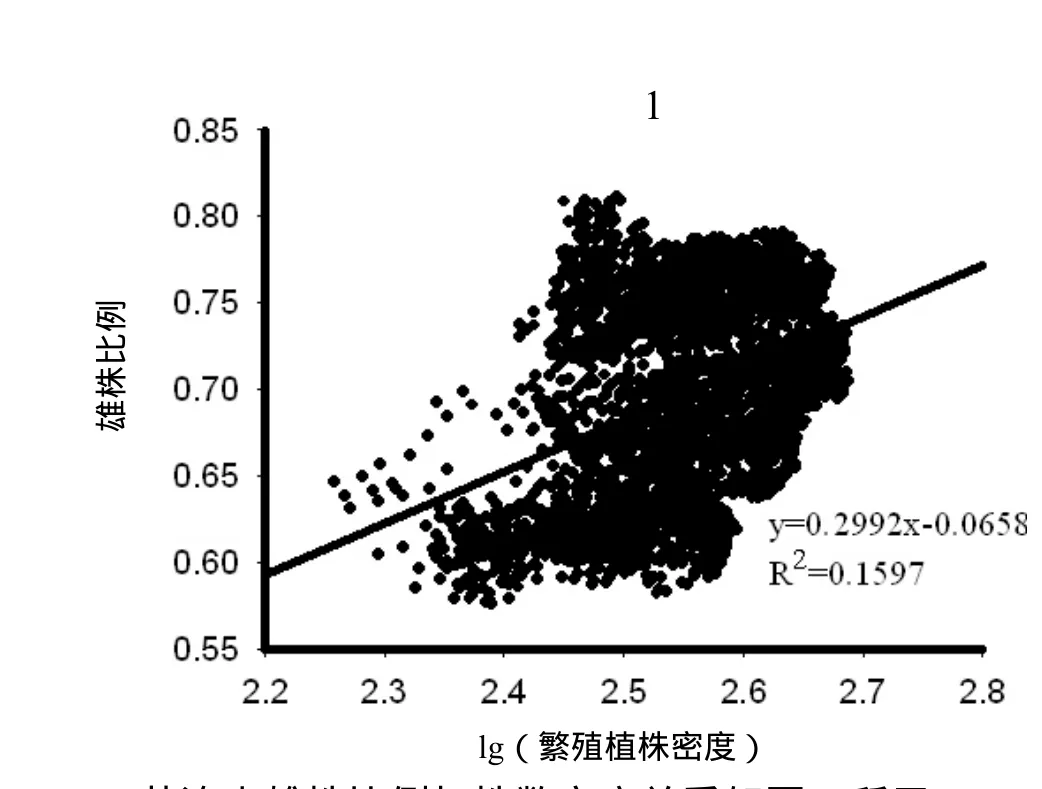
黄连木雄株比例与株数密度关系如图4所示。
黄连木雄株比例与繁殖植株密度呈正相关(r =0.3996,p < 0.001),与种群密度呈显著正相关(r =0.566 5,p < 0.001),与林分密度呈显著正相关(r= 0.512 2,p < 0.001)。
2.3 种群性比与微生境因子关系
黄连木种群性比与微生境因子相关分析显示:黄连木雌树株数、雄树株数均与土壤全氮、有机碳、有机质和枯落物厚度呈显著正相关。黄连木雌、雄植株数与土壤 pH值、全磷、全钾、土层厚度均无显著相关性;黄连木雄株比例与土壤全磷含量显著负相关(r =-0.168, p < 0.05),与土壤湿度显著正相关(r = 0.186, p < 0.05),与土壤pH值、全钾、全氮、有机碳、有机质、土层深度无显著相关性(表2)。

图4 黄连木雄株比例与株数密度间关系Figure 4 Correlation of male proportion with stand density

表2 黄连木种群性比与生境因子的关系Table 2 Correlation between population sex ratio and microenvironment factors
3 结论与讨论
黄连木种群性比随取样面积变化波动不大,所以进行黄连木种群性比格局研究可合理确定取样面积,避免浪费人力、物力。大量研究显示在资源匮乏的生境中,雌雄异株植物种群性比通常偏雄[38~39]。Barradas et al.研究发现地中海地区(Pistacia lentiscus)种群性比偏雄[40]。黄连木种群雄树明显多于雌树,性比显著偏离1:1(检验,p < 0.001)。本文研究样地内土壤多属碳酸盐褐土和红黏土,土壤有机质含量低,供氮能力低,不良生境条件可能是导致黄连木种群性比显著偏雄的原因。
本文结果表明黄连木种群性比具有显著密度依赖性。黄连木种群雄株比例与繁殖植株密度、种群密度、林分密度均呈显著正相关。雌雄异株植物种群雄株比例与较高的局部林分密度有关[41~42],林分密度增大导致邻体竞争增加,进而产生强大的环境压力。国外学者研究发现黄连木属乳香黄连木的雄株比例与种群密度显著正相关;当种群密度低时雌树占优势,随着种群密度增加性比接近 1:1[6]。黄连木雄株比例与土壤全磷含量显著负相关。Krischik等发现雌雄异株树种酒神菊(Baccharis halimifolia)在种群密度高、土壤营养含量低的环境中性比偏雄性[11]。
环境因子可能导致雌雄异株植物发生性别改变或性比偏离,如雄树或雌树通常表现出不同的环境偏好。一般雄树在资源溃乏的环境中生长良好,而雌树则倾向于生长在资源丰富的生境中[14,43]。黄连木种群性比与微生境因子相关分析显示,黄连木雌雄植株数量均与土壤全氮、有机碳、有机质以及枯落物厚度显著正相关。因此,黄连木种群雌雄植株可能具有相似的资源需求。通常认为与雄树相比,雌树更加喜欢潮湿的生境。但本文研究结果却相反,黄连木雄树与土壤湿度显著正相关,而雌树与土壤湿度相关不显著。
[1] Renner S S, Ricklefs R E. Dioecy and its correlates in the flowering plants [J]. Am J Bot,1995(82):596-606.
[2] Bawa K S. Evolution of dioecy in flowering plants [J]. Ann Rev Ecolo Sys, 1980(11):15-39.
[3] Fisher R A. The genetical theory of natural selection [M]. Oxford: Oxford University Press, 1930.
[4] Bierzychudek P, Eckhart V. Spatial segregation of the sexes of dioecious plants[J]. Am Naturalist, 1988(152):34-43.
[5] Thomas S C, LaFrankie J V. Sex, size, and interyear variation in flowering among dioecious trees of the malayan rain forest [J]. Ecology, 1993(74):1 529-1 537.
[6] Verdú M, García-Fayos P. Females biased sex ratios in Pistacia lentiscus L.(Anacardiaceae) [J]. Plant Ecol, 1998(135):95-101.
[7] Pickering C M. Sex-specific differences in floral display and resource allocation in Australian alpine dioecious Aciphylla glacialis (Apiaceae) [J].Aus.J Bot, 2000(48):81-91.
[8] LIoyd D G. Sex ratios in sexualIy dimorphic Umbel liferae[J]. Heredity, 1973(31):239-249.
[9] Carrol S B, Mulcahy D L. The relationship between pollen grain size and progeny gender in dioecious Silene latifolia (Caryophyllaceae) [J].Sex Plant Reprod, 1991(4):203-207.
[10] Taylor D R. The genetic basis of sex ratio in Silene alba (= S. latifolia) [J]. Genetics, 1994(136):641-651.
[11] Krischik V A, Denno R F. Patterns of growth, reproduction, defense, and herbivory in the dioecious shrub Baccharis halimifolia (Compositae) [J].Oecologia, 1990(83):182-190.
[12] Allen G A, Antos J A. Sex ratio variation in the dioecious shrub Oemleria cerasiformis [J]. Am Naturalist, 1993(141):537-553.
[13] Purrington C B. Parental effects on progeny sex ratio, germination, and flowering in Silene latifolia (Caryophyllaceae) [J]. J Ecol 1993(81):807-811.
[14] Freeman D C, Harper K T, Charnov E L. Sex change in plants: old and new observations and new hypothesis[J]. Oecologia, 1980(47):222-232.
[15] Obeso J R. The costs of reproduction in plants [J]. New Phytolist, 2002(155):321-348.
[16] Vega-Frutis R, Guevara R. Different arbuscular mycorrhizal interactions in male and female plants of wild Carica papaya L.[J]. Plant Soil,2009(322):165-176.
[17] Dawson T D, Bliss L C. Patterns of water use and the tissue water relations in the dioecious shrub, Salix arctica: the physiological basis for habitat partitioning between the sexes [J]. Oecologia, 1989(79):332-343.
[18] Sakai A K. Sex ratios of red maple (Acer rubrum) populations in northern lower Michigan [J]. Ecology, 1990(71):571-580.
[19] Sakai A K, Weller S G. Ecological aspects of sex expression in subdioecious Schiedea globosa (Caryophyllaceae) [J]. Am J Bot, 1991(78):1 280-1 288.
[20] Pickering C M, Hill W. Reproductive ecology and the effect of altitude on sex ratios in the dioecious herb Aciphylla simplicifolia (Apiaceae) [J].Aus J Bot, 2002(50):1-12.
[21] Dawson T E, Ehleringer J R. Gender specific physiology, carbon isotope discrimination, and habitat distribution in box-elder, Acer negundo [J].Ecology, 1993(74):798-815.
[22] Eppley S M. Gender-specific selection during early life history stages in the dioecious grass Distichlis spicata [J]. Ecology, 2001(82):2 022-2 031.
[23] Vitale J J, Freeman D C. Patterns of biomass allocation in Spinacia Oleracea (Chenopodiaceae) across asalinity gradient-evidence for a niche separation [J]. Am J Bot, 1987(74):1 049-1 054.
[24] Shea M M, Dixon P M. Size differences, sex-ratio, and spatial distribution of male and female water tupelo, Nyssa aquatica (Nyssaceae) [J].Am J Bot, 1993(80):26-30.
[25] Marques A R, Fernandes G W, Reis I A, et al. Distribution of adult male and female Baccharis concinna (Asteraceae) in the Rupestrian Fields of Serra Do Cipό, Brazil [J]. Plant Biil,2002, 4(1):94-103.
[26] Nicotra A B. Sex ratio variation and spatial distribution of Siparuna grandiflora, a tropical dioecious shrub [J]. Oecologia, 1998(115):102-113.
[27] Thomas S C, LaFrankie J V. Sex, size, and inter-year variation in flowering among dioecious trees of the Malayan rain-forest [J]. Ecology, 1993,74(5):1 529-1 537.
[28] 郑万钧. 中国树木志(4)[M]. 北京:中国林业出版社,2004. 4 227-4 229
[29] 刘启慎,谭浩亮,李建新. 中国黄连木生长规律的研究[J]. 河南林业科技,1999(6):3-6.
[30] 金烈谊,袁其站. 太行山南段黄连木生长规律与效益分析[J]. 中国林业调查规划,1995(4):17-19.
[31] 徐金燕,石玉琴. 中国黄连木播种育苗技术[J]. 经济林研究,2005,25(3):28-30.
[32] 马铁民,李保国,齐国辉,等. 黄连木容器苗造林关键技术的初步研究[J]. 河北林果研究,2008,23(1):20-21.
[33] 田士波,靳杏蕊,赵淑娥. 黄连木种子小蜂幼虫危害特点与防治[J]. 植物保护,1994,20(2):15-16.
[34] 贾利强,李吉跃. 水分胁迫对黄连木、清香木幼苗的影响[J]. 北京林业大学学报,2003,25(3):55-59.
[35] 李在军,冷平生. 黄连木对干旱胁迫的生理响应[J]. 植物资源与环境学报,2006,15(3):47-50.
[36] 张春雨,赵秀海. 随机区块法在空间点格局分析中的应用[J]. 生态学报,2008(28):3 108-3 115.
[37] Hardy I C W. Sex Ratios: Concepts and research methods [M]. New York: Cambridge University Press,2002.
[38] Freeman D C, Klikoff L G, Harper K T. Differential resource utilization by the sexes of dioecious plants [J]. Science, 1976, 193(4253):597-599.
[39] Lawton R. O., Cothran P. Factors influencing reproductive activity of Juniperus virginiana in the Tennessee Valley[J]. J Torrey Bot Soc, 2000,127(4):271-279.
[40] Barradas M C D, Correia O. Sexual dimorphism, sex ratio and spatial distribution of male and female shrubs in the dioecious species Pistacia lentiscus L[J]. Folia Geobot, 1999, 34(1):163-174.
[41] Onyekwelu S S, Harper J L. Sex ratio and niche differentiation in spinach (Spinacia oleracea L.) [J]. Nature, 1979(282):609-611.
[42] Marques A R, Fernandes G W, Reis I A, et al. Distribution of adult male and female Baccharis concinna (Asteraceae) in the rupestrian fields of Serra do Cipό, Brazil [J]. Plant Biol, 2002(4):94-103.
[43] Ueno N., Seiwa K. Gender-specific shoot structure and functions in relation to habitat conditions in a dioecious tree, Salix sachalinensis [J].J For Res, 2003(8):9-16.
