尼可刹米注射液细菌内毒素检查法的建立
2010-06-01张广伟周继春
张广伟,周继春
(河南省食品药品检验所,河南 郑州 450003)
尼可刹米注射液为中枢兴奋药,主要用于治疗疾病或呼吸抑制药中毒引起的呼吸及循环衰竭[1],收载于2005年版《中国药典(二部)》,但并无热原或细菌内毒素检查方法。天津药业焦作有限公司的药品注册标准中增加了热原检查项目,但在实际操作中经常出现注射本品后兔体温急剧升高的现象,分析原因可能是注射速度过快所致不良反应,为使标准更适宜操作、可控,该公司委托我所建立尼可刹米注射液细菌内毒素检查方法。现报道如下。
1 仪器与试药
DC3A型干式恒温器(南京三爱斯技术开发有限公司);ZH-2型自动漩涡混合器(天津药典标准仪器厂)。尼可刹米注射液,(规格 1.5 mL ∶0.375 g,批号为 07070122,07091021,08032431,08051531,08062222,08110121,天津药业焦作有限公司)。鲎试剂(TAL,批号为0710262、规格为0.5 mL/支、灵敏度 0.5 EU/mL,批号为0712270、规格为0.5 mL/支、灵敏度0.125 EU/mL;湛江安度斯生物有限公司;批号为0705300、规格为0.5 mL/支、灵敏度 0.25 EU/mL,批号为 0901122、规格为 0.5 mL/支、灵敏度0.125 EU/mL,湛江博康海洋生物有限公司)。细菌内毒素工作标准品(WSE,规格为 120 EU/支,批号为 150601-200862),细菌内毒素检查用水(BET用水,批号为2008-4,规格为10 mL/支)均由中国药品生物制品检定所提供。
2 方法与结果
2.1 供试品细菌内毒素限值(L)确定
根据细菌内毒素限值的计算公式:L=K/M,其中 K为人每kg体重每h最大可接受的内毒素剂量,注射剂的K值为5 EU/(kg·h),M为人用每kg体重每h的最大供试品剂量,人均体重按60 kg计算。参照该药品说明书及《临床用药须知》[1-2],本品成人1次最大给药剂量为1 250 mg/(60 kg·h),则L=K/M=5 EU/(kg·h)/1 250 mg/(60 kg·h)=0.24 EU/mg。考虑到本品为急救用药,应标准从严,结合干扰试验结果,确定 L为0.15 EU/mg。
2.2 TAL灵敏度复核
按照2005年版《中国药典(二部)》附录的要求复核所用TAL进行复核,结果均符合规定。见表1。
2.3 干扰预试验
将样品用 BET用水进行倍比稀释,分别稀释 2,4,8,16,32,64,128,256,512 倍,制成质量浓度为 125,62.5,31.25,15.62,7.8,3.9,1.95,0.98,0.49 mg/mL的溶液,将上述稀释溶液用湛江安度斯生物有限公司生产的TAL(灵敏度为0.5 EU/mL,批号为08110121)依法进行干扰试验预试验[3]。结果见表2。可见,供试品溶液在0.49 mg/mL及其以下质量浓度时对试验可能不造成干扰。为了较准确地确定最大不干扰浓度,将样品分别制成质量浓度为2.0,1.0,0.9,0.8,0.7,0.6,0.5 mg/mL 的溶液,再次进行干扰试验预试验,结果样品稀释至0.9 mg/mL时即不再对试验产生干扰。

表1 TAL灵敏度复核结果

表2 样品细菌内毒素干扰预试验结果
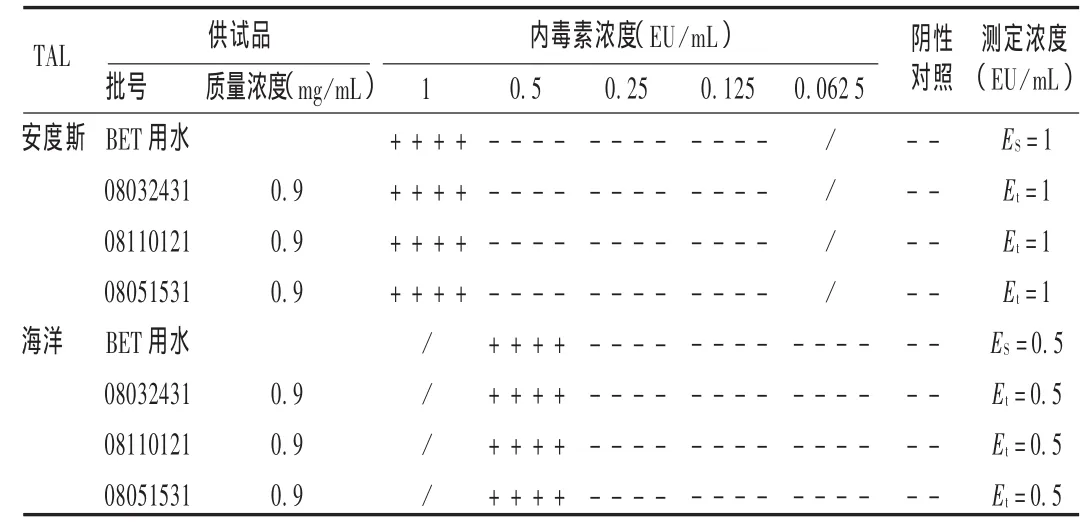
表3 尼可刹米注射液细菌内毒素干扰试验结果
2.4 干扰试验
根据预试验结果,将3个批号的样品稀释至0.9 mg/mL,分别取上述2个厂家的 TAL(安度斯 λ0.5,海洋 λ0.25),依法进行干扰试验[2]。结果见表3。可见,样品高质量浓度时对TAL与细菌内毒素的凝集反应有干扰作用,经稀释至0.9 mg/mL时即可排除干扰作用,Et均在0.5~2.0 ES之间,其最大不干扰质量浓度为0.9 mg/mL。
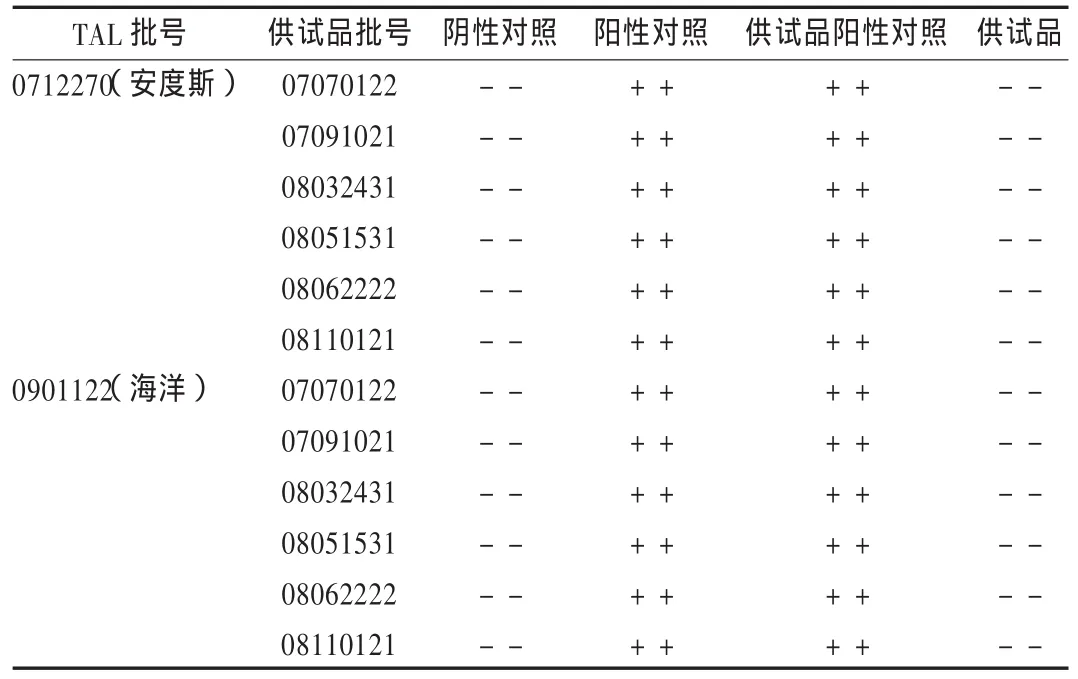
表4 尼可刹米注射液细菌内毒素检查结果
2.5 细菌内毒素检查
分别选择2个厂家的TAL(灵敏度为0.125 EU/mL),对上述3批样品进行细菌内毒素检查,结果均符合规定。见表4。
3 讨论
对于提高尼可刹米注射液质量控制标准,笔者认为采用细菌内毒素检查法较热原检查法更为合适,可避免热原检查法中尼可刹米所致家兔体温升高的假阳性结果,因此建议厂家用细菌内毒素检查法代替热原检查法对尼可刹米注射液进行质量控制。
[1]国家药典委员会.中华人民共和国药典临床用药须知(化学药和生物制品卷)2005年版[M].北京:人民卫生出版社,2005:54.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:附录ⅪE.
[3]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2005:287.
