氯化锂对A549肺癌细胞增殖及核因子-κBp65表达的影响
2010-05-31李辉张开基李万成
李辉 张开基 李万成
糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3)不但参与肌肉能量储存和新陈代谢,还参与多种生物学效应,如在胚胎发育、细胞分化、细胞周期调节、肿瘤形成等多方面发挥重要作用。GSK-3是WNT信号途径和NF-κB信号系统发生交叉对话(crosstalk)的结合点,研究证实WNT信号途径的异常持续激活参与了包括恶性肿瘤在内多种疾病的发生发展,如大肠癌、黑色素瘤、乳腺癌、胃癌以及肝癌等。在WNT信号通路中GSK-3起着关键负性调节酶作用,它通过促进癌蛋白β-连接素(β-catenin)降解而抑制该信号通路的激活。
但有研究报道,使用GSK-3高选择性抑制剂——锂剂能够诱发多种肿瘤细胞的凋亡,如人髓性细胞白血病细胞系HL-60、人单核细胞白血病细胞系U937和人卵巢癌细胞系A2780等[1],这显然与WNT信号作用相矛盾,是否GSK-3在肿瘤细胞存在有其他信号机制发挥作用有待进一步研究证实。本研究以离体培养的A549人肺腺癌细胞株为实验对象,通过不同浓度氯化锂(LiCL)干预,观察抑制GSK-3对肿瘤细胞的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 人肺腺癌(A549)细胞株由四川大学华西医学中心呼吸实验室提供。DMEM培养基购自美国GIBCO公司;新生小牛血清购自成都哈里生物公司;LiCL为华北制药厂产品;MTT试剂购自美国Sigma公司;SP超敏试剂盒购自福州迈新生物技术公司;NF-κBp65抗体购自长沙三创生物技术有限公司。主要仪器:NUAIRE超净工作台为蚌埠净化设备厂产品,日本Olympus倒置光学显微镜,MS-352全自动酶标检测仪。
1.2 方法 (1)取对数生长期的人肺癌A549细胞株,按1×104/孔、200μl/孔接种至96孔培养板后培养24h,细胞贴壁后加入100μl含培养液的不同浓度LiCl,并保证终浓度分别达到2.5mmol/L(实验1组)、5mmol/L(实验2组)、10mmol/L LiCl(实验3组),另设细胞对照组和空白对照组,每组均设3个复孔。继续培养48h后加入MTT,用酶标仪测定490nm波长处吸光度(A)值,按下列公式计算细胞增殖抑制率:细胞增殖抑制率=(1-A490值/对照组A490值)×100%,实验重复3次。
(2)将A549单细胞悬液接种于有血盖片的六孔培养板中,每孔加入1×105个细胞,培养24h,待细胞完全贴壁时,弃原培养液,根据实验需要实验组加入不同剂量LiCl(均使用DMEM培养液溶解),使实验1组、2组、3组终浓度分别达到2.5,5.0和10.0mmol/L,对照组加入等量DMEM培养基,置CO2孵箱中培养48h。磷酸盐缓冲液洗涤;丙酮固定,免疫组化步骤参照说明书进行,阴性对照采用PBS代替一抗染色。
1.3 结果判定及分析 以细胞核呈明确的棕黄色为阳性染色,使用Nikon光学显微镜对切片观察,用SPOT Cool CCD摄像头进行图像采集。用Image pro plus 4.10版本的专业图像分析软件进行图像分析。每张切片在200倍光学显微镜下随机选取5个视野,每个视野统计100个细胞中的阳性细胞数。
1.4 统计学分析 统计分析采用SPSS13.0软件。实验数据以均数±标准差(±s)表示,统计方法采用方差分析、x2检验等,P<0.05表示差异有显著性统计学意义,P<0.01表示差异有非常显著性统计学意义。
2 结果
2.1 氯化锂对A549细胞MTT值的影响 蓝(MTT)检测法显示了活细胞能量代谢,反应细胞毒性反应。试验组A549细胞分别与不同浓度的氯化锂(2.5~10.0mmol/L)培养48h后,结果显示各个实验组的MTT值显著低于对照组,差异有非常显著的统计学意义(P<0.01),试验组中肿瘤细胞的生长与对照组比较呈剂量依赖关系,其中试验3组细胞增殖抑制率达到48.03%,见表1及图1、图2。
2.2 LiCl对NF-κBp65表达的影响 各组A549细胞均显示出NF-κBp65蛋白表达,主要在胞浆。使用LiCl处理48h后,实验组A549细胞NF-κBp65蛋白表达明显下降,与对照组相比,差异有显著统计学意义(P<0.05)。各实验组之间NF-κBp65蛋白随LiCl浓度上升而表达下降,各实验组之间比较,其表达有明显差异(P<0.05),见表2。
3 讨论
锂是人体非必要微量元素,近年来人们在大量体内外实验中证实,锂剂可对多种肿瘤细胞有抑制增殖和诱导凋亡作用,但其具体作用机制尚不明确。本实验结果发现,以LiCl作用于A549肺癌细胞后,用MTT法发现A549细胞明显凋亡增加且凋亡程度与LiCl浓度呈正相关。
表1 不同浓度氯化锂对A549细胞毒性作用(±s)

表1 不同浓度氯化锂对A549细胞毒性作用(±s)
注:a:与对照组比较,P<0.01;b:与实验3组比较,P<0.01);c:与实验3组比较,P=0.06。
组别 MTT(mmol/L) 细胞增殖抑制率(%)对照组 2.54±0.28试验1组 2.10±0.30abc 17.33实验2组 1.75±0.23ab 31.11实验3组 1.32±0.20a 48.03
表2 不同浓度LiCl对A549细胞iNOS蛋白表达的影响(±s)

表2 不同浓度LiCl对A549细胞iNOS蛋白表达的影响(±s)
注:a: 与对照组比较,P<0.01;b:实验各组间比较,P<0.05。
组别iNOS阳性率(%)对照组 74.2±5.11实验1组 62.4±2.88ab实验2组 53.6±3.20ab实验3组 34.8±3.27ab
NF-κB是属于Rel家族的转录因子,参与调节与机体免疫、炎症反应、细胞分化及凋亡有关的基因的转录。研究显示,肿瘤细胞中存在NF-κB蛋白高表达,这也是肿瘤细胞与正常细胞区别之一[2]。Schwabe等[3]报道NF-κB系统在GSK-3抑制后,其活性受到抑制,并能有效增加肝细胞的凋亡。实验结果表明,各实验组LiCl作用于A549细胞48h后,NF-κBp65表达均明显下降,与对照组比较有非常显著性差异(P<0.01),各实验组间比较有显著性差异(P<0.05);其水平随LiCl浓度增加而降低,证明NF-κB系统受到抑制且与LiCl浓度相关,A549细胞产生的增殖抑制效果可能与此有关。使用氯化锂抑制GSK-3后抑制肿瘤细胞增殖表明,其作用机制是通过抑制NF-κB信号系统发挥作用,而WNT信号途径作用并不明显。
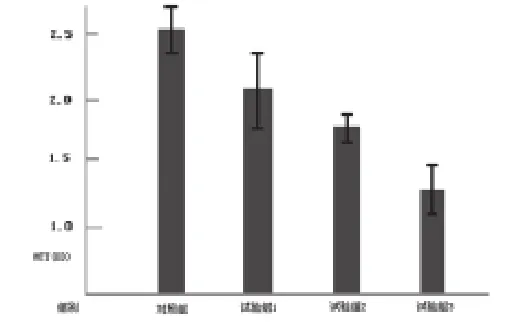
图1 不同浓度LiCl体外作用A549细胞48h后MTT值的影响

图2 不同浓度LiCl对A549细胞增殖抑制 率的影响
[1]钟梅,吴易元,朱岩,等.锂诱导肿瘤细胞凋亡及其机理初探[J].中华微生物学和免疫学杂志,1998,18(1):5-11.
[2]Tsutomu S,Toyokazu M,NavRi W,et al.Nuclear factor-κB dependent exression of metastasis suppressor KAI1/cd82 gene in lung cancer cell lines expressing mutant p53[J].Cancer Res,2001,61(8):673-678.
[3]Schwabe RF,brenner DA.Role of glycogen synthase kinase-3 in TNF--induced NF-B activation and apoptosis in hepatocytes[J].Am J Physiol Gastrointest Liver Physiol,2002,283(1):204-211.