急性淋巴细胞白血病患儿亚甲基四氢叶酸还原酶基因多态性与甲氨蝶呤动态血药浓度相关性的研究
2010-05-30张亚南康熙雄
许 宏,张亚南,康熙雄*
(1.首都医科大学附属北京天坛医院检验科,北京100050;2.首都医科大学附属北京儿童医院检验中心,北京100045)
白血病是儿童发病率较高的恶性肿瘤,其中以急性淋巴细胞白血病(ALL)最为常见,广东省2003年-2004年0岁-18岁青少年恶性肿瘤流行病学调查,白血病位居第一位,年发病率1.36/10万[1]。研究发现ALL与亚甲基四氢叶酸还原酶基因型突变相关[2].亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢途径的限速酶,催化5,10-亚甲基四氢叶酸还原为5甲基四氢叶酸,前者参与DNA合成和修复,后者参与DNA甲基化。MTHFR基因研究较多的2个基因多态位点分别为MTHFR C677T和MTHFR A1298C,这两种基因突变可导致MTHFR活性不同程度减低,进而影响叶酸代谢。
甲氨蝶呤(methylaminopterin,MTX)是抗叶酸代谢药物,大剂量甲氨蝶呤(high-dose methylaminopterin,HDMTX)是治疗儿童急性淋巴细胞白血病的主要治疗药物,尤其在维持治疗及防治髓外白血病中有着极其重要的作用。临床观察治疗过程中相同剂量的MTX用在不同个体时患者的疗效和毒副反应不同,不同的个体对MTX治疗的敏感性及耐受性存在差异,推测叶酸代谢可能影响机体对MTX作用。本研究以ALL患儿为研究对象,探讨MTHFR基因C677T和A1298C基因多态性与大剂量甲氨蝶呤化疗期间的MTX动态血药浓度的相关关系。
1 材料与方法
1.1 研究对象 2009年6月-2010年2月在北京儿童医院血液病房住院的初诊并接受正规化疗的ALL患儿35例,均经骨髓细胞学确诊,其中男19例,女16例,年龄范围在1.5岁-14岁之间,平均年龄5.5±3.6岁。35例患儿根据CCLG-ALL 2008方案临床危险度分为两组:标危组17例,其中男10例,女7例,年龄在2-7岁之间,平均年龄3.53±1.59岁。中危组18例,其中男9例,女9例,年龄范围在1.5岁-14岁之间,平均年龄7.38±4.12岁。化疗前血常规、肝、肾功能均在正常范围内。所有患儿经VDLD诱导方案治疗处于完全缓解状态,应用HD-MTX进行巩固及髓外白血病防治的治疗。
1.2 HD-MTX用法 参见CCLG-ALL 2008方案,标危组采用MTX 2.0 g/m2·次,中危组采用MTX 5.0 g/m2·次,1/6量(不超过500 mg/次)在 30 min内快速静脉滴入,余量在24 h内均匀滴入。化疗期间检测血常规、肝、肾功能,并常规对口腔黏膜、胃肠道以及重要脏器进行保护。化疗后42 h用甲酰四氢叶酸钙(CF)15 mg/(m2·次)解救,每6 h给药 1次,共6-8次。同时检测血清MTX水平,以调整CF的应用次数和剂量,直至血清MTX浓度<0.1 μ mol/L时,停止CF解救。
1.3 MTX药物浓度监测 经HD-MTX治疗预防髓外白血病患儿于静脉滴注MTX后24 h、48 h、72 h采对侧上肢静脉血2 mL,应用TDX荧光偏振免疫分析仪(FPIA,美国雅培公司)检测MTX血药浓度,MTX试剂由雅培公司提供。
1.4 外周血白细胞DNA提取 化疗前抽取每个研究对象静脉血2 ml,EDTA抗凝,提取外周血基因组DNA(爱思进生物技术有限公司)。
1.5 PCR扩增 PCR扩增目的片段的引物分别是MTHFRC677T:F1 5'-TGA AGG AGA AGG TGT CTG CGG GA-3'和F2 5'-AGG ACG GTG CGG TGA GAG TG-3'[3];MTHFRA1298C位点:F1 5'-CTT CTA CCT GAA GAG CAA GTC-3'和F2 5'-CAT GTC CAC AGC ATG GAG-3'[4](上海生工生物工程公司),产物分别为198 bp和256 bp。PCR反应体系含有模板DNA、上游和下游引物、dNTP、缓冲液 (mg2+plus)、Ampli-Taq酶(TaKaRa公司)。MTHFR C677T的PCR反应条件为:94℃4 min,94℃30 s、60℃60 s和 72℃60 s共 35个循环,72℃10 min。MTHFR A1298C的PCR反应条件为:94℃3 min,94℃30 s、56℃30 s、72℃60 s共35个循环,72℃5 min。应用MyCycler(BIO-RAD)仪器进行PCR。
1.6 酶切鉴定 取PCR产物与限制性核酸内切酶HinfⅠ(TaKaRa公司)或MboⅡ(TaKaRa公司)37℃温浴2小时,3%琼脂糖凝胶电泳判定基因型。
1.7 统计学分析 统计分析采用SPSS 11.5统计软件。卡方检验比较不同基因型分布在性别和危险度分组的差异,单因素方差分析比较HD-MTX化疗后MTHFR不同基因型间MTX血药浓度的差异,P<0.05有统计学意义。
2 结果
2.1 MTHFR基因型鉴定
Hinf I识别MTHFR C677T突变T位点,PCR产物酶切后共出现3种基因型(见图1):野生型(CC)198 bp片段;纯合变异型(TT)175 bp、23 bp片段;杂合变异型(CT)198 bp、175 bp及 23 bp片段。23 bp片段分子量太小,显示不清楚。PCR产物经Mbo II酶切后MTHFRA1298C出现3种基因型(见图1):野生型(AA)有 176 bp 、30 bp、28 bp、22 bp 四个片段 ;纯合变异型(CC)204 bp、30 bp、22 bp三个片段;杂合变异型(AC)有 204 bp、176 bp、30 bp、28 bp、22 bp 五个片段。30 bp、28 bp、22 bp片段分子量太小,显示不清楚。

图1 mthfr基因 RFLP分析图
2.2 MTHFR基因型分布
35例ALL的MTHFR C677T基因型分布为:野生型(CC型)4例,突变杂合型(CT型)18例,突变纯合型(TT型)13例。低危组:野生型(CC型)2例,突变杂合型(CT型)6例,突变纯合型(TT型)9例,中危组:野生型(CC型)2例,突变杂合型(CT型)12例,突变纯合型(TT型)4例。MTHFRA1298C基因型分布为:野生型(AA型)25例,突变杂合型(AC型)10例。低危组:野生型(AA型)13例,突变杂合型(AC型)4例,中危组:野生型(AA型)12例,突变杂合型(AC型)6例。MTHFR A1298C基因型CC型未见。最常见的基因型组合是C677 TT/A1298AA(25.71%)和C677 CT/A1298 AA(22.86%),未检出C677 TT/A1298 AC基因型(见表1)。MTHFR C677T以及A1298C基因型分布在临床分组未见差异(分别为P=0.142,P=0.521)。
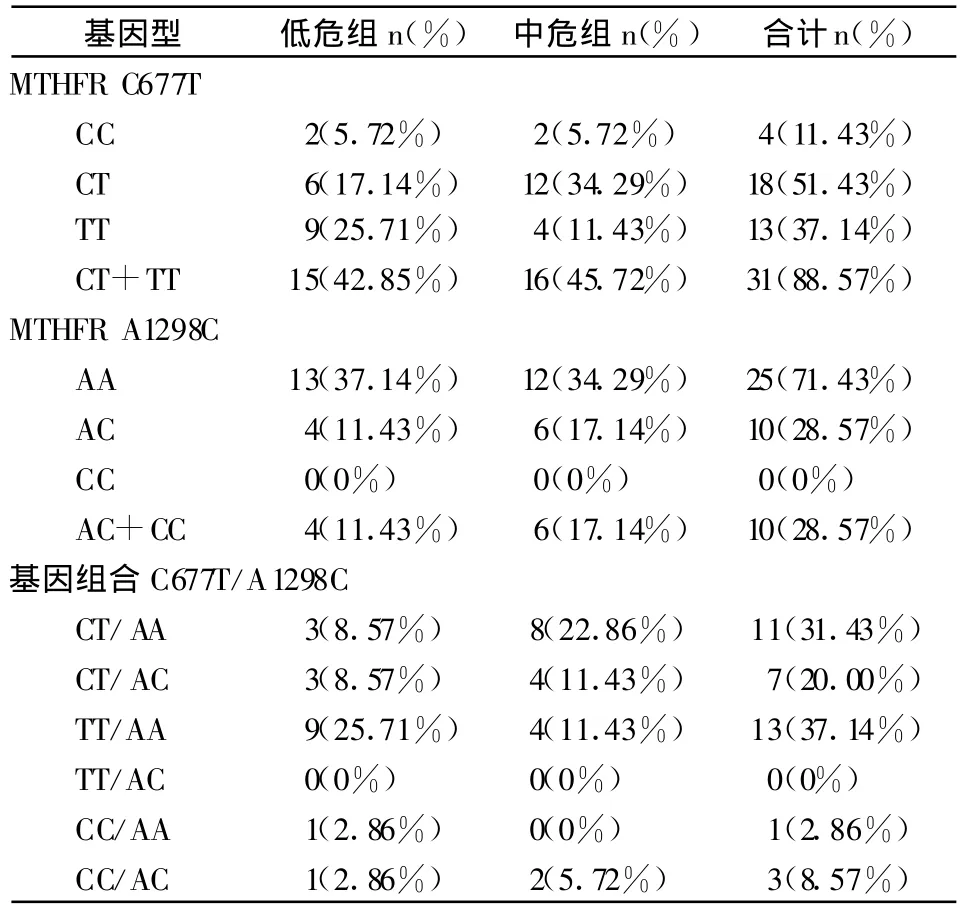
表1 35例ALL患儿MTHFR基因型临床分组
2.3 MTHFR基因突变比率
35例ALL患儿中MTHFRC677T CT+TT基因突变率占88.57%,MTHFR A1298C AC+CC基因突变率占28.57%(表1)。
2.4 MTHFR基因型与HD-MTX化疗后动态MTX浓度的关系
HD-MTX化疗临床危险度分组标危组和中危组的MTX动态血药浓度24 h与48 h、72 h有显著差异(P=0.002)(见表2)。MTHFRC677T基因型24 h的MTX浓度有显著差异(P=0.017)(表3),CT型明显高于CC型及TT型(P=0.025,P=0.016);48 h、72 h的MTX浓度未见差异(见表3)。MTHFR A1298C基因型之间24 h,48 h,72 h的MTX浓度未见差异(P>0.05)(见表3)。
表2 HD-MTX化疗后血清MTX浓度(±s mol/L)

表2 HD-MTX化疗后血清MTX浓度(±s mol/L)
*P<0.05
时间(h)治疗前 24 48 72临床危险度分组标危组 0.01±0.0228.41±19.920.33±0.25 0.20±0.19中危组 0.02±0.0261.61±33.531.17±1.34 0.39±0.59 P值 0.79 0.002* 0.02 0.40
表3 HD-MTX化疗后MTHFR基因型MTX动态浓度(±s mol/L)
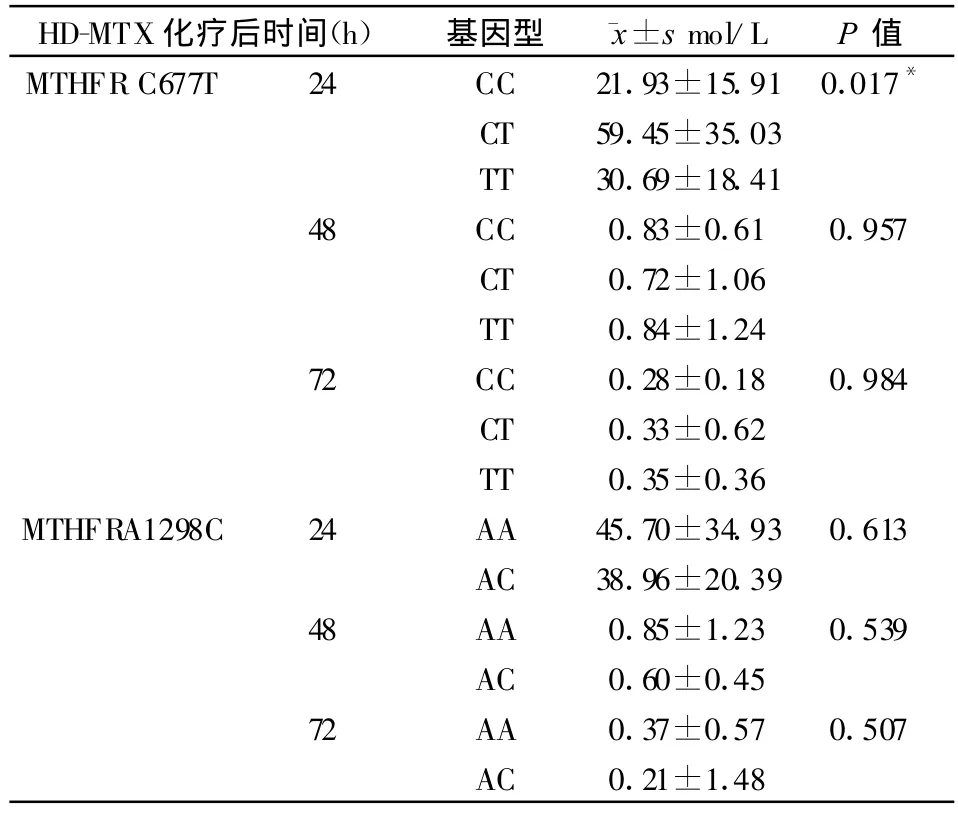
表3 HD-MTX化疗后MTHFR基因型MTX动态浓度(±s mol/L)
*P<0.05
HD-MTX化疗后时间(h)基因型 ±s mol/L P值MTHFR C677T 24 CC 21.93±15.91 0.017*CT 59.45±35.03 TT 30.69±18.41 48 CC 0.83±0.61 0.957 CT 0.72±1.06 TT 0.84±1.24 72 CC 0.28±0.18 0.984 CT 0.33±0.62 TT 0.35±0.36 MTHFRA1298C 24 AA 45.70±34.93 0.613 AC 38.96±20.39 48 AA 0.85±1.23 0.539 AC 0.60±0.45 72 AA 0.37±0.57 0.507 AC 0.21±1.48
3 讨论
MTHFR是研究癌症基因多态性较好的基因之一,研究发现突变频率较高的两个多态位点是MTHFR C677T和A1298C。MTHFR基因多态性与急性淋巴细胞白血病的易感性是否相关尚有争议。德国学者研究从1983到2003年出生人群未见MTHFR基因多态性与ALL相关[5]。但是,Sinnett研究MTHFR基因突变与ALL相关,突变基因型可降低ALL风险,具有保护作用[6],推测怀孕期间服用维生素的孕妇在各国之间的差异(从法国3%到美国90%)是影响研究结论的因素之一,即MTHFR与种族、地域、文化习惯等因素相关。MTHFR各基因型与ALL疾病相关程度也报道不一。我国学者江华等研究发现MTHFR 677CT/TT等基因多态性对儿童ALL的发生具有保护作用,有可能使儿童ALL发生的风险降低3倍,而MTHFR A1298C的各种基因型则与儿童ALL的发生间均无明显相关性[7]。de Jonge等未发现MTHFR A1298C基因对ALL发生风险有任何预防作用,而其他基因还原叶酸载体基因(reduced folate carrier gene,RFC1)和尼克酰胺N-甲基化酶(nicotinamide N-methyltransferase,NNMT)基因多态性可增加ALL发生风险[8]。本研究对ALL患儿MTHFR基因多态性调查发现:①MTHFR保护基因TT/AC和TT/CC及风险基因TT/AA和CT/AA。Thirumaran等[5]调查 460例ALL和1472例对照组没有 TT677/AC1298和TT677/CC1298基因型,本研究ALL也未见这两种基因型,提示这两型基因可能是保护基因。而最多见基因型TT677/AA1298(25.71%)和CT677/AA1298(22.86%),提示这两型基因与其他基因型比较患病风险较高。②ALL患儿MTHFR CT+TT突变频率比成人ALL高。MTHFR C677T CT+TT占88.57%,MTHFR A1298C AC+CC占29%,患儿的MTHFRC677T基因突变型高于成人(65.1%)(P=0.019),MTHFRA1298C基因突变型与成人(28.6%)(P=1.000)相似[9]。③MTHFR基因多态性与临床根据CCLG-ALL 2008方案将病情危险度分组无差异(P>0.05)。基因多态性与ALL病情严重程度无关。
关于MTHFR基因多态性与化疗的敏感性及毒副反应关系也有相关报道。余慧等研究发现具有MTHFR 677 CT突变的个体对于MTX化疗的毒副反应发生率较野生型明显提高,前者的毒副反应发生风险为后者11.3倍[10]。刘晶霞等研究结果显示HD-MTX化疗对拥有MTHFR C677 TT等位基因患者的毒副作用高于携带MTHFR 677 TC等位基因的野生型基因型[9]。然而,Samart等发现MTHFR C677T变异在ALL患儿接受HD-MTX治疗时没有增加MTX导致的毒性的风险性。MTHFR 1298CC基因型降低骨髓抑制的风险性[11],A1298C与MTX毒副反应相关[12]。本研究MTX用药按照ALL诊疗建议临床危险度分组即标危组和中危组用药剂量不同,在化疗期间,患儿肝功、肾功等检测指标均在正常参考范围,未见基因多态性与MTX的毒副作用相关,关于MTHFR基因多态性对ALL患儿MTX毒副反应的影响还有待更多病例调查和进一步研究。HD-MTX化疗期间MTX动态血药浓度研究中发现MTHFR C677T基因型24小时的MTX浓度有差异,CT型明显高于CC型及TT型。MTHFR 677CT和TT突变基因型的酶比活性分别为677C/C基因型的60%和30%[3]且MTHFRC677T TT基因型存在DNA低甲基化[13],四氢叶酸还原酶酶活性降低使叶酸生产减少,导致体内DNA甲基化异常,DNA甲基化异常影响MTX代谢,造成MTX在体内代谢缓慢,推测TT型比CT型代谢慢。而本研究提示甲氨喋呤在MTHFR 677C/T型代谢较缓慢,推测可能是一个位点突变对MTX代谢影响程度较大。
临床用药过程中观察相同剂量的甲氨蝶呤用在不同的患者其毒副反应不一,不同患者对此药的敏感性和耐受程度不同,基因多态性在个体分布差异是造成临床疗效不同的原因之一。监测MTX血药浓度,根据血药浓度作为调整甲酰四氢叶酸钙解救MTX浓度调整CF的应用次数和剂量,对MTX清除缓慢患儿尤为重要,保证疗效和减少甲氨喋呤毒副作用。随着叶酸代谢途径的研究进展,MTHFR基因多态性与ALL易感性关系的研究进展,为ALL个体化治疗提供理论依据。临床治疗ALL前检测MTHFR C677T基因型,预测个体对药物敏感性,在HDMTX给药和CF解救过程中监测和及时调整MTX浓度进行个体化治疗。
[1]马金香,雷毅雄,叶铁真,等.广东省儿童青少年白血病流行特征分析[J].中国预防医学杂志2008,9(4):245.
[2]Aplenc R,Thompson J,Han P,et al.Methylenetetrahydrofolate reductase polymorphisms and therapy response in pediatric acute lymphoblastic leukemia[J].Cancer Research 2005,65(6):2482.
[3]Frosst P,BlomHJ,Milos R,et al.candidate genetic risk factor for vascular disease:a common mutation in methylenetetrahydrofolate reductase[J].Nature Genetics,1995,10(1):111.
[4]Hanson NQ,Aras O,Yang F,et al.C677T and A1298C Polymorphisms of the Methylenetetrahydrofolate Reductase Gene:Incidence and Effect of Combined Genotypes on Plasma Fasting and Post-Methionine Load Homocysteine in Vascular Disease[J].Clinical Chemistry 2001,47:661.
[5]Thirumaran RK,Gast A,Flohr T,et al.MTHFR genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukemia[J].Blood,2010,106(7):2590.
[6]Sinnett D,Labuda D,Krajinovic M.MTHFR gene variant:an example of gene-nutrient interation and susceptibility to childhood acute lymphoblastic leukemia[J].Blood,2010,106(7):2591.
[7]江 华,顾龙君,薛惠良,等.儿童急性淋巴细胞白血病MTHFR基因多态性分析[J].中华血液学杂志,2004,25:439.
[8]de Jonge R,Tissing WJ,Hooijberg JH,et al.Polymorphisms in folate-related genes and risk of pediatric acute lymphoblastic leukemia[J].Blood,2009,113(10):2284.
[9]刘晶霞,陈洁平,谭 文,等.亚甲基四氢叶酸还原酶基因多态性与急性淋巴细胞白血病患者甲氨喋呤化疗毒副反应的研究[J].中国实验血液学杂志,2008,16(3):488.
[10]余 慧,金润铭,白 燕,等.急性淋巴细胞白血病患儿亚甲基四氢叶酸还原酶多态性与氨甲蝶呤毒副反应的研究[J].中华儿科杂志,2005,43(4):302.
[11]Pakakasama S,Kanchanakamhaeng K,Kajanachumpol S,et al.Genetic polymorphisms of folate metabolic enzymes and toxicities of high dose methotrexate in children with acute lymphoblastic leukemia[J].Annals of Hematology,2007,86:609.
[12]Kantar M,Kosova B,Cetingul N,et al.Methyleneterahydrofolate reductase C677T and A1298Cgene polymorphisms and therapy-related toxicity in children treated for acute lymphoblastic leukemia and non-hodgkin lymphoma[J].Leukemia and Lymphoma,2009,50(6):912.
[13]Stren LL,Mason JB,Selhub J,et al.Genomic DNA hypomethylation,a characteristic of most cancers,is present in peripheral leukocytes of individuals who are homozygous for the C677T polymorphism in the methylenetetrahydro2folate reductase gene[J].Cancer Epidemiology Biomarkers and Prevention,2000,9(8):849.
