荔枝核提取物抑制乳腺增生模型大鼠乳腺组织ER和PR表达及促进乳腺细胞凋亡作用研究Δ
2010-05-22林妮吕俊华潘竞锵肖柳英广州市中医医院药剂科广州市51010暨南大学药学院药理研究室广州市5106广州市中医医院广州市中医中药研究所药理研究室广州市51010
林妮,吕俊华,潘竞锵,肖柳英(1.广州市中医医院药剂科,广州市 51010;.暨南大学药学院药理研究室,广州市 5106;.广州市中医医院/广州市中医中药研究所药理研究室,广州市 51010)
乳腺增生病是妇女的一种常见病和多发病,发病年龄集中于20~50岁,50岁以后发病率急剧下降,其发病率占育龄妇女的40%左右,占全部乳房病的75%,是最常见的乳房疾病。现代医学认为,乳腺增生病与内分泌失调有关。
荔枝核含有氨基酸、多糖、总皂苷和黄酮类化合物等活性成分。大量的药理实验和医学临床证实,荔枝核具有降血糖、调血脂、抗氧化作用[1,2]。近年研究表明[3],荔枝核能抑制雌激素性乳腺增生病(HMG)大鼠乳腺组织增生,并调节病鼠性激素水平。本研究拟进一步探讨荔枝核对HMG大鼠乳腺组织雌二醇受体(ER)和孕酮受体(PR)表达及细胞凋亡的作用。
1 材料
1.1 仪器
CX41-32RFL型荧光显微镜(日本Olympus公司);-80℃冰箱(美国Thermo fora公司);XSZ-D型倒置生物显微镜(重庆光学仪器厂);低温高速冷冻离心机(美国Sigma公司);RM2135型切片机(德国Leica公司);FACS 440型流式细胞仪(美国Becton dickinson公司)。
1.2 试药
荔枝核提取物颗粒(广东一方制药有限公司,批号:0604229);苯甲酸雌二醇注射液、黄体酮注射液(天津金耀氨基酸有限公司,批号分别为H20020529、H200205534);乳结平(广东彼迪药业有限公司,批号:H44025162);SABC免疫组化染色试剂盒(批号:SA1026)、DAB显色试剂盒(批号:AR1022)、ER试剂盒(批号:BA0345)、PR试剂盒(批号:BA0107)均购于武汉博士德生物工程有限公司;其余试剂均为国产分析纯。
1.3 动物
SPF级SD未孕大鼠60只,♀,150~180 g,由广东省医学实验动物中心提供(动物合格证号:SCXX(粤)2003-0002)。
2 方法与结果
2.1 模型的复制
[4]复制模型,im苯甲酸雌二醇(0.5 mg·kg-1)25 d后,改im黄体酮(4 mg·kg-1)5 d,即得。
2.2 分组及给药
实验分为6组,即正常(蒸馏水)、模型(蒸馏水)、乳结平(3.3g·kg-1)及荔枝核高、中、低剂量(44 、22、11 g·kg-1)组,于复制模型第31天开始ig给药,连续给药30 d。
2.3 乳头形态学指标测定
实验开始后,连续观察各组大鼠的一般状况,未见大鼠进食、饮水和体质量改变。每周用游标卡尺测量大鼠左侧腋窝下第3对乳头的直径和高度1次。结果表明,复制模型后大鼠乳头出现红肿或增大,经乳结平和荔枝核处理30 d后,病鼠乳头红肿或增生显著减轻(P<0.01)。荔枝核提取物对模型大鼠乳头形态的影响见表1、表2。
表1 荔枝核提取物对模型大鼠乳头直径的影响(,n=10)Tab 1 Effect of ESLon the diameter of nipples in HMG rats(,n=10)
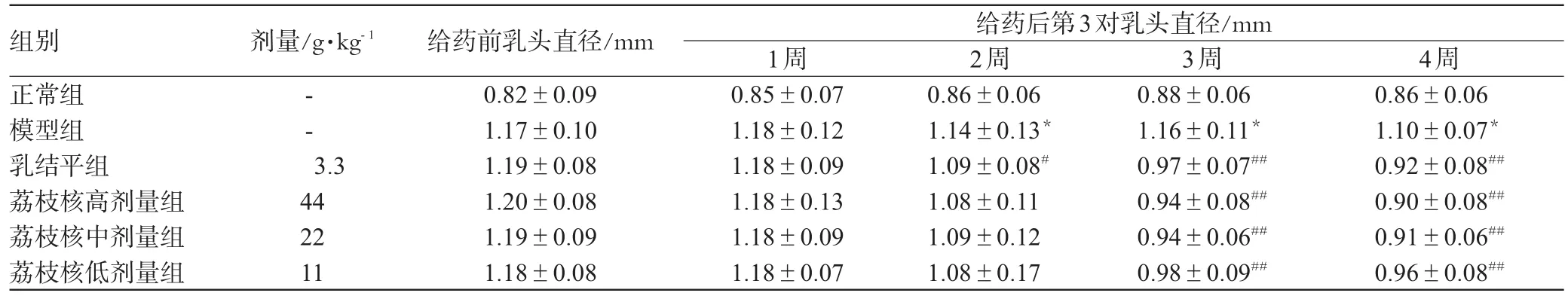
表1 荔枝核提取物对模型大鼠乳头直径的影响(,n=10)Tab 1 Effect of ESLon the diameter of nipples in HMG rats(,n=10)
与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01vs.mormal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
组别正常组模型组乳结平组荔枝核高剂量组荔枝核中剂量组荔枝核低剂量组剂量/g·kg-1给药后第3对乳头直径/mm给药前乳头直径/mm 0.82±0.091.17±0.101.19±0.081.20±0.081.19±0.091.18±0.08--3.34422111周0.85±0.071.18±0.121.18±0.091.18±0.131.18±0.091.18±0.072周0.86±0.061.14±0.13*1.09±0.08#1.08±0.111.09±0.121.08±0.173周0.88±0.061.16±0.11*0.97±0.07##0.94±0.08##0.94±0.06##0.98±0.09##4周0.86±0.061.10±0.07*0.92±0.08##0.90±0.08##0.91±0.06##0.96±0.08##
表2 荔枝核提取物对模型大鼠乳头高度的影响(,n=10)Tab 2 Effect of ESLon the height of nipples in HMG rats(,n=10)

表2 荔枝核提取物对模型大鼠乳头高度的影响(,n=10)Tab 2 Effect of ESLon the height of nipples in HMG rats(,n=10)
与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01vs.mormal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
组别正常组模型组乳结平组荔枝核高剂量组荔枝核中剂量组荔枝核低剂量组给药后第3对乳头高度/mm剂量/g·kg-1--4周1.66±0.071.95±0.14*1.65±0.08##1.70±0.06##1.66±0.16##1.68±0.10##3.3442211给药前乳头高度/mm 1.60±0.092.03±0.111.99±0.082.00±0.121.97±0.091.95±0.091周1.62±0.081.98±0.091.91±0.111.89±0.09#1.91±0.091.93±0.082周1.66±0.072.00±0.08*1.80±0.08##1.82±0.07##1.80±0.06##1.85±0.073周1.68±0.091.97±0.12*1.70±0.10##1.75±0.07##1.74±0.07##1.76±0.06##
2.4 乳腺组织ER和PR检测[3]
末次给药24 h后,按随机数字表法从每组中随机抽取6只大鼠,脱颈处死动物,经乳头基底部最大切面取下大鼠右侧第2对完整乳腺组织,用10%甲醛溶液固定,常规方法进行石蜡包埋,石蜡切片脱蜡脱水;参照文献[4,5]方法进行免疫组化染色并观察结果。ER和PR阳性判断标准为乳腺导管和小叶上皮细胞核着色。阳性细胞率<20%者为(-);阳性细胞率不足20%,但局部区域有少量较强着色的阳性细胞者为(±);阳性细胞率>20%者,按阳性细胞数由少至多、着色由浅至深为+、++、+++、++++,并分别计1、2、3、4、5、6分,积分愈高表明ER和PR含量愈高。结果表明,模型组大鼠乳腺组织ER和PR表达显著增强,与正常组大鼠比较有显著差异(P<0.01);经乳结平和荔枝核给药各组处理后,乳腺组织ER和PR表达显著降低(P<0.01或P<0.05)。荔枝核提取物对模型大鼠乳腺组织ER和PR表达的影响见表3。
2.5 乳腺组织细胞凋亡的检测
取大鼠乳腺组织,于0.5 mL PBS液中剪碎,加入0.125%的胰酶消化液200µL,冰浴中消化5 min,加入含10%牛血清的DMEM培养基200µL停止消化。溶液过200目筛后4℃冷冻,1300 r·min-1离心 5 min,弃上清,细胞沉淀用 PBS液800~1000 r·min-1离心洗涤3次。收集细胞,调整细胞数为约每1 mL含1×106个,于预冷的70%乙醇中固定,4℃下贮藏;检测前以1000 r·min-1离心5 min,弃上清后调整细胞数至每1 mL含1×106个,10 mg·L-1碘化丙啶室温下染色30 min;尼龙网过滤,流式细胞仪检测,经计算机系统Cellquest软件分析,绘制细胞数-DNA分布图,计算凋亡细胞所占比例,用百分比表示。结果表明,正常、模型组大鼠乳腺组织出现的凋亡细胞较少,无显著性差异(P>0.05);荔枝核提取物高、中剂量组大鼠乳腺组织出现较高的凋亡细胞(P<0.01或P<0.05);荔枝核提取物低剂量、乳结平组的凋亡细胞变化较小,无显著差异(P>0.05)。荔枝核提取物对模型大鼠乳腺组织细胞凋亡的影响见表4。
表3 荔枝核提取物对模型大鼠乳腺组织ER和PR表达的影响(,n=6)Tab 3 Effect of ESL on the expression of ER and PR of mammary tissue in HMG rats(,n=6)
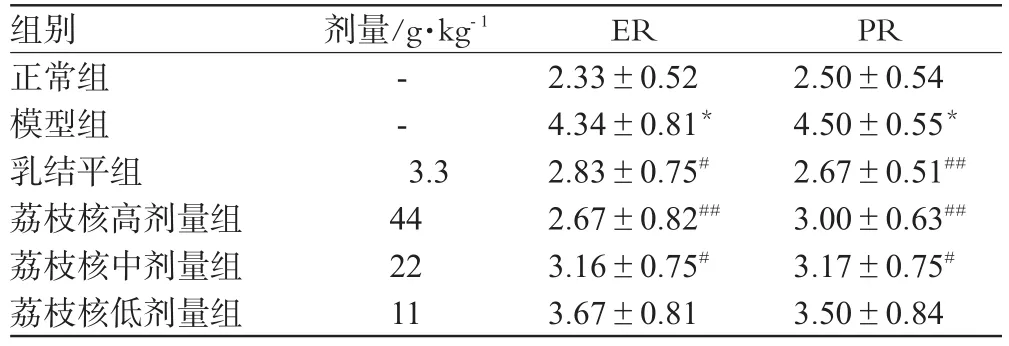
表3 荔枝核提取物对模型大鼠乳腺组织ER和PR表达的影响(,n=6)Tab 3 Effect of ESL on the expression of ER and PR of mammary tissue in HMG rats(,n=6)
与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01vs.mormal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
组别正常组模型组乳结平组荔枝核高剂量组荔枝核中剂量组荔枝核低剂量组PR 2.50±0.544.50±0.55*2.67±0.51##3.00±0.63##3.17±0.75#3.50±0.84剂量/g·kg-1--3.3442211 ER 2.33±0.524.34±0.81*2.83±0.75#2.67±0.82##3.16±0.75#3.67±0.81
表4 荔枝核提取物对模型大鼠乳腺组织细胞凋亡的影响(,n=3)Tab 4 Effect of ESL on apoptosis of mammary glandular cells in H MG rats(,n=3)

表4 荔枝核提取物对模型大鼠乳腺组织细胞凋亡的影响(,n=3)Tab 4 Effect of ESL on apoptosis of mammary glandular cells in H MG rats(,n=3)
与模型组比较:*P<0.05,**P<0.01vs.model group:*P<0.05,**P<0.01
组别正常组模型组乳结平组荔枝核高剂量组荔枝核中剂量组荔枝核低剂量组细胞凋亡率/%28.07±0.7632.33±0.9636.28±1.9556.49±3.35**45.10±8.20*37.34±0.79剂量/g·kg-1--3.3442211
2.6 子宫指数的计算
分别剖取大鼠的子宫称重,与相应大鼠的体质量进行换算,得出子宫指数。结果表明,与正常组比较,模型组大鼠子宫指数显著升高(P<0.01);与模型组比较,荔枝核高、中剂量组大鼠子宫指数显著降低(P<0.05),而荔枝核低剂量组大鼠子宫指数也呈减小趋势,但无显著性差异(P>0.05)。荔枝核提取物对模型大鼠子宫指数的影响见表5。
表5 荔枝核提取物对模型大鼠子宫指数的影响(,n=10)Tab 5 Effect of ESL on uterus index in HMG rats(,n=10)
与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01vs.mormal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
组别正常组模型组乳结平组荔枝核高剂量组荔枝核中剂量组荔枝核低剂量组子宫指数/g·100 g-1 0.24±0.400.52±0.12*0.28±0.09##0.37±0.05#0.39±0.10#0.45±0.12剂量/g·kg-1--3.3442211
3 讨论
随着社会发展,社会竞争加大、心理压力增加、膳食结构不合理等因素使乳腺疾病发病率急剧增加。一直以来,HMG被认为与患者内分泌紊乱、雌激素水平过高及乳腺局部组织对雌激素过于敏感有关。
Strange等[4]证明,雌二醇(E2)和孕酮(P)水平在大鼠的性周期产生变化,并调节乳腺上皮的增殖与凋亡。研究[5]表明,胰岛素生长因子-1、表皮生长因子和性激素通过mTOR通路调节乳腺上皮细胞的自噬作用,使乳腺上皮细胞的增殖与凋亡达到动态平衡。ER和PR是一种蛋白质,对E2和P具有高选择性、高亲和力并与其结合的生理功能特点。当E2升高时,促使正常上皮细胞增殖,致使乳腺增生的发生;另一方面,抑制细胞免疫,使乳腺组织自身修复能力降低,增生的上皮细胞通过激素受体系统使ER合成增加,随之代表ER活性的PR亦增多,随着ER和PR合成的增多,E2进一步刺激引起乳腺上皮细胞的增生和细胞功能活跃。性激素受体ER和PR的检测结果说明了HMG与ER和PR的相关性,显示乳腺良性病变中存在ER和PR,且表达较高。HMG随着增生程度的加重,其ER和PR有显著增加的趋势。当大鼠乳腺组织形态表现为显著增生时,乳腺ER和PR病理积分也显著升高。黄勤等[6]研究表明,雌激素受体显著增多,对雌激素感受性增加,可导致HMG甚至癌变。
本研究结果表明,大鼠经im苯甲酸雌二醇出现乳腺小叶、腺泡上皮增生、导管扩张、间质水肿等病理性改变;后期施用孕酮,进一步促进腺泡发育。说明外源性性激素的异常刺激可造成大鼠乳腺组织的病理性增生,其改变与人体HMG病理类似,成功模拟HMG病理模型。对HMG大鼠乳腺组织ER和PR表达及细胞凋亡、子宫指数的观察,与正常组比较,模型大鼠乳腺组织ER和PR表达显著增强,乳腺组织出现的凋亡细胞较少,子宫指数显著增高;荔枝核3个剂量组均可使模型大鼠乳腺组织ER和PR表达显著降低,乳腺组织出现较高的凋亡细胞或死亡细胞,子宫指数显著减少。由此推测,HMG的发病除了过高的E2直接刺激或P值降低不能保护乳腺组织的作用外,乳腺组织中ER和PR含量增加使组织对性激素的敏感性增强也是此病发生的另一重要因素。
HMG属中医“乳癖”、“乳痞”、“乳中结核”等范畴,临床以乳房疼痛、肿块随月经周期变化为主要特点。病因病机多与情志不调、肝气郁结有关,在辨证分型上常分为肝郁气滞、冲任失调、痰凝血瘀等型。荔枝核具有活血化瘀、软坚散结等功效,在临床上用于治疗HMG取得良好的疗效。本研究表明,荔枝核能不同程度地抑制乳腺组织ER和PR表达,并促进乳腺组织细胞凋亡,改善HMG及子宫的病理变化,从而有效地抑制HMG,调节内分泌。
参考文献
[1]潘竞锵,郭洁文,韩 超,等,荔枝核的药理实验研究[J].中国新药杂志,2000,9(1):14.
[2]林 妮,肖柳英,吕俊华,等.荔枝核提取物抑制大鼠乳腺增生及调节激素水平研究[J].中国临床药理学与治疗学杂志,2009,14(8):861.
[3]洪素兰,芦 锰,张翠英,等.肝舒乐片对乳腺增生病大鼠性激素受体的影响[J].中医研究,2007,20(4):12.
[4]Strange R,Westerlind KC,Ziemiecki A,et al.Proliferation and apoptosis in mammary epithelium during the rat oestrous cycle[J].Acta Physiol(Oxf),2007,190(2):137.
[5]Sobolewska A,Gajewska M,Zarzyńska J,et al.IGF-I,EGF,and sex steroids regulate autophagy in bovine mammary epithelial cells via the mTOR pathway[J].Eur J Cell Biol,2009,88(2):117.
[6]黄 勤,孟凡青.粗针穿刺活检乳腺非恶性增生病变的病理诊断[J].诊断病理学,2005,12(1):70.
