A型禽流感病毒不同拷贝数基质蛋白胞外区基因的原核表达及免疫保护力研究
2010-05-21李洪涛张新涛刘春国杜金玲石薇琳孙恩成
李洪涛 ,张新涛,刘 明,刘春国,杜金玲,石薇琳,2,孙恩成
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感开放实验室及国家禽流感参考实验室/OIE禽流感参考实验室,黑龙江 哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;3.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
禽流感病毒(Avian influenza virus,AIV)一直是危害养殖业的重要致病原[1],该病毒亚型众多,基因组分节段的特点使得其容易发生基因重组,产生不同型的变异株,在人及其它哺乳动物之间引起流感流行。目前应用的疫苗多为基于血凝素(Hemagglutinin,HA)的灭活疫苗及活病毒载体疫苗[2]。在长期的选择压力下HA容易发生抗原漂移甚至抗原变异,往往造成疫苗免疫失败的发生,寻求一种通用免疫原成为近年来通用流感疫苗研究的另一热点。
流感病毒基质蛋白2(Matrix protein 2,M2)是流感病毒的第3种膜蛋白,为非糖基化Ⅲ型跨膜蛋白,该蛋白由97个氨基酸残基组成,N端24个氨基酸残基暴露在膜外,2位~24位氨基酸组成胞外功能区,即M2e。M2蛋白的主要作用是在HA合成过程中作为一种“离子泵”降低并维持细胞高尔基体内的pH,起到离子通道的作用[3],但由于M2作为跨膜的离子通道对宿主有一定的毒害作用,因此,该类疫苗研究主要集中在各个亚型流感病毒间同源性高、序列高度保守的M2e上[4],在疫苗开发中得到越来越多的关注,许多研究已经发现基于M2e的多种疫苗可以提供不同程度的保护力[5-7]。但是禽源M2e的亚单位疫苗在鸡体中的研究很少,本实验构建含不同拷贝数M2e基因的融合蛋白原核表达系统,研究融合蛋白的免疫原性,用纯化蛋白免疫SPF鸡后攻毒试验验证3M2e蛋白的保护力。
1 材料和方法
1.1 病毒株、菌株和细胞 AIV A/Chicken/Guangdong/04(H5N1)(简称CG/04)、大肠杆菌BL21(DE3)感受态细胞由本实验室保存;MDCK细胞培养在含100 mL/L FBS的DMEM培养液中。
1.2 主要试剂 各种限制性内切酶、DNA Marker、dNTP和T4 DNA连接酶购自TaKaRa公司;蛋白分子质量标准0671购自Fermentas公司;pMAL-C2x载体及pMALTM融合蛋白纯化系统购自NEB公司;完全弗式佐剂和不完全弗式佐剂均购自Sigma公司;佐剂MONTANIDETM ISA 70 M购自法国赛比克公司;抗M2单克隆抗体(MAb)14C2购自Santa Cruz公司;异硫氰酸荧光素(FITC)标记的山羊抗兔抗体购自Pierce公司;抗MBP MAb购自NEB公司;封闭缓冲液和IRDyeTM700DX荧光标记的山羊抗小鼠二抗IgG购自Rockland公司;碱性磷酸酶标记的羊抗鸡IgG抗体购自北京中杉金桥生物技术有限公司;质粒小量提取试剂盒及凝胶回收试剂盒购自Axygen公司;硝酸纤维素膜购自上海华舜生物工程公司。
1.3 实验动物 6周龄SPF鸡、新西兰家兔均购自中国农业科学院哈尔滨兽医研究所实验动物中心,饲养于隔离器中。
1.4 引物设计及不同拷贝数M2e基因的获得 参照GenBank登录的H5N1亚型AIV M2e序列,利用Oligo6.0软件设计引物M2e/F1和M2e/R1,以此互为引物和模板产生序列M2e/F1-R1,再以此为模板,与设计合成的另一对引物M2e/F2和M2e/R2(表1),扩增单拷贝的M2e序列。以单个M2e为基础,顺次串联多个M2e拷贝,制备3M2e、6M2e、9M2e和12M2e不同拷贝数的目的片段。

表1 PCR扩增用引物Table 1 Primers used in PCR amplification
1.5 重组质粒的构建和鉴定 重组质粒构建和鉴定参照文献[8]方法进行,构建的重组质粒分别命名为p-M2e、p-3M2e、p-6M2e、p-9M2e 和 p-12M2e。
1.6 融合蛋白的诱导表达及SDS-PAGE鉴定 分别挑取阳性重组质粒的单菌落及载体质粒pMAL-C2x单菌落,分别接种于LB培养液(Amp+)中,37℃振荡培养至合适浓度,然后以1∶100稀释后转接于80 mL LB培养液中,37℃振摇2 h~3 h至A600nm=0.6,加入终浓度为0.3 mM/L的IPTG,16℃诱导12 h后收获菌液,进行SDS-PAGE分析。
1.7 融合蛋白的纯化及western blot分析 按照pMALTM融合蛋白表达及纯化试剂盒说明书,利用直链淀粉树脂柱纯化融合蛋白[8]。
将纯化的融合蛋白SDS-PAGE电泳后转移至硝酸纤维素膜,封闭过夜,以抗MBP MAb(1∶104稀释)、M2 MAb 14C2(1∶103稀释)作为一抗,再 以IRDyeTM700DX荧光标记的山羊抗小鼠IgG作为二抗,进行western blot分析。
1.8 动物免疫和多克隆抗体的制备 将纯化的融合蛋白(1 g/L)与完全弗式佐剂等体积乳化,背部皮下多点初次免疫家兔(200 μL/只)。SPF鸡平均分为7组(8只/组),分别将不同的蛋白抗原以2.6∶7.4的体积比加入佐剂MONTANIDETM ISA 70 M中,乳化后颈部皮下免疫SPF鸡(150 μL/只),另一组设为阴性对照组,免疫前采集分离阴性血清,以后每隔3周加强免疫两次,加强免疫采用不完全弗式佐剂乳化融合蛋白,3次免疫一周后采血分离血清,储存于-20℃备用。
1.9 间接免疫荧光试验(IFA) 将MDCK细胞培养于96孔板,待生长至单层时用PBS洗涤,加入100 TCID50AIV(100 μL/孔)37 ℃感作 12 h;PBS 洗涤后用甲醛固定液室温固定10 min;PBS洗涤,加入0.5 mL/L Triton-100浸透液室温浸透 20 min;用PBS洗涤,加入阴性兔血清及免疫兔血清(1∶100稀释,100 μL/孔)37℃作用1.5 h;PBS洗涤,加入FITC标记的山羊抗兔荧光二抗(1∶200稀释,100 μL/孔),37℃作用45 min;PBS洗涤,于倒置荧光显微镜下观察。
1.10 间接ELISA测定鸡血清抗体水平 将MDCK细胞培养于96孔板,待生长至单层时用PBS洗涤,加入100 TCID50AIV(100 μL/孔)37℃感作1 h,加入完全培养基(200 μL/孔)4℃孵育过夜,次日用PBST洗涤,用甲醛固定液室温固定20 min;PBST洗涤,加入5 mL/L脱脂乳,37℃封闭1 h,PBST洗涤,加入鸡血清(1∶100稀释,100 μL/孔)室温孵育2 h,加入碱性磷酸酶标记的羊抗鸡IgG抗体(1∶5000稀释)室温孵育1 h,加入PNPP室温显色10 min,最后用 0.5 M NaOH(50 μL/孔)终止反应,测定OD405nm值。
1.11 SPF鸡攻毒保护试验 SPF鸡按照1.8方法免疫后一周,用1×106EID50的AIV CG/04攻毒,观察记录SPF鸡的生长状态和存活率。
2 结 果
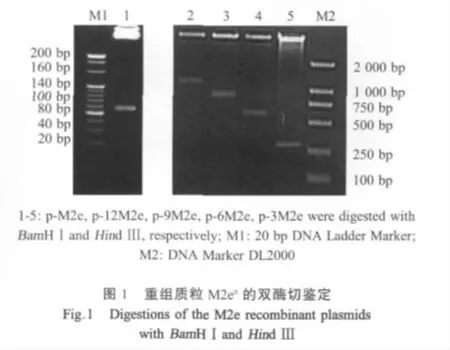
2.1 目的片段的获得和重组质粒的构建与鉴定 重组质粒经BamHⅠ和HindⅢ双酶切后进行琼脂糖凝胶电泳鉴定,分别在约 100 bp、300 bp、600 bp、900 bp和1200 bp的位置出现目的条带,其大小与预期值相符(图1),同时经测序验证序列正确。
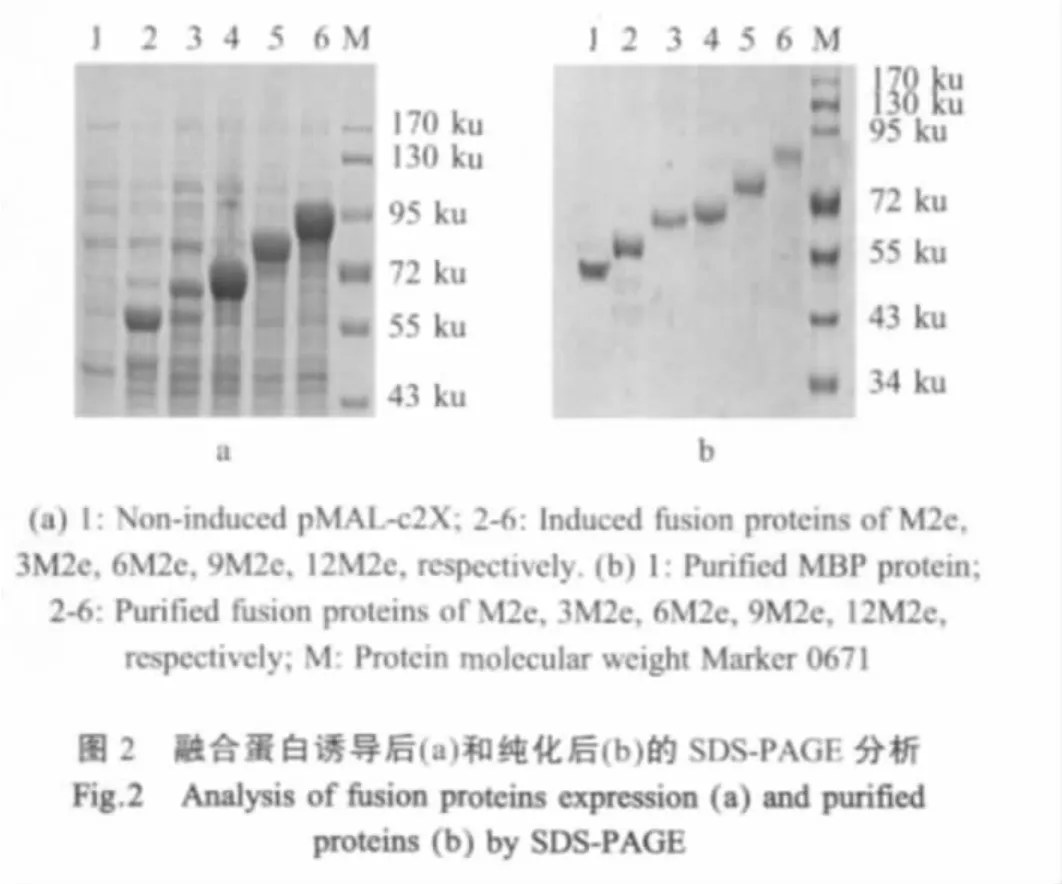
2.2 融合蛋白的表达和纯化分析 IPTG诱导融合蛋白表达后的SDS-PAGE电泳显示,与未诱导的pMAL-C2x相比,均出现一条新的蛋白条带,其大小与推测的融合蛋白分子量相一致(图2a)。收集细菌裂解的上清纯化,纯化后进行SDS-PAGE分析,结果显示目的蛋白均得到了高度纯化(图2b)。
分别用抗MBP和抗M2的MAb进行western blot分析,结果显示不同的融合蛋白均在相应大小处出现与SDS-PAGE大小一致的单一条带(图3)。
2.3 M2e多克隆血清抗体的IFA试验 将家兔阴性血清、阳性血清分别作为抗体感作,按照常规方法进行IFA试验,结果表明在用阳性血清感作的MDCK细胞中检测到荧光,而阴性家兔血清感作的MDCK细胞未检测到荧光(图4),表明融合蛋白具有良好的免疫原性。

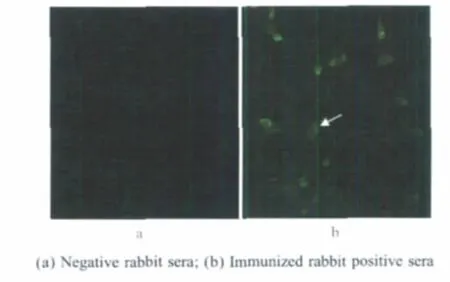
图4 IFA检测家兔多克隆血清抗体的免疫原性(100×)Fig.4 Identification of the immunogenicity of anti-rabbit polyclonal sera by IFA(100×)
2.4 间接ELISA 按照间接ELISA方法监测不同SPF鸡免疫组抗体水平差异(图5)。

2.5 SPF鸡攻毒后的免疫保护力 SPF鸡攻毒后,从第3 d起陆续死亡,出现高致病性AIV感染的典型症状。MBP-3M2e免疫组可以保护37.5%的鸡存活,而MBP-6M2e、MBP-9M2e和MBP-12M2e免疫组只保护12.5%的鸡存活,而阴性对照组攻毒后第2 d~第 5 d全部死亡(图6)。
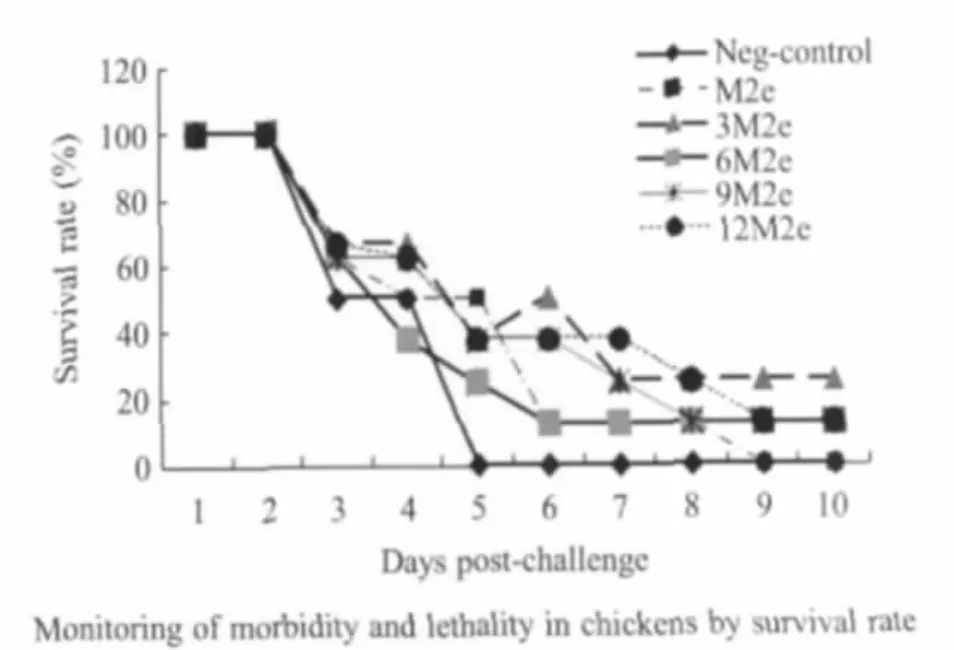
图6 不同M2e亚单位疫苗对SPF鸡的免疫保护力Fig.6 SPF chickens immunized with different M2e subunit vaccines protected against CG/04 challenge
3 讨 论
近年来,许多研究已经证实M2e作为疫苗株候选抗原的可行性,针对M2e的免疫学研究发现,融合M2e的疫苗能够诱发抵抗人流感病毒的广谱保护性免疫,诱导产生针对活病毒的特异性抗体保护[9],是一种潜在的交叉保护性抗原[10]。尤其是欧洲研究小组的流感通用疫苗研究计划均取得了良好的试验结果,某些已进入Ⅰ期临床试验阶段[11]。
M2e分子量小,使得其免疫原性较弱,有研究表明多拷贝的M2e偶联至适合的载体或辅以免疫佐剂后,可以诱导更强的免疫反应,产生更强的免疫保护作用[12-15],本实验采用密码子优化的禽源M2e基因产生多拷贝M2e基因,通过原核表达系统构建含A型AIV不同M2e拷贝的重组质粒后表达融合蛋白,该蛋白具有良好的免疫原性。
我们先前构建以pET30a为载体的重组质粒,在不同诱导条件下均未获得蛋白表达(数据未发表),而利用pMAL-c2X载体获得了较好的可溶性表达,诱导条件经过优化确定在IPTG浓度0.3 mM/L,16℃诱导9 h~12 h呈现最大蛋白表达量。免疫SPF鸡监测抗体水平的差异显示,随着M2e密度的增加,抗体水平呈现升高趋势,但是并不呈连续梯度性增加,其中免疫3M2e蛋白组抗体水平最高。在攻毒试验中,3M2e也表现出最好的保护效力,这与Liu等的实验保护力与M2e基因拷贝数成正相关的结果不同[12]。分析原因,一是所用病毒不同,Liu的试验中采用了流感病毒A/PR/8/34,而我们选用的AIV CG/04是对小鼠和SPF鸡均成高致病性的流感病毒[12,16];其次,免疫鸡体激发的免疫应答也不同于小鼠等动物模型;此外,MBP作为标签相对较大,在结构和构象上可能会影响到抗原表位与病毒的有效接触,干扰蛋白的抗病毒作用。
本研究表明该类M2e亚单位疫苗在鸡体中有一定的免疫保护力,但不稳定,其它研究人员构建的不同M2e疫苗表现的免疫保护力不一致[14,17-18],在防控AIV方面仍需进一步的研究和探索。
[1]Monto A S.The threat of an avian influenza pandemic[J].N Eng J Med,2005,352(4):323-325.
[2]Chen H,Bu Z.Development and application of avian influenza vaccines in China[J].Curr Top Microbiol Immunol,2009,333:153-162.
[3]Lamb R A,Zebedee S L,Richardson C D.Influenza virus M2 protein is an integral membrane protein expressed on the infected-cell surface[J].Cell,1985,40(3):627-633.
[4]Schnell J R.Structure and mechanism of the M2 proton channel of influenza A virus[J].Nature,2008,451(7178):591-595.
[5]De Filette M,Min J W,Birkett A,et al.Universal influenza a vaccine:optimization of M2-based constructs[J].Virology,2005,337(1):149-161.
[6]De Filette M,Martens W,Smet A,et al.Universal influenza a M2e-HBc vaccine protects against disease even in the presence of pre-existing anti-HBc antibodies[J].Vaccine,2008,26(51):6503-6507.
[7]Mozdzanowska K,Feng J,Eid M,et al.Induction of influenza type a virus-specific resistance by immunization of mice with a synthetic multiple antigenic peptide vaccine thatcontains ectodomains of matrix protein 2[J].Vaccine,2003,21(19-20):2616-2626.
[8]张新涛,刘明,刘春国,等.A型禽流感病毒M2蛋白胞外功能区(M2e)的原核表达和免疫原性分析[J].中国兽医科学,2010,40(04):357-362.
[9]Wu F,Huang J H,Yuan X Y,et al.Characterization of immunity induced by M2e of influenza virus[J].Vaccine,2007,25(52):8868-8873.
[10]Fan J,Liang X,Horton M S,et al.Preclinical study of influenza virus A M2 peptide conjugate vaccines in mice,ferrets,and rhesus monkey[J].Vaccine,2004,22(23-24):2993-3003.
[11]Fiers W,Filette M D,Bakkouri K E,et al.M2e-based universal influenza A vaccine[J].Vaccine,2009,27(45):6280-6283.
[12]Liu W,Peng Z,Liu Z Q,et al.High epitope density in a single recombinant protein molecule of the extra cellular domain of influenza A virus M2 protein significantly enhances protective immunity[J].Vaccine,2004,23(3):3663-3671.
[13]Eliasson D G,El Bakkouri K,Schon K,et al.CTA1-M2e-DD:A novel mucosal adjuvant targeted influenza vaccine[J].Vaccine,2008,26(9):1243-1252.
[14]De Filette M,Ramne A,Birkett A,et al.The universal influenza vaccine M2e-HBc administered intranasally in combination with the adjuvant CTA1-DD provides complete protection[J].Vaccine,2006,24(5):544-551.
[15]De Filette M,Fiers W,Martens W,et al.Improved design and intranasal delivery of an M2e-based human influenza A vaccine[J].Vaccine,2006,24(44-46):6597-6601.
[16]刘春国,闫丽辉,曹殿军.病毒样颗粒技术应用的研究进展[J].中国预防兽医学报,2005,27(2):157-160.
[17]Zhang G G,Li D X,Hui H Z,et al.Enhancement of mucosal immune response against the M2e HBc+antigen in mice with the fusion expression products of LTB and M2e HBc+through mucosal immunization route[J].Vet Res Commun,2009,33(7):735-747.
[18]Rangel-Moreno J,Carragher DM,Misra R S,et al.B Cells promote resistance to heterosubtypic strains of influenza via multiple mechanisms[J].Immunology,2008,180(1):454-463.
