食品中弓形虫和旋毛虫液相基因芯片检测方法的研究
2010-05-21杨朋欣张子群路义鑫韩彩霞李晓云宋铭忻
杨朋欣,张子群,路义鑫,韩彩霞,李晓云,宋铭忻*
(1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.黑龙江出入境检验检疫局,黑龙江 哈尔滨 150036)
弓形虫(Toxoplasma gondii)和旋毛虫(Trichinella spiralis)均为重要的食源性寄生虫[1]。人若进食含有以上2种寄生虫不同发育阶段的虫体或卵(囊)的食品,会导致发生食源性弓形虫或旋毛虫感染。弓形虫几乎可以感染各种温血动物,人感染弓形虫除影响生育外,还会引发多种疾病[2]。据报道,全球约10亿人感染弓形虫,我国感染人数达6000万[3-4]。旋毛虫为肉品卫生检验中的必检项目,人体感染旋毛虫严重者会导致心肌炎等疾病甚至死亡,我国旋毛虫感染高发区主要在云南、河南、湖北和东北三省[6-8]等地区。因此,加强食源性寄生虫的检测是十分迫切和必要的。
目前,我国诊断食源性寄生虫的方法较多,但是大多为一次仅检测一种虫体,在很大的程度上限制了食源性寄生虫的快速检测和鉴定。因此,有必要建立一种灵敏、特异、高通量的检测方法。液相基因芯片技术是美国Luminex公司开发的一种新型检测型生物芯片技术[5-6],已应用于微生物检测等领域,具有高通量多指标同步分析、操作简便、灵敏性和重复性好等优点。本研究以弓形虫B1基因及旋毛虫18S rDNA基因为靶序列,设计特异性引物,建立高效、灵敏、特异的液相基因芯片检测方法,为食源性寄生虫的检测提供新方法。
1 材料和方法
1.1 虫株、载体与菌株 弓形虫基因组DNA由兰州兽医研究所惠赠;旋毛虫为本实验室保种;载体pMD18-T购自TaKaRa公司;大肠杆菌感受态菌株DH5α为本实验室保存。
1.2 主要试剂及仪器 链霉素-亲和素-藻红蛋白(SAPE)、表面羧基化的荧光编码微球购自上海透景生物科技有限公司;Luminex100液体悬浮点阵检测仪为美国Luminex公司产品。
1.3 探针及引物的设计与合成 根据GenBank登录的弓形虫B1基因(EU340879)和旋毛虫18S rDNA基因(AY497012)的序列,分别选择保守区域应用DNAStar软件设计探针,并根据探针位置,应用Primer5.0软件设计引物(表 1)。探针 5'端均添加poly T11尾并氨基化,同时将两条用于杂交的生物素标记的探针互补链作为阳性对照,上游引物5'端均采用生物素标记。探针和引物均由上海桑尼生物有限公司合成。
1.4 目的基因的克隆与重组质粒的鉴定 采用试剂盒方法提取旋毛虫基因组DNA,分别以弓形虫和旋毛虫基因组DNA为模板,进行PCR扩增,设阴性对照,反应条件为:95℃5 min;94℃30 s、58℃30 s、72℃40 s,30个循环;72℃10 min。琼脂糖凝胶电泳鉴定PCR产物。目的片段经过纯化分别克隆到pMD18-T载体中,并转化感受态细胞DH5α,PCR方法筛选阳性重组质粒,测序鉴定。

表1 引物和探针序列及扩增产物大小Table 1 The sequences of primers and probes and the size of product
1.5 双重PCR反应 以两种虫体基因组DNA为模板,进行双重PCR扩增,反应体系为:10×PCR Buffer 2.5 μL,dNTP(各 2.5 mmol)2.0 μL,上、下游引物(10 μmol/L)为弓形虫各 0.5 μL、旋毛虫各0.8 μL,模板 DNA 各 0.5 μL,rTaqDNA 聚合酶0.5 μL。反应条件为:95℃ 5 min;94℃ 30 s、58.5℃ 30 s、72℃ 45 s,30个循环;72℃ 8 min。琼脂糖凝胶电泳鉴定双重PCR产物。
1.6 液相基因芯片的制作 购置表面带有活性羧基化基团编号为35和38的两种微球,将B1基因探针和18S rDNA基因探针分别与35号和38号微球耦联,命名为Ⅰ和Ⅱ,耦联步骤由上海透景生物有限公司完成,并采用生物素标记的探针互补链测定耦联率。
1.7 液相基因芯片检测体系的建立 分别取单重和多重 PCR 产物各 3 μL,加入 7 μL TE 溶液和 20 μL稀释的微球溶液,95℃变性5 min,50℃孵育20 min,加入80 μL荧光素,50℃孵育20 min,于Luminex100液体悬浮点阵检测仪读取各微球检测的荧光强度值。
1.8 重复性试验 采用PCR方法分别扩增弓形虫和旋毛虫的基因组DNA,以液相基因芯片体系检测各PCR产物荧光强度,在相同的试验条件下重复6次,并对结果进行分析,验证本方法的重复性。
1.9 特异性试验 分别以弓形虫和旋毛虫引物扩增弓形虫、旋毛虫、猪囊尾蚴(Cysticercus cellulose)和华支睾吸虫(Clonorchis sinensis)的基因组DNA,应用液相基因芯片体系检测各PCR产物的荧光强度,并对结果进行分析,验证本方法的特异性。
1.10 敏感性试验 对弓形虫和旋毛虫PCR扩增产物进行2-n倍比稀释,每种产物稀释12个梯度,分别应用琼脂糖凝胶电泳和液相基因芯片体系检测,比较两者的敏感性。
1.11 人工模拟污染试验 分别提取弓形虫、旋毛虫和检疫合格猪肌肉组织的基因组DNA,将猪基因组DNA分装入30个EP管中:其中20个管加入一种虫体基因组DNA;8个管加入两种虫体的混合基因组DNA;另外2个管为对照组。将30个EP管随机编号,应用弓形虫和旋毛虫的混合引物分别扩增,对液相基因芯片检测结果进行分析。
2 结 果
2.1 目的基因的克隆与重组质粒的鉴定 应用PCR方法分别从弓形虫与旋毛虫基因组DNA中扩增出约200 bp和100 bp的DNA片段(图l),与预期大小相符。测序结果显示,弓形虫B1基因和旋毛虫18S rDNA基因与GenBank登录的相关基因相似性分别为99.47%和100%,表明目的片段已插入克隆载体中,构建了弓形虫和旋毛虫的重组质粒。
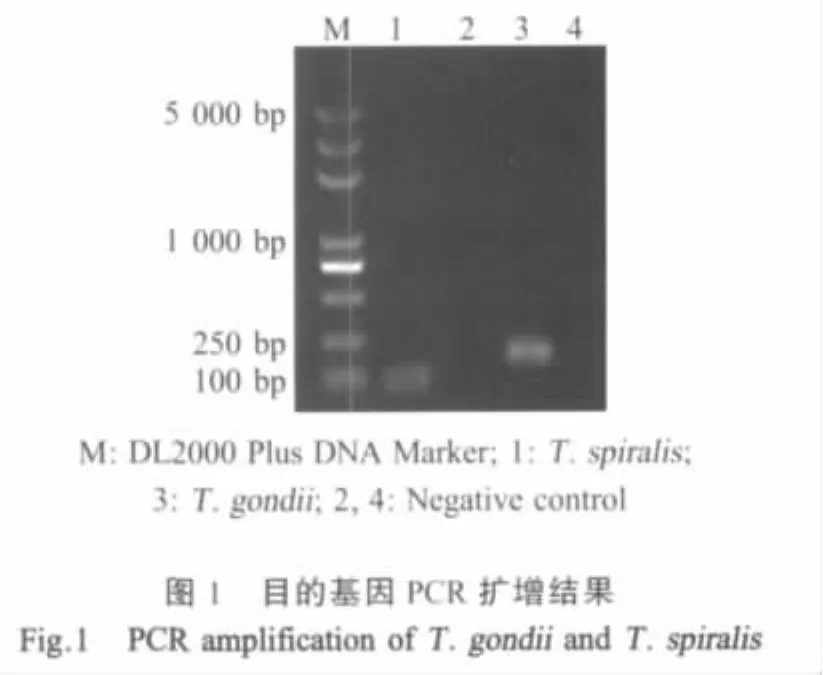

2.2 双重PCR扩增 应用双重PCR方法由弓形虫与旋毛虫混合基因组DNA中扩增出约200 bp和100 bp的DNA片段(图2),与预期大小相符,表明双重PCR扩增产物正确。
2.3 液相基因芯片体系检测结果 应用生物素标记的探针互补链测定液相基因芯片Ⅰ和Ⅱ,检测耦联率较高,表明Ⅰ和Ⅱ可以在该体系中应用。液相基因芯片体系检测单重PCR和双重PCR产物结果表明:阴性和阳性的荧光强度检测值与琼脂糖凝胶电泳结果一致(图略),两种虫体检测过程的信噪比分别为72.72和75.11,表明荧光信号值明显高于背景值,视为有效结果;双重PCR产物检测结果与单重PCR产物检测结果一致(表2)。

表2 液相基因芯片检测PCR产物Table 2 PCR products detected by liquid gene chip
2.4 重复性试验 在相同试验条件下,重复检测6次,计算各批间平均荧光强度值的变异系数(CV)。重复性检测结果显示各变异系数均在7%以内(表3),表明该方法具有良好的重复性和稳定性。

表3 液相基因芯片检测单重PCR产物重复性试验Table 3 Reproducibility tests of liquid gene chip for PCR products
2.5 特异性试验 特异性检测结果显示,扩增虫体混合基因组DNA的PCR产物荧光强度值呈阳性,而扩增猪肉基因组DNA的PCR产物荧光强度值均呈阴性(表4),表明该方法具有较好的特异性。

表4 液相基因芯片特异性试验Table 4 Specificity tests of liquid gene chip
2.6 敏感性试验 比较液相基因芯片体系和琼脂糖凝胶电泳检测结果的灵敏性,结果表明液相基因芯片体系比琼脂糖凝胶灵敏度高约8倍,检测弓形虫和旋毛虫的最低限可达原液的2-8(图3)和2-9(图4),灵敏度分别为65.6 ng/mL和53.52 ng/mL。
2.7 人工模拟污染试验结果 应用建立的液相基因芯片体系检测30个随机编号的待检样品,结果显示30份样品中阳性率为90%(27/30);阴性率为7%(2/30);阳性检出率为96%;阴性检出率均为100%,盲测结果准确率达98%以上,与预期的结果基本相符,表明该方法在实际操作中具有一定的可行性。
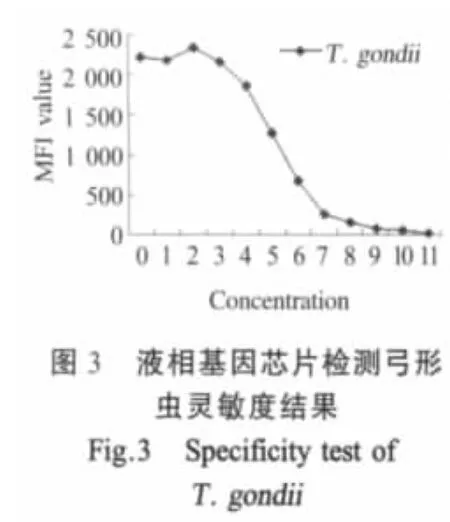
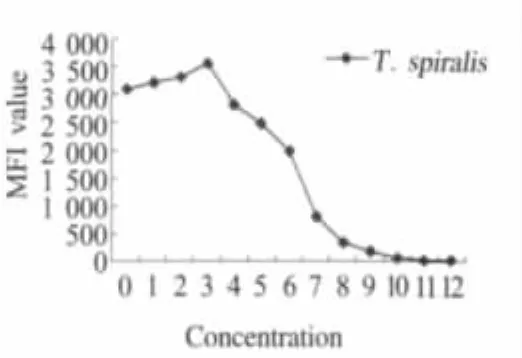
图4 液相基因芯片检测旋毛虫灵敏度结果Fig.4 Specificity test of T.spiralis
3 讨论
近年来,尽管建立了多种食源性寄生虫的检测方法,但均为“单一”法,本研究建立的液相基因芯片方法打破了传统“一对一”的检测方式,可快速进行高通量、多指标同步分析,为特异性强、灵敏性和重复性好的新方法。
在建立方法过程中,基因的选择和探针的设计至关重要。核糖体DNA(rDNA)是细胞核内编码核糖体RNA的基因,为一类中度重复序列,每个重复单位由非转录间隔区(NTS)、内转录间隔区(ITS)和3种核糖体基因编码区(18S、5.8S、28S)组成[7],不同区域进化速率不同,而且十分保守。因此,本研究选择旋毛形线虫18S基因作为检测的靶基因。虽然弓形虫B1基因的生物学功能尚不清楚,但该基因是一种多拷贝基因,并且序列高度保守,是目前鉴定弓形虫最为理想的目的基因之一[8]。本方法能够特异地对弓形虫和旋毛虫PCR产物进行检测,检测的线性范围广,检测荧光强度的CV值控制在统计学有效范围内,本实验结果均证明该方法具有良好的稳定性。在验证液相基因芯片灵敏度时,发现PCR产物初始浓度的荧光值并非最高,而是随浓度的降低呈先升高后下降的趋势,这种变化在其它文献中尚未报道,暂将其称作液相基因芯片所需PCR产物的最适浓度。虽然本研究在人工模拟污染试验中取得较好的结果,但在检测实际样本方面,还有待进一步验证。总之,液相基因芯片技术的开发及应用将改变食源性寄生虫检测的现状,该方法的建立为食源性寄生虫的检测提供了实验依据。
[1]甘绍伯.病原生物学与感染性疾病[J].中国热带医学,2006,6(12):2103-2114.
[2]许隆祺,余森海,徐淑惠.中国人体寄生虫分布与危害[M].北京:人民卫生出版,2000.
[3]薛纯良.孕期弓形虫感染的诊断、治疗和预防[J].中国寄生虫学与寄生虫病杂志,2000,18(1):55-61.
[4]Bastien P.Molecular diagnosis of Toxoplasmosis[J].Trans R Soc Trop Med Hyg,2002,96(Sl):205-215.
[5]夏骏,邓菲,金润铭,等.液相芯片MASA技术用于儿童呼吸道感染病原学研究[J].中国病毒学,2005,20(6):586-589.
[6]Kellar K L,Iannone M A.Multiplexed microsphere-based flow cytometric assays[J].Exp Hematol,2002,30:1227-1237.
[7]董晓波,李冬梅,花丽茹,等.旋毛虫ITSⅡ区基因的克隆及其在分类学上的应用[J].畜牧兽医学报,2006,37(2):173-175.
[8]单连玉.PCR技术诊断弓形虫病的研究进展[J].国外医学寄生虫病分册,2002,29(2):58-65.
[9]路义鑫,宋铭忻.各隔离株旋毛虫感染性的研究[J].动物医学进展,2003,24(3):82-84.
