低有机负荷率下聚磷好氧颗粒污泥的培养
2010-05-10李金娟
黄 宇,赵 林,,谭 欣,,董 涛,李金娟
(1. 天津大学环境科学与工程学院,天津 300072;2. 天津大学化工学院,天津 300072)
好氧颗粒污泥是在微生物自凝聚作用下形成的生物聚集体,与普通絮状活性污泥相比,好氧颗粒污泥具有结构紧凑坚固、沉降性能好、微生物量高等优点,已成为污水处理领域的研究热点.但是,目前对于好氧颗粒污泥还只停留在实验室研究上,这主要是由于好氧颗粒污泥的稳定性较差,长期运行易发生颗粒解体.如何提高好氧颗粒污泥的稳定性是该项技术能否应用于实际的关键.
目前对于好氧颗粒污泥的培养多采用序批式反应器(sequencing batch reactor,SBR)[1],在高有机负荷率下,以短沉淀时间为选择压,筛选出沉降性能好的污泥,而沉降性能差的污泥则随出水排出反应器.高有机负荷率可以加速微生物的生长,从而弥补短沉淀时间引起的污泥的大量流失.这种培养方式虽然有利于好氧颗粒的快速形成,但是生长速率过快也是导致颗粒稳定性差的重要原因.据报道,筛选缓慢生长的微生物将有助于改善好氧颗粒的稳定性[2].de Kreuk等[3]通过降低反应器内的溶解氧浓度,从而减缓体系中微生物的生长速率,使得形成好氧颗粒的沉降性能和稳定性都得到了改善.因此,微生物的生长速率可能是影响好氧颗粒稳定性的关键因素.
聚磷好氧颗粒污泥是以聚磷菌(phosphate accumulating organisms,PAOs)为主体,能够实现强化生物除磷(enhanced biological phosphorus removal,EBPR)功能的一类好氧颗粒污泥.为了控制反应器内微生物的生长速率,从而提高稳定性,本文考察了在低有机负荷率下培养聚磷好氧颗粒污泥的可行性及其关键培养技术,并对反应器运行状况和形成颗粒的特性进行了评价.
1 材料与方法
1.1 试验装置与流程
试验所用柱状 SBR反应器由有机玻璃制成,总容积9,L,工作容积8,L,通过“SBR法污水处理自动群控系统”进行自动控制,使 SBR反应器按照强化生物除磷工艺运行,运行周期为 8,h,其中包括进水100,s,厌氧 2,h,好氧 4,h,沉淀 1,h,其余时间为排水和闲置.反应器内安装了溶解氧(dissolved oxygen,DO)和pH电极,能够实现DO和pH值的在线监测,好氧阶段控制 DO大于 2,mg/L,整个周期 pH值在7.3~7.9范围内变化.每周期排水 3,L,交换比为3/8.泥龄(sludge retention time,SRT)控制在 20,d.
1.2 接种污泥
反应器接种污泥取自天津市纪庄子污水处理厂曝气池,属于普通絮状污泥,污泥聚积指数(sludge volume index,SVI)为 103.35,mL/g.
1.3 进水水质
进水采用人工配制的模拟废水.乙酸钠为主要碳源,产生化学需氧量(chemistry oxygen demand,COD)为 530.8,mg/L,有机负荷率控制在 0.6,kg COD/(m3·d).KH2PO4为磷源,P/TOC 值为 20/200.丙烯基硫脲作为硝化抑制剂,用来抑制硝化细菌的生长.具体成分组成见表1.
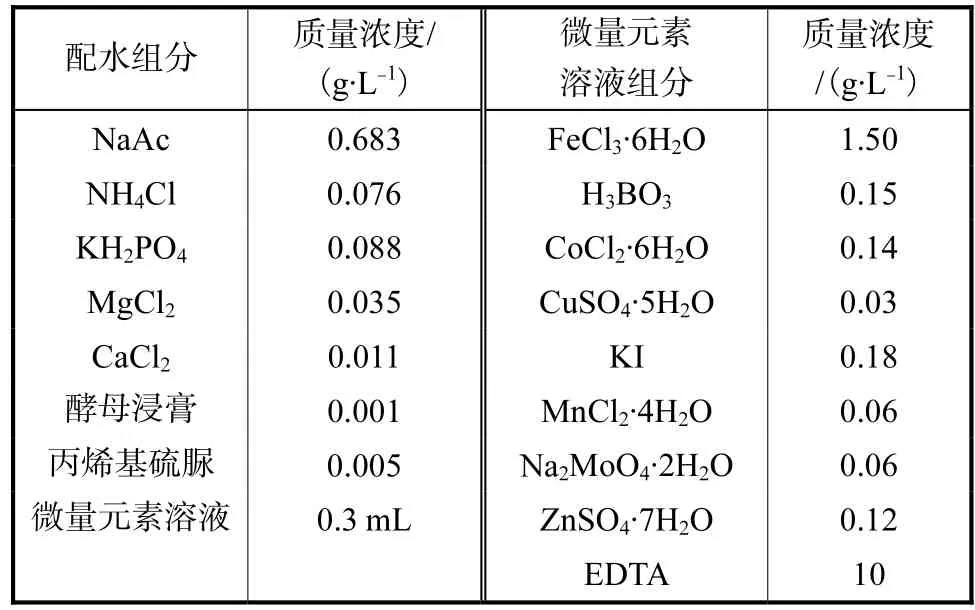
表1 人工配水成分Tab.1 Composition of the synthetic wastewater
1.4 分析方法
总磷(total phosphorus,TP)、可溶性正磷酸盐(soluble ortho-phosphate,SOP)、NO3-、NO2-、MLSS、SVI采用标准方法测量[4-5].总有机碳(total organic carbon,TOC)采用 TOC-VCHP型总有机碳分析仪(日本岛津)测定.
污泥含磷量的测定:取一定量污泥样品,使其悬浮于水中,采用超声波细胞粉碎机(JY92-Ⅱ型,宁波新芝生物科技股份有限公司),在功率 400,W,工作时间5,s,间隙时间5,s的条件下处理20,min后,测定其中的TP含量,
颗粒粒径分布采用激光粒度分析仪(英国马尔文公司)测定.颗粒污泥细胞表面疏水性的测定参考Rosenberg等[6]的方法,以十六烷为疏水相,菌悬液中进入十六烷的细胞占原菌悬液中细胞总数的百分比作为细胞表面疏水性的值,具体步骤如下:试管中先后加入 5,mL菌悬液和一定量的十六烷,30,℃恒温水浴加热 10,min,取出试管振荡 120,s后,静置 15,min使两相分离,取出水相在400,nm处测定吸光度.与原菌悬液相比,水相中吸光度减少的百分比即为所求.
颗粒污泥的微观形态采用FEI Quanta 200扫描电镜(捷克 FEI公司)进行观察.样品预处理步骤如下:
(1)3%戊二醛固定4,h;
(2)磷酸缓冲液漂洗3次;
(3)1%四氧化锇固定2 h;
(4)磷酸缓冲液漂洗3次;
(5)30%~100%梯度乙醇脱水;
(6)乙酸异戊酯置换,20,min;
(7)CO2临界点干燥(CPD-030临界点干燥仪,Bal-Tec公司);
(8)金离子溅射法镀膜(SCD-005冷喷涂仪,Bal-Tec公司);
(9)FEI Quanta 200扫描电镜观察.
2 结果与分析
2.1 反应器运行性能
SBR反应器在启动后6个星期内基本达到稳定,图 1和图 2分别显示了反应器运行过程中磷的去除情况以及污泥含磷量、混合液悬浮固体浓度(mixed liquor suspended solids,MLSS)、SVI的变化趋势.结果表明,从第27天开始,总磷的去除率一直处于90%以上,出水中总磷的最低质量浓度可达 0.6,mg/L,说明反应器已具有很好的生物除磷性能.在反应器运行过程中,污泥的含磷量持续增长,从最初的 2.02%上升到 7.05%(占污泥干重),污泥中积累了大量的磷.但其生长却很缓慢,MLSS在24,d内从2.419,g/L增加到 5.047,g/L,之后便不再增加甚至略有降低.图3是反应器运行稳定后的1个周期内SOP和TOC的变化曲线,可以看出,在厌氧阶段,碳源被迅速吸收并在 1.5,h内耗尽,同时伴随着 SOP的大量释放,厌氧阶段开始时的零点是在进水结束并达到泥水的完全混合后开始计算的,因此厌氧阶段 SOP的增加正是由于PAOs厌氧代谢的结果,随后好氧阶段SOP浓度逐渐降低,直到好氧阶段末趋近于 0,说明此时反应器已具有EBPR工艺的典型特征,实现了对PAOs的富集.在反应器的整个运行周期内,均未检出 NO3-和NO2-,证实丙烯基硫脲成功抑制了硝化细菌的活性,防止其产生 NO3-和 NO2-抑制 PAOs的厌氧代谢.从不断下降的SVI值可以看出,污泥的沉降性能得到很好的改善,这与污泥含磷量的增加有关,因为胞内聚磷含量的增加将一定程度上提高污泥的密度,但更重要的原因是,反应器内的污泥从最初接种时的絮状物逐渐转化成为颗粒污泥.
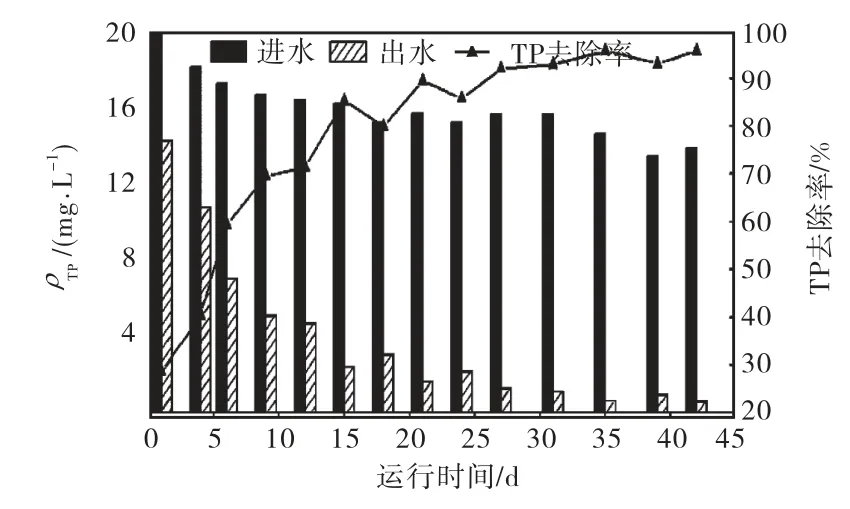
图1 反应器运行过程中总磷的去除情况Fig.1 TP removal performance during operation of reactor
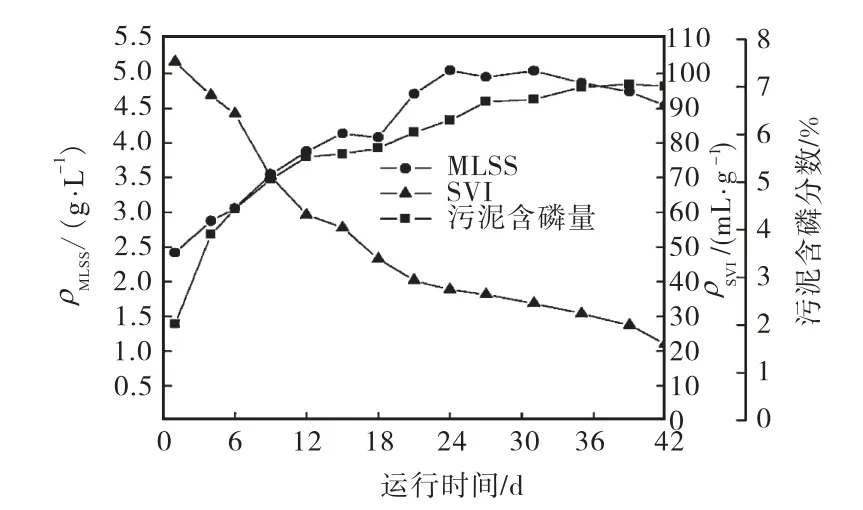
图2 反应器运行过程中MLSS、污泥含磷量和SVI的变化曲线Fig.2 Variation curves of MLSS,phosphorus content in sludge and SVI during operation of the reactor
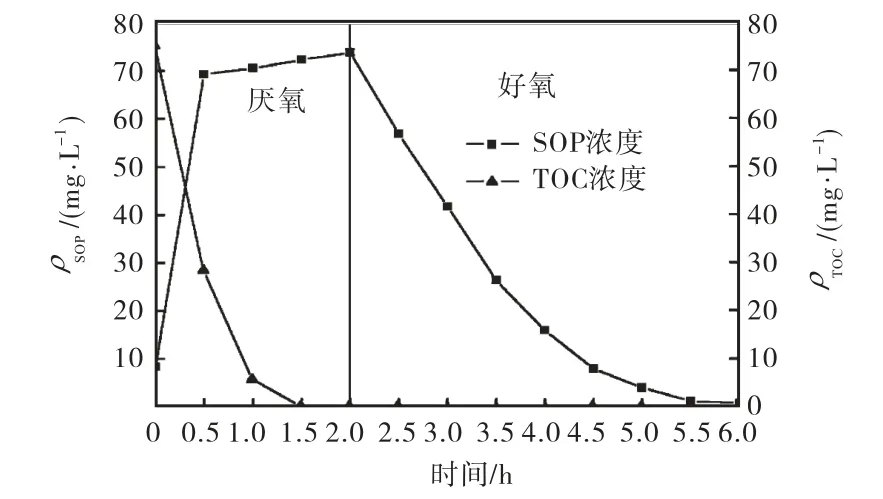
图3 SOP和TOC在一个反应周期内随时间的变化Fig.3 Variations of SOP and TOC with time in one cycle
2.2 好氧颗粒污泥的形成
从第 10天开始,反应器内逐渐出现了肉眼可见的微小颗粒,运行到 1个月左右,最初接种的棕色絮状污泥已完全转化成黄色的颗粒状污泥,实现了对聚磷好氧颗粒污泥的培养.成熟后颗粒的平均密度为1.048,g/cm3,细胞表面疏水性为48.4%.通过激光粒度分析仪测得颗粒污泥的粒径分布,如图 4所示,粒径主要集中在1,mm左右,体积平均粒径为940.17,μm,中值粒径为 903.75,μm,粒径介于 0.5~2.0,mm 之间的颗粒约占70%.
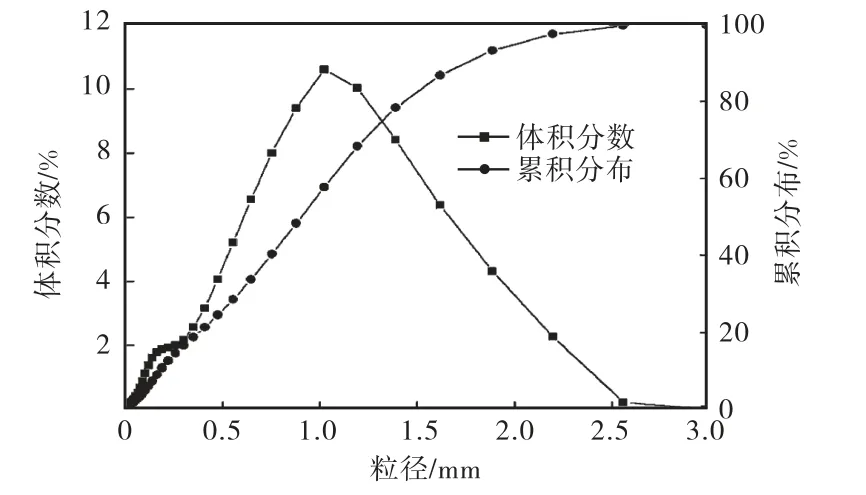
图4 粒径分布Fig.4 Distribution of particle size
图 5为好氧颗粒污泥的电镜观察结果.如图所示,颗粒具有非常清晰地外部轮廓,形状较为规则,多数呈球形(图 5(a)~(b)).颗粒的表层主要由紧密缠绕的丝状菌组成,而透过表层的丝状菌可以看到,颗粒内部结构非常密实,内表面凹凸不平,有裂缝和凹陷(图 5(c)).从颗粒污泥的剖面来看,颗粒内部由紧凑排列的短杆状细菌组成(图 5(d)~(e)),从形态上看,至少存在2种不同的杆菌(图5(f)).

图5 颗粒污泥的扫描电镜照片Fig.5 SEM images of granular sludge
3 讨 论
3.1 聚磷好氧颗粒污泥的关键培养技术
目前对好氧颗粒的培养几乎都是在 SBR反应器中实现的[7],SBR反应器的主要特征是周期循环运行,每周期包括进水、曝气、沉淀和排水阶段,根据工艺不同还可能包括厌氧和缺氧阶段.沉淀时间被认为是引起好氧颗粒化的主要选择压[8-9],在较短的沉淀时间内,沉淀性能差的污泥将随出水排出反应器,从而筛选出沉淀性能好的污泥保留在反应器内.因此,目前大多数研究都是采用短沉淀时间(2~10,min)作为培养好氧颗粒污泥的控制参数[10-11].但是,采用短沉淀时间很容易造成污泥的大量流失,尤其是在反应器启动初期,如 Tay等[12]将沉淀时间设为 2,min,启动后 24,h内大部分接种污泥被排出反应器,使得混合液挥发性悬浮固体 (mixed liquor volatile suspended solids,MLVSS)质量浓度从 1,980,mg/L 迅速降低到 330~280,mg/L.虽然短沉淀时间有利于筛选出沉淀性能好的污泥,从而加速好氧颗粒的形成,但是由于 PAOs的生长速率相对缓慢,污泥的大量流失不利于 PAOs的富集,很难形成聚磷好氧颗粒.按照常规EBPR工艺的运行方式,采用较长的沉淀时间1 h,同样实现了污泥的颗粒化,证实以短沉淀时间形成选择压并不是培养聚磷好氧颗粒的关键控制参数.
从图3可以看出,在厌氧阶段开始后的1.5,h左右碳源就被完全耗尽,直到好氧阶段结束反应器内的污泥都处于底物匮乏状态.有研究者认为底物匮乏是导致细胞表面特性改变和增强细胞之间粘附作用的重要因素[13],这将有利于细胞之间的自凝聚,从而促进生物颗粒的形成.Liu等[14]研究了长期运行条件下,不同的底物匮乏时间(0.8,h、3.3,h、7.3,h)对好氧颗粒形成和性质的影响,结果表明底物匮乏时间为3.3,h时,形成的颗粒密度最大,稳定性最好.本实验运行周期内存在 4.5,h左右的底物匮乏期,这对于好氧颗粒的形成与稳定性都有一定的促进作用.但是底物匮乏并不是形成好氧颗粒的先决条件,一直处于基质过剩的条件下同样能够形成颗粒污泥[15].
好氧颗粒污泥的培养多采用葡萄糖[16]或乙酸[17]为碳源.以葡萄糖为碳源时,形成的好氧颗粒形态不规则,颗粒表面易出现松散的绒毛,但是可以在较高有机负荷率下(15,kgCOD/(m3·d))维持系统的稳定运行;以乙酸为碳源时,颗粒具有紧凑的结构,呈规则的球状,但是在较高有机负荷率(9,kgCOD/(m3·d))下会造成颗粒分解使反应器运行失败[18].对于 PAOs而言,挥发性脂肪酸(volatile fatty acids,VFAs)尤其是乙酸被认为是最佳碳源,因为在厌氧条件下聚磷菌可直接吸收 VFAs形成聚羟基烷酸酯(polyhydroxy alkanoates,PHAs),并迅速释放出磷酸盐.PAOs一般无法直接利用其它碳源(如葡萄糖),必须在多种微生物共同作用下才能够实现 EBPR[19],但其除磷效果依然不如乙酸.因此,为了培养聚磷好氧颗粒污泥,本研究以乙酸钠为碳源,且需要采用较低的有机负荷率.
采用较低的有机负荷率使得系统中微生物的生长率较低,从图 2可以看出,污泥浓度的增长比较缓慢.Liu等[2]发现,高生长率将导致颗粒大小迅速增加,进一步导致颗粒的结构松散,密度降低,而生长率相对较低的好氧颗粒具有较强的结构和较好的沉淀性能,降低生长率可以改善好氧颗粒的稳定性.在聚磷好氧颗粒污泥培养过程中,污泥中主要包含聚磷菌、聚糖菌和普通的异养菌,在较高的有机负荷率下,聚糖菌和普通异养菌的快速生长不仅造成好氧颗粒的稳定性下降,同时也使得聚磷菌在竞争中处于劣势,不利于聚磷好氧颗粒的培养.因此,采用低有机负荷率在聚磷好氧颗粒污泥的培养中起到至关重要的作用,可以一定程度上降低系统中微生物的生长率,形成稳定的颗粒结构,并有利于实现对聚磷菌的富集.
3.2 聚磷好氧颗粒污泥的特性
随着反应器的运行,颗粒状污泥逐渐取代了最初的絮状污泥并在污泥体系中占优势,粒径介于0.5~2.0,mm的颗粒约占污泥总量的70%.同时,颗粒中积累了大量的聚磷,含磷量高达 7.05%,远远大于常规活性污泥的含磷量(1.5%~2.3%),与絮状 EBPR污泥(含磷量 3%~7%)相比也是相当高的[20].这说明在颗粒污泥内已富集了大量的 PAOs,成功的培养出了聚磷好氧颗粒污泥.通过扫描电镜照片(图 5)对聚磷好氧颗粒污泥的微观结构进行观察,可以看出,颗粒主要由3种不同形态的微生物组成,颗粒的外层是紧密缠绕着的丝状菌,内部是2种大小不同的短杆状细菌紧密结合形成的聚集体.目前已报道的聚磷菌多数呈杆状,如不动杆菌属(Acinetobacter)、气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas),而呈丝状的微丝菌(Microthrix parvicella)和诺卡氏菌属(Nocardia)也能够积累聚磷酸盐[21-22].
普遍认为,丝状菌的存在对于好氧颗粒的培养是不利的.一些好氧颗粒污泥系统中,由于丝状菌的过量生长而形成结构松散的绒毛状颗粒,沉淀性能变差,反应器运行恶化[23].因此,丝状菌的生长一直被认为是导致好氧颗粒系统运行不稳定的主要原因.但也有研究者发现丝状菌可以在好氧颗粒污泥中起到骨架的作用,甚至可以增强好氧颗粒的结构[24].
从密度、粒径分布和SVI值等颗粒特性参数可以看出,成熟的聚磷好氧颗粒具有紧凑的结构和很好的沉降性能.而其细胞表面疏水性却只有 48.4%,与一般的好氧颗粒污泥(70%左右[25])相比是较低的.颗粒污泥的形成和结构与细胞的疏水性密切相关.细胞疏水性高可以自聚集形成紧凑密实的颗粒,而且这种颗粒的外层一般是没有丝状菌缠绕的.
本研究中所获得的聚磷好氧颗粒虽然没有高度的细胞疏水性,但同样具有紧凑密实的结构和良好的沉降性能,表面丝状菌的紧密缠绕对于颗粒结构的强化起到至关重要的作用.丝状菌与颗粒内部的短杆菌聚集体存在着相互依存的关系,丝状菌附着缠绕在密实的短杆菌聚集体上,避免因沉淀性能差而被冲出反应器,也避免其被微型动物吞食;短杆菌聚集体被丝状菌紧密缠绕,变得更加密实,增强了结构的稳定性.
4 结 论
(1)SBR反应器接种絮状活性污泥,在低有机负荷率的条件下,按照 EBPR工艺的运行方式,成功培养出聚磷好氧颗粒污泥,并已稳定运行 1年多,证实该操作模式是适合聚磷好氧颗粒污泥的培养的.培养出的颗粒污泥中富集了大量的 PAOs,含磷量高达7.05%,能够达到非常好的除磷效果,总磷去除率高于90%,同时具有紧凑密实的结构和良好的沉降性能,平均粒径为 940.17,μm,平均密度为 1.048,g/cm3,SVI为22.02,mL/g.形成的聚磷好氧颗粒污泥由外层缠绕着的丝状菌和内部的短杆状细菌聚集体组成,丝状菌的紧密缠绕对于颗粒结构的强化起到至关重要的作用.
(2)为防止启动初期污泥的大量流失,采用较长的沉淀时间 1,h,同样实现了污泥的颗粒化,证实以短沉淀时间形成选择压并不是培养聚磷好氧颗粒的关键控制参数.采用较低的有机负荷率,使得反应器在一个运行周期内存在 4.5,h左右的底物匮乏期,有利于增强细胞之间的粘附作用;并一定程度上降低了系统中微生物的生长率,增强了颗粒的稳定性;还使得PAOs在与其他微生物的竞争中占优势,有助于PAOs的富集.因此,低有机负荷率对 PAOs的富集及其聚成颗粒都起着重要的作用,采用低有机负荷率是培养聚磷好氧颗粒污泥的关键控制参数.
(3)目前几乎所有的生物除磷工艺都是采用絮状活性污泥,但由于 PAOs的代谢活性容易受到很多因素的影响,因此在实际处理过程中时常会出现反应器性能恶化,难以实现长期稳定的运行.与之相比,聚磷好氧颗粒污泥内能够更大程度地富集 PAOs,具有紧凑密实的结构和良好的沉降性能,可以减小反应器容积,对于各种不利因素具有更强的抗冲击负荷能力,在实际废水生物除磷领域具有更加广阔的发展前景.
[1]Liu Y Q,Tay J H. Characteristics and stability of aerobic granules cultivated with different starvation time[J].Applied Microbiology and Biotechnology,2007,75(1):205-210.
[2]Liu Y,Yang S F,Tay J H. Improved stability of aerobic granules by selecting slow-growing nitrifying bacteria[J].Journal of Biotechnology,2004,108(2):161-169.
[3]de Kreuk M K,van Loosdrecht M C M. Selection of slow growing organisms as a means for improving aerobic granular sludge stability[J].Water Science and Technology,2004,49(11/12):9-17.
[4]国家环境保护总局. 水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社,2002.
National Environmental Protection Bureau.Water and Waste Water Monitoring and Analysis[M]. 4th ed. Beijing:China Environmental Science Press,2002(in Chinese).
[5]APHA.Standard Methods for the Examination of Water and Wastewater[M]. 20th ed.Washington DC,USA:American Public Health Association/American Water Works Association/Water Environment Federation,1998.
[6]Rosenberg M,Gutnick D,Rosenberg E. Adherence of bacteria to hydrocarbons:A simple method for measuring cell-surface hydrophobicity[J].FEMS Microbiology Letters,1980,9(1):29-33.
[7]Adav S S,Lee D J,Show K Y,et al. Aerobic granular sludge:Recent advances[J].Biotechnology Advances,2008,26(5):411-423.
[8]Liu Y,Wang Z W,Qin L,et al. Selection pressuredriven aerobic granulation in a sequencing batch reactor[J].Applied Microbiology and Biotechnology,2005,67(1):26-32.
[9]Qin L,Tay J H,Liu Y. Selection pressure is a driving force of aerobic granulation in sequencing batch reactors[J].Process Biochemistry,2004,39(5):579-584.
[10]Kishida N,Tsuneda S,Kim J H,et al. Simultaneous nitrogen and phosphorus removal from high-strength industrial wastewater using aerobic granular sludge[J].Journal of Environmental Engineering-Asce,2009,135(3):153-158.
[11]Han Z Y,Wu W X,Ding Y,et al. Optimization of main factors associated with nitrogen removal in hybrid sludge sequencing batch reactor with step-feeding of swine wastewater[J].Journal of Environmental Science and Health Part a-Toxic/Hazardous Substances and Environmental Engineering,2008,43(2):161-170.
[12]Tay J H,Pan S,He Y X,et al. Effect of organic loading rate on aerobic granulation (I):Reactor performance[J].Journal of Environmental Engineering-Asce,2004,130(10):1094-1101.
[13]Li Z H,Kuba T,Kusuda T. The influence of starvation phase on the properties and the development of aerobic granules[J].Enzyme Microb Technol,2006,38(5):670-674.
[14]Liu Y Q,Wu W W,Tay J H,et al. Starvation is not a prerequisite for the formation of aerobic granules[J].Applied Microbiology and Biotechnology,2007,76(1):211-216.
[15]Liu Y Q,Tay J H. Characteristics and stability of aerobic granules cultivated with different starvation time[J].Applied Microbiology and Biotechnology,2007,75(1):205-210.
[16]Tay J H,Pan S,He Y X,et al. Effect of organic loading rate on aerobic granulation(II):Characteristics of aerobic granules[J].Journal of Environmental Engineering,2004,130(10):1102-1109.
[17]Lin Y M,Liu Y,Tay J H. Development and characteristics of phosphorus-accumulating microbial granules in sequencing batch reactors[J].Applied Microbiology and Biotechnology,2003,62(4):430-435.
[18]Moy B Y P,Tay J H,Toh S K,et al. High organic loading influences the physical characteristics of aerobic sludge granules[J].Letters in Applied Microbiology,2002,34(6):407-412.
[19]Jeon C O,Park J M. Enhanced biological phosphorus removal in a sequencing batch reactor supplied with glucose as a sole carbon source[J].Water Research,2000,34(7):2160-2170.
[20]王建龙,文湘华. 现代环境生物技术[M]. 北京:清华大学出版社,2001.
Wang Jianlong,Wen Xianghua. Modern Environmental Biological Technology[M]. Beijing:Tsinghua University Press,2001(in Chinese).
[21]张兰英,刘 娜,孙立波,等. 现代环境微生物技术[M]. 北京:清华大学出版社,2005.
Zhang Lanying,Liu Na,Sun Libo,et al.Modern Environmental Microbiological Technology[M]. Beijing:Tsinghua University Press,2005(in Chinese).
[22]李亚新. 活性污泥法理论与技术[M]. 北京:中国建筑工业出版社,2007.
Li Yaxin.Activated Sludge Process Theory and Technology[M]. Beijing:China Architectural Industry Press,2007(in Chinese).
[23]Chen Y,Jiang W,Liang D T,et al. Structure and stability of aerobic granules cultivated under different shear force in sequencing batch reactors[J].Applied Microbiology and Biotechnology,2007,76(5):1199-1208.
[24]Liu Y,Liu Q. Causes and control of filamentous growth in aerobic granular sludge sequencing batch reactors[J].Biotechnology Advances,2006,24(1):115-127.
[25]Liu Y,Yang S F,Tay J H,et al. Cell hydrophobicity is a triggering force of biogranulation[J].Enzyme and Microbial Technology,2004,34(5):371-379.
