RT-PCR检测人膀胱上皮细胞双功能氧化酶表达*
2010-05-07耿会珍刘明岩赵丽君刘珍刘燕翔黄宁王伯瑶吴琦
耿会珍 刘明岩 赵丽君 刘珍 刘燕翔 黄宁 王伯瑶 吴琦
(四川大学华西基础医学与法医学院感染免疫研究室,四川 成都 610041)
吞噬细胞NADPH氧化酶被激活后,细胞发生呼吸爆发,产生大量活性氧(ROS),成为细胞杀灭微生物的重要成分。2000年以后,在非吞噬细胞发现了NADPH氧化酶的同源物家族,被命名为 NOX(NADPH oxidase)家族。人类 NOX家族共有 7 个成员,即 NOX1、NOX2、NOX3、NOX4、NOX5、Duox-1和Duox-2[1-3]。NOX家族广泛表达于机体的组织器官,其生物学功能成为研究的热点。双功能氧化酶(Duox-1和Duox-2)最初在甲状腺中发现,它们除了具有NOX的C端结构域外,还有一个N端过氧化物酶样胞外域,故称为双功能氧化酶。近年来,呼吸道、胰腺、腮腺、前列腺及肠胃道上皮等部位陆续发现Duox基因表达。泌尿道上皮是否表达Duox目前未见文献报道,本实验利用逆转录聚合酶链反应(RT-PCR)的方法,观察膀胱上皮细胞中是否存在Duox表达,并初步探讨基因的表达调控因素。
1 材料与方法
1.1 材料 人膀胱上皮细胞株(T24)为本实验室保存,RPMI-1640为GIBCO产品,新生小牛血清购自兰州民海生物工程有限公司,佛波酯(PMA)购自 sigma公司,细胞因子(TNF-α、IFN-γ)为 PeproTech公司产品,Trizol试剂购自 Invitrogen公司,逆转试剂盒购自M BI公司,Taq mix DNA聚合酶,DL2000 DNA Marker为天根生物技术有限公司产品,PCR引物由Invitrogen公司合成。
1.2 方法
1.2.1 细胞培养及刺激 T24细胞采用含有10%新生小牛血清的1640培养基(无抗生素)常规培养和传代。实验前在每个细胞培养皿(60×15mm)中接种30万个T24细胞,37℃5%CO2孵箱培养 24h。加入 PMA(浓度为5nM)或细胞因子(TNF-α 20 ng◦ml-1+IFN-γ20 ng◦ml-1),分别在刺激后的12、24h收集细胞抽提RNA。实验同时设无刺激的空白对照组。
1.2.2 PCR引物设计 根据GenBank的序列,用Prime5.0软件分别设计 Duox-1(登录号 AF213465),Duox-2(登录号AF267981),β-actin(登录号 BC016045)的引物。

表1 PCR引物序列
1.2.3 总RNA提取 按 Trizol试剂说明操作。贴壁 T24细胞直接用Trizol试剂裂解,提取的总RNA用异丙醇沉淀,溶于经过DEPC处理的水中,紫外分光光度计检测其含量及纯度。
1.2.4 逆转录反应 在0.5ml的Eppendorf管中加入 RNasin 0.5μ l,Oligo(dt)1μ l,总 RNA 1μ l,M gCl24μ l,10(buffer 缓冲液2μ l,逆转录酶1μ l,用DEPC处理过的水补足至总体积20μ l,混匀,42℃反应 40min,95℃5min终止反应,冰浴冷却5min,-70℃保存。
1.2.5 PCR 扩 增 Taq-mix 酶 12.5μ l,cDNA2μ l,上 游引 物0.5μ l,下游引物 0.5μ l,加水补足总体积 25μ l。Duox 反应程序:94℃ 10min,94℃ 45s,53℃ 45s,72℃ 1min,40个循环,最后72℃延伸10min,4℃保存。β-actin反应程序:94℃3min,94℃30s,62℃30s,72℃1min,27个循环,72℃5min,4℃保存。
1.2.6 PCR产物的鉴定 取 5μ lPCR产物,加 1μ l 6×lodding buffer,以1×TAE电泳缓冲液,在2%琼脂糖凝胶上电泳约60min,Bio-Rad凝胶图像分析仪拍照,Quantity One分析软件对PCR扩增产物的特异性条带进行灰度扫描,以β-actin产物作校正分析,计算目的基因与内参照β-actin灰度比。
1.3 统计学处理 利用SPSS软件13.0对数据进行统计学处理。
2 结果
2.1 总RNA的鉴定
实验提取的细胞总RNA用紫外分光光度计检测OD260/OD280比值在1.79-1.90之间,表明所提RNA的纯度较高,蛋白质和DNA污染少。从凝胶电泳上可以清晰看到28sRNA和18sRNA两条带(图1),其亮度之比约为2∶1,5sRNA带不明显,表明RNA没有降解。
2.2 RT-PCR扩增结果
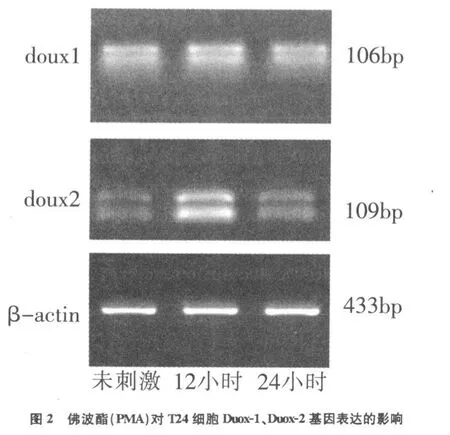
PCR扩增结果显示Duox-1,Duox-2在T24细胞中有组成性表达(Constructive expression)。佛波酯(PMA)刺激后,Duox-1基因表达无明显改变,而Duox-2基因表达增加,并以细胞刺激后12h表达量最高,与未刺激对照细胞相比增加4.5倍(P<0.05)(图2)。

联合使用细胞因子 TNF-α和INF-γ,Duox-1基因表达无明显变化,Duox-2基因表达显著增高,以实验24h表达增加最为明显,与未刺激对照细胞相比增加26.8(P<0.05)(图3)。
3 讨论

图3细胞因子(TNF-α、INF-γ)对T24细胞Duox1、Duox2基因表达的影响
吞噬细胞(中性粒细胞、单核/巨噬细胞)杀菌机理研究揭示,通过细胞呼吸爆发产生大量超氧阴离子和活性氧(ROS),是吞噬细胞重要的杀菌方式。NADPH氧化酶(NADPH oxidase)是吞噬细胞呼吸爆发的关键酶,该酶在吞噬细胞特异表达。基因突变而使NADPH氧化酶活性丧失的病人很容易感染细菌和真菌,这种疾病称为慢性肉芽肿病(Chronic granulomatous disease,CGD)。2000年以来,通过基因同源检索,发现人的基因组中另外还有6个基因编码的蛋白分子与NADPH氧化酶结构和活性相似,因此具有NADPH氧化酶活性的分子被重新分类,分别称为NOX1-5(NOX是NADPH oxidase的简称)以及Duox-1和Duox-2。在吞噬细胞特异表达的NADPH氧化酶现在称为NOX2,而其他NOX分子广泛表达于机体的上皮细胞、血管内皮细胞、平滑肌细胞、成纤维细胞[4-6]。
活性氧(ROS)参与了许多重要生命活动,比如信号转导、细胞凋亡、炎症反应、免疫防御、组织损伤等,因此细胞(特别是非吞噬细胞)产生活性氧的分子基础受人关注。双功能氧化酶(Duox-1、Duox-2)是 NADPH氧化酶(NOX)家族的两个重要成员,最早发现它们在甲状腺中高表达,研究表明Duox2基因突变将使甲状腺激素合成减少,而Duox-1在甲状腺中表达的生物学意义尚有待明确。近年来研究显示Duox-1、Duox-2在呼吸道、肠道上皮细胞也有很高的表达,并把它们与这些粘膜部位的免疫防御功能相联系,气管上皮细胞Duox-2产生的过氧化氢在乳过氧化物酶及硫氰酸盐存在的情况下生成具有抗菌活性的次硫氰酸盐,可能是呼吸道上皮的一种抗菌机制[7-8]。
双功能氧化酶(Duox-1、Duox-2)是否在泌尿道粘膜上皮表达目前未见报道。本实验通过 RT-PCR检测表明在膀胱上皮细胞 T24中 Duox-1、Duox-2有组成性表达,并且佛波酯(PM A)以及炎症细胞因子(TNF-α和IFN-γ)作用均能刺激细胞Duox-2的表达,但两种刺激因素并不能改变Duox-1的表达,这与呼吸道上皮细胞双功能氧化酶表达调控研究比较相似,Duox-2表达受 IFN-γ刺激,而Duox-1表达受 IL-4和 IL-13刺激[9]。本实验证实了膀胱上皮细胞表达双功能氧化酶,因此它们在泌尿道粘膜的生物学功能值得研究。而炎症刺激增加Duox-2基因表达,提示双功能氧化酶可能参与膀胱粘膜免疫防御过程,为膀胱粘膜抗感染机制研究提供了新的线索。
1 Kikuchi H,Hikage M,Miyashita H,et a1.NADPH oxidase subunit,g p91(phox)homologue,preferentially expressed in human colon epithelial cells[J].Gene,2000,254(1-2):237-243.
2 Cheng GJ,Cao ZH,Xu XX,et a1.Homologs of gp91phox:cloning and tissue expression of NOX3,NOX4,and NOX5[J].Gene,2001,269(1-2):131-140.
3 Geiszt M,Leto TL.The Nox Family of NAD(P)H Oxidases:Host Defense and Beyond[J].J Biol Chem,2004,279(50):51715-51718.
4 Clempus RE,Griendling KK.Reactive oxygen species signaling in vascular smooth muscle cells[J].Cardiovasc Res,2006,71(2):216-225.
5 Hassani RA,Benfares N,Caillou B,et a1.Dual oxidase2 is expressed all along the digestive tract[J].Am J Physiol Gastrointest Liver Physiol,2005,288(5):933-942.
6 Shiose A,Kuroda J,Tsuruya K,et a1.A novel superoxide-producing NAD(P)H oxidase in kidney[J].J Biol Chem,200l,276(2):1417-1423.
7 Moskwa P,Lorentzen D,Ex coffon KJ,et al.A novel host defense system of airway s is defective in cy stic fibrosis[J].Am J Respir Crit Care Med,2007,175(2):174-183.
8 Gattas MV,Forteza R,Fragoso MA.Oxidative epithelial host defense is regulated by infectious and inflammato ry stimuli[J].Free Radic Biol M ed,2009,47(10):1450-8.
9 Harper RW,Xu C,Eiserich JP,et a1.Differential regulation of dual NADPH oxidases/peroxidases,Duox1 and Duox2,by Th1 and T h2 cytokines in respiratory tract epithelium[J].FEBS Lett,2005,579(21):4911-7.
