醒脑静注射液对内毒素休克家兔血浆细胞因子含量的影响
2010-05-07余文静林燕李著华
余文静 林燕 李著华△
(1.泸州医学院病理生理学教研室;2.泸州医学院机能实验室,四川 泸州 646000)
内毒素又称脂多糖(Lipopolysaccharide,LPS),是革兰氏阴性菌细胞壁外膜上的一种含有多糖和类脂的特殊物质。内毒素休克(Endotoxin Shock),是由革兰氏阴性菌内毒素引起的以发热、低血压及多器官功能衰竭为主要特征的综合征,死亡率高,是临床常见的危急重症之一,目前尚无令人满意的治疗药物。有研究证实[1-4],醒脑静注射液能通过抑制肿瘤坏死因子-α(TNF-α)的表达,有效地抑制炎性级联反应,减轻内皮细胞损伤,清除氧自由基。本实验拟通过观察内毒素休克模型家兔血清中促炎因子TNF-α及抗炎因子白细胞介素-10(IL-10)含量的变化,探讨醒脑静注射液抗内毒素休克的作用机制。
1 材料与方法
1.1 动物 健康日本大耳白兔18只(合格证号:20054020),体重2-2.5kg,雄性,清洁级动物,由泸州医学院实验动物科提供。
1.2 试剂 醒脑静注射液购自河南天地药业股份有限公司;内毒素(LPS)购自美国 Sigma公司;兔 TNF-α、IL-10试剂盒,均购自上海西唐生物科技有限公司。
1.3 仪器 BL-420生物机能实验系统。
1.4 动物实验 日本大耳白兔18只,随机分为正常组6只,LPS组6只,LPS+XNJ组6只。耳缘静脉注射1%戊巴比妥钠全麻,分离右颈总动脉,插管,BL-420生理仪观察并记录平均动脉压、心率变化。分离右侧股动脉插管放血。待 10-20min平均动脉压稳定后记录平均动脉压、心率并定为记录0点。LPS组和 LPS+XNJ组沿耳缘静脉推注 LPS2.4mg◦kg-1,正常组推注等量生理盐水。待血压下降至正常的 2/3后,治疗组沿耳缘静脉推注醒脑静注射液0.5ml◦kg-1,正常组和模型组推注等量生理盐水。以上各组分别于推注后0、1、2、3h取血2ml,同时回输等量生理盐水。所取血以3000r◦min-1离心10min,取血浆测 TNF-α及IL-10的含量。
1-5 观察并计算动物的存活率
1-6 细胞因子(TNF-α以及IL-10)测定 按试剂盒说明操作,设空白管、标准管和测定管,各管一式两份。450nm读取吸光值,绘制标准曲线,在标准曲线上读取各待测标本含量。
1.7 统计学处理 采用SPSS16.0 for windows软件包分析处理。计量资料用均数±标准差()表示,用 t检验,p<0.05为差异具有显著性。
2 结果
2.1 平均动脉压及心率的变化 LPS组与PLS+XNJ组在静脉注入内毒素后60min动脉血压即下降至正常的2/3,PLS组在0h开始平均动脉压进行性下降;PLS+XNJ组在0h开始平均动脉压平缓下降,具体数值如表1示。LPS组0h心率明显加快,在1h达到顶峰,2h迅速下降,3h降至最低,直至死亡;LPS+XNJ组0h心率明显加快,1h达到顶峰,2h开始减慢,减慢幅度较LPS组小。
2.2 存活率 正常组动物全部存活,存活率为100%。注射LPS后3h,LPS组动物全部死亡,存活率为0。注射LPS后3h,LPS+XNJ组动物全部存活,存活率为100%。
2.3 血浆 TNF-α检测 正常组兔血浆 TNF-α浓度在 4个时间点无变化(p>0.05)。LPS组血浆TNF-α浓度在4个时间点表现趋势为逐渐增高,与0时间点比较差异均有显著性(p<0.01)。LPS+XNJ组血浆TNF-α浓度在 0时间点为峰值,在1h、2h、3h逐渐下降,与 0时间点比较差异均有显著性(p<0.05,p<0.01)。在 0h、1h、2h、3h 时间点正常组、LPS组、LPS+XNJ组比较,差异均有显著性(p<0.05,p<0.01)。具体数值如表2示。
2.4 血浆IL-10检测 正常组兔血浆IL-10浓度在4个时间点无变化(p>0.05)。LPS组血浆IL-10浓度在 4个时间点表现趋势为逐渐增高,与0时间点比较差异均有显著性(p<0.05,p<0.05)。LPS+XNJ组血浆 IL-10浓度在2时间点为峰值,3h时明显下降,与组内0时间点比较差异有显著性(p<0.01),与同一时间点 LPS组比较,差异均有显著性(p<0.01)。具体数值如表3示。
3 讨论
内毒素进入机体后以游离的形式释放或以内毒素-菌体蛋白复合体的形式释放。在血液循环中的内毒素可刺激机体产生一系列的生物活性介质,从而介导了众多病理生理学效应。近年研究认为,促炎和抗炎性介质共同失控性释放是引起内毒素休克的主要原因[5],它导致了免疫反应性失常,改变了免疫细胞的免疫性,引起内皮细胞的损伤和全身炎症反应综合征(Systemic Inflammatory Response Syndrome,SIRS),炎症介质在其发病机制中起重要作用。
肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)是内毒素进入人体内诱导机体效应细胞产生炎症反应最早出现的一种炎症介质,被认为起到关键作用。实验证明[6],内毒素损伤存在着TNF-α等血清促炎细胞因子水平的升高,单核细胞或外周血单核细胞及巨噬细胞核转录因子-κ B(Nuclear transcription factor-kappa B,NF-κ B)活性的增强,进而启动包括IL-8等其它细胞因子和粘附分子的炎症分子的表达。TNF-α生成后,又可刺激单核巨嗜细胞生成一系列介质而形成瀑布效应,造成机体死亡。
表1 促炎因子TNF-α浓度的变化±s,n=6)

表1 促炎因子TNF-α浓度的变化±s,n=6)
注:LPS组与正常组同时间点比较△P<0.05,△△P<0.01;LPS+XNJ组与LPS组同时间点比较▲P<0.05,▲▲P<0.01;与组内0h时间点比较*P<0.05,**P<0.01;与组内前一时间点比较#P<0.05,##P<0.01。
组别/时间 正常组 LPS组 LPS+XNJ组0h 16.82±1.29 99.81±6.89△△ 103.99±5.451h 18.90±0.28 111.51±1.61△△ 98.40±1.99▲*2h 24.22±0.97 129.94±2.83△△ 42.86±3.0▲▲**##3h 26.88±0.53 139.81±0.38△△ 31.53±2.45▲▲**
表2 抗炎因子IL-10浓度的变化(±s,n=6)
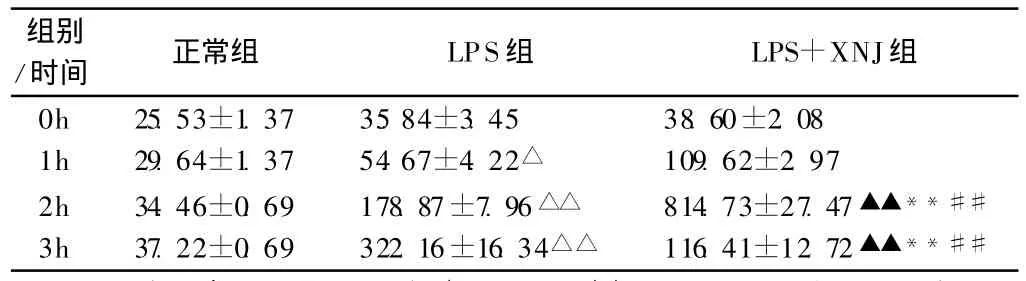
表2 抗炎因子IL-10浓度的变化(±s,n=6)
注:LPS组与正常组同时间点比较△P<0.05,△△P<0.01;LPS+XNJ组与LPS组同时间点比较▲P<0.05,▲▲P<0.01;与组内0h时间点比较*P<0.05,**P<0.01;与组内前一时间点比较#P<0.05,##P<0.01。
组别/时间 正常组 LPS组 LPS+XNJ组0h 25.53±1.37 35.84±3.45 38.60±2.081h 29.64±1.37 54.67±4.22△ 109.62±2.972h 34.46±0.69 178.87±7.96△△ 814.73±27.47▲▲**##3h 37.22±0.69 322.16±16.34△△ 116.41±12.72▲▲**##
IL-10是目前公认的炎症和免疫抑制细胞因子,主要由Th2细胞产生,具有良好的抗炎和免疫抑制特性。它一方面能抑制炎性因子的合成与释放,包括 TNF-α、IL-1、IFN-γ等众多前炎性细胞因子;另一方面能直接抑制炎性细胞的激活、迁移与粘附,并与其它抗炎介质有协同作用。Tokuda M[7]发现IL-10通过抑制NF-Κ B的活化来抑制肾小管细胞中IL-6和IL-8 mRNA的表达;Olivier[8]发现IL-10可以通过抑制I-Κ B激酶α/β复合体来抑制 NF-Κ B的活性。以上研究显示,IL-10是一种炎症反应的负调节因子,可广泛抑制炎症介质,有利于重建体内炎症介质及抗炎介质的平衡。
从本实验结果中可以看出,在内毒素休克一开始TNF-α即开始升高,用药后2h开始明显下降,说明醒脑静注射液通过抑制TNF-α,从而有效地抑制炎症反应引发的级联反应,;而IL-10在内毒素休克一开始升高缓慢,用药后2h达到顶峰,说明醒脑静注射液能促进内毒素休克时IL-10的表达来对抗 TNF-α的损害作用,通过调节 TNF-α/IL-10这一对促炎和抗炎因子的平衡来抑制内毒素引起的炎症级联反应。
1 He XP,Li P,Qiu QY,et a1.Inhibitory effects of muscone on PMNS adherence to HUVEC and the expression of ICAM-1,VCAM-1 and CD44 of HUVEC[J].Chinese Journal of Immunology,2006,22(2):148-150.
2 Wang WJ,Zhong M,Guo Y,et a1.Effects of musk glucoproteinon chemo taxis of polymorphonuclear leukocytes in vivo and invitro[J].J Chin Mater Medica,2003,28(1):59-60.
3 Zhu J,Xie WE,Jin YZ,et a1.Effect of gardenia jasminoides ellis on sertlm IL-l and T NF-αof rheumatoid arthritis rats[J].Chinese T raditional Patent Medicine,2005,27(7):801-809.
4 Zhang XY,Zhang ZJ,Wang Z,et a1.Effect of gardenin on gene expression profile in brain of rats with focal cerebral ischemia[J].Chinese Journal of Integrated T raditional and Western Medicine,2005,25(1):42-44.
5 杨友竹,译.SIRS与CA RS的病理状态和诊断标准[M].日本医学介绍,2001,22(9):408-409.
6 梁敏,白令君.丹参创伤性急性肺损伤治疗作用的实验研究[J].中国危重病急救医学,2000,12(9):515-517.
7 Tokuda M,Nagaoka S,et al.Interleukin-10 inhibits expression of interleukin-6 and-8 mRNA in human dental pulp cell cultures via nuclear factor-kappa B deactivation[J].J Endod,2002,28(3):177-180.
8 Olivier Tabary,Ce1ine,Muselet,et al.Interleukin-10 inhibits elevated chemokine interleukin-8 and regulated on activation normal T cell expressed and secreted production in cystic fibrosis bronchial epithelial cells by targeting the Iκ B kinase α/β complex[J].Am J Pathol,2003,162(1):293-302.
