1例扭转痉挛患者丘脑底核电生理特征及刺激术前后的 PET/CT表现
2010-04-27谭红愉陈楚霜邓怀福何俊德
谭红愉, 陈楚霜, 邓怀福, 何俊德, 邵 明
(1广东省广州医学院第一附属医院神经内科,广州 510120;2广东省广州医学院第一附属医院PET-CT中心,广州 510120;3广东省广州医学院第一附属医院神经外科,广州 510120)
扭转痉挛(torsion dystonia,TD)是一种全身型肌张力障碍,其特征为不自主的肌肉收缩引起肢体或躯干的扭转、反复的运动或姿势异常,影响日常生活、学习及生长发育,严重时致残甚至威胁生命。TD的病因不明,目前的研究认为其发病可能与基底节、丘脑、大脑皮质神经细胞变性导致底节功能异常有关。近来发现脑深部电刺激术(deep brain stimulation,DBS)能有效改善原发性肌张力障碍患者的症状,过去的手术大多选择苍白球(Gpi)作为手术的靶点[1],自从孙伯民报道采用丘脑底核(STN)作为手术靶点有明显的优势之后[2],STN便逐渐取代了 Gpi作为 TD的手术靶点,但有关其改善症状的机制研究则不多。我们采用双侧STN的 DBS成功治疗1例 TD患者,并通过正电子发射计算机断层显像 (Positron Emission Tomography,PET)/计算机断层扫描(Computer Tomography,CT)观察了患者治疗前后脑代谢的变化,旨在探讨 STN持续电刺激改善 TD症状的机制。
1 临床资料与方法
1.1 病例资料 13岁男性患儿,自 9岁始出现右手指扭曲,以食指、中指为甚,不能伸直,逐渐波及到左手;11岁出现颈椎向右侧弯曲,胸椎、腰椎向左侧弯曲后突,精神紧张时症状明显加重,睡眠时则消失;12岁时出现双下肢扭曲,伴站立时头向一侧扭,肩背向后仰,不能独立行走,日常生活需家人照顾,明显影响学习,病情进行性加重。曾予氟哌啶醇、乙哌立松等治疗无明显改善。足月顺产,婴幼儿期发育正常,无特殊家族史。患者于 2007年9月入住广东省广州医学院第一附属医院神经内科,头颅核磁共振成像(MRI)未见明显异常,临床诊断为 TD。
1.2 手术方法 气管插管静脉麻醉下安装 Leksell立体定向框架。STN定位使用西门子 1.5 T磁共振扫描机,MRI直视定位并参考 Schaltenbrand Bailey人脑标准图谱坐标在 MRI计算机工作站上直接定位并计算靶点所对应的头架坐标及进针角度。STN参考坐标为 AC-PC中点向后 2 mm,旁开 11 mm,AC-PC平面下 4 mm。麻醉后在颅骨钻孔,应用 leadpoint微电极推进系统及记录仪记录,微电极采用尖端 20~30μm的钨丝金属电极,阻抗 0.1~0.5MΩ。在预定靶点上 10 mm开始记录,用微电极推进器将微电极沿 STN的后外上方向前内下部推进。到出现典型的STN神经元放电为止。然后按预定靶点植入脑深部刺激电极(Medtronic 3389型电极)。MRI复查电极位于 STN,植入电刺激发生器。手术后用 DBS程控仪开机并在体外调整刺激参数。
1.3 PET/CT显像 患者行 2-氟 -2-脱氧 -D-葡萄糖(18F-FDG)与氮 -13-氨(13NH3)血流灌注PET/CT显像前禁食 6 h,检查时平躺尽量保持肢体不活动。在刺激器“关”状态下,静脉注入药物后30 min行颅脑 X-CT(140 Kv,240 mA)透射断层和PET发射断层影像采集,影像经重建处理后获得脑X-CT、PET和融合影像。在刺激器“开”状态下,在相同条件下再次进行18F-FDG和13NH3-PET/CT显像。由有经验的核医学科医师进行阅片,比较刺激器“开”与“关”状态下葡萄糖代谢和血流灌注的改变。
2 结 果
在脑深部电极植入术后 3周,用 DBS程控仪开机,以左侧 2点、右侧 6点为刺激点,根据患者的反应在体外调整刺激参数,调整参数为:左侧 CASE+,2-,脉宽 60 μs,频率 150 Hz,电压 1.5 V;右侧CASE+,6-,脉宽 60 μs,频率 150Hz,电压 1.5 V;并调整为 24 h持续开机状态。开机 2 d后,患者肢体扭转幅度有所减少,2周后躯干扭转程度减轻可独自行走。术后 3个月,患者已基本上无肢体扭动,仅有躯干轻度向左侧扭转,生活基本可以自理,症状明显改善。患者于 2008年春季复学,生活完成自理。术后,患者一直未使用药物治疗,随访 2年无并发症发生。(患者术前的胸片见脊柱明显侧弯,术后 10个月复胸片见脊柱侧弯消失如正常人,见图 1)。
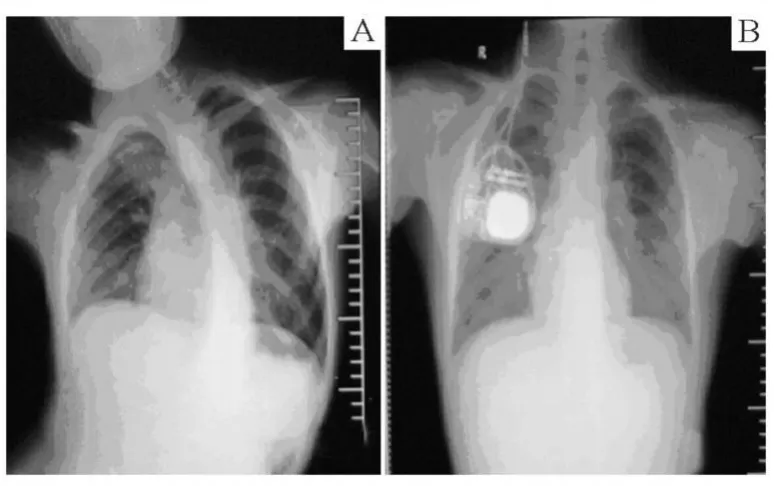
图1 A为 DBS术前胸片;B为 DBS术后 10个月胸片
我们在术中用微电极记录针道的不同电信号:左侧电极在靶点上4~7mm,多为18~33Hz不规则的低频簇状电活动;在靶点上 1~3mm时,背景噪音增加,见 34~65 Hz的不规律放电活动,为进入 STN区域;电极到达靶点 -靶下 2mm时,背景突然寂静,无明显神经元放电;电极继续下行,至靶点下 3 mm时仍然表现为背景安静,无明显神经元放电。右侧电极在靶点上 5~6 mm,为 35~41 Hz不规则低频簇状电活动;在靶点上 1~4 mm时,背景噪音增加,见35~68 Hz的不规律放电活动,为进入 STN区域;到达靶点 -靶下 3mm时,背景突然安静,无明显神经元放电。(双侧术中微电极记录针道各点的电活动图及对应头颅 MRI上电极所在的位置,见图 2)。
在 DBS“开”或“关”状态下的18F-FDG及13NH3双侧底节和丘脑的标准摄取比值(SUV值)分别见图3,表1、2。DBS“开”状态下皮质、丘脑和底节区的葡萄糖代谢及血流灌注均较“关”状态下低。
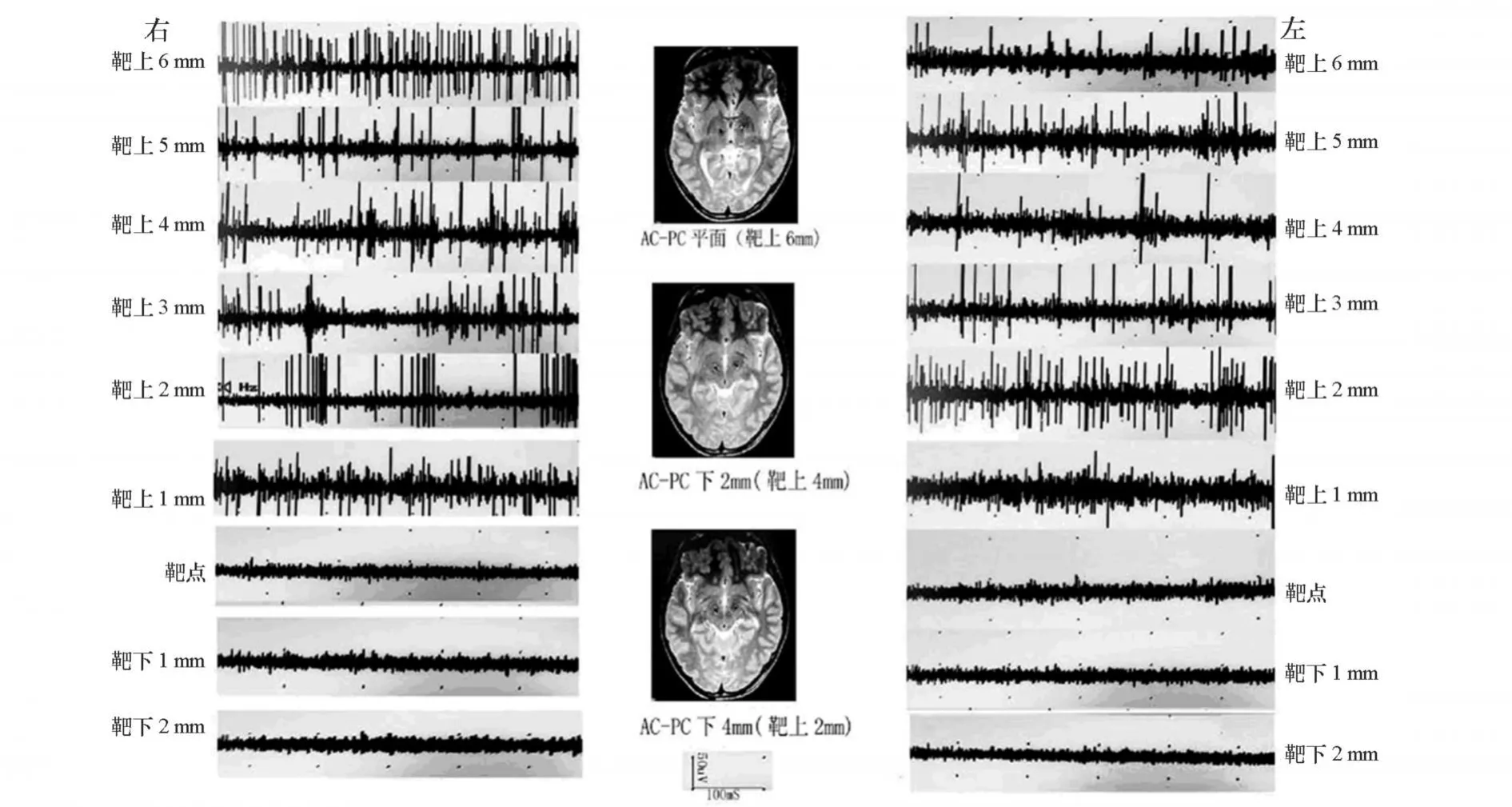
图2 双侧术中微电极记录针道各点的电活动图及术后对应头颅MRI上电极所在的位置
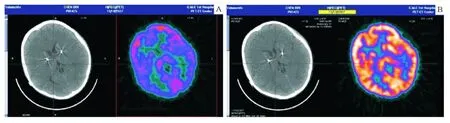
图3 18F-FDG-/PET/CT显像

表1 18 F-FDG(SUV值)

表2 13NH3(SUV值)
3 讨 论
本例患者通过 STN的 DBS治疗后症状完全改善,取得了显著的疗效,随访 2年疗效仍然稳定。Vitek等[3]研究者认为苍白球的异常放电可能是 TD发病的一个重要因素,Vidailhet等[4]的研究提示双侧苍白球 DBS是安全有效的治疗方法。但是苍白球的体积较大,在此处植入电极,需要消耗刺激系统较大的功率,电池在 2年左右就会耗尽,对患者的经济负担很大。孙伯民等曾经报道在 STN植入电极刺激可全面改善患者的症状[2]。STN相对 Gpi来讲,体积较小,电刺激所需要的功率较小,耗电明显降低,因而是最佳的选择。本结果支持上述观点。本研究还显示该患者的 STN神经元的放电频率与帕金森病(PD)患者不一致。首先,根据该患者典型的 STN放电信号确定 STN长度(左侧 3mm,右侧 4 mm),术中在靶点上 1~4mm处记录到典型的 STN放电信号,而到靶点时已进入了静区,这可能与患者年少头颅较小有关。再者,我们用微电极技术记录了该患者STN神经元的电活动,发现其 STN的放电频率平均为 54.75 Hz,比 Hutchison等[5]报道的 PD患者的STN神经元的自发放电频率(37±17)Hz高,说明这两种疾病在电生理特性方面存在差别。我们应用的电刺激的参数与 PD的 STN电极植入后的刺激参数基本一致,说明对于基底节环路的功能紊乱,从电生理的角度而言,只要恢复基底节固有频率的电冲动发放,使其电生理节律恢复正常,就可以改善症状。
我们通过 PET/CT检测,观察到当 DBS处于“关”状态时,皮质、丘脑以及基底节的葡萄糖代谢增高,提示 TD患者底节环路的电生理节律紊乱,STN的电活性增高,皮质及底节区的糖代谢增高。这与Gilio等[6]通过运动诱发电位(MEP)的研究发现肌张力障碍的患者在运动状态下患侧的MEP面积明显大于对照组,推测皮质兴奋性的异常增高引起持续的不随意肌肉收缩的结论一致。当 DBS处于“开”状态时,皮质和基底节区的葡萄糖代谢、丘脑和底节的血流量与"关"状态相比明显降低,提示 STN的高频电刺激改善症状的机制可能与抑制了基底节区 STN的过度电兴奋导致的血流增加和葡萄糖代谢增高有关。国外有类似的研究,Kumar等[7]利用 PET技术研究了 TD患者在DBS术前后的脑代谢的变化,发现苍白球的持续电刺激可以降低患者术前过度活跃皮质运动区的代谢,与本观察结果一致。
[1]Isaias IU,Alterman RL,TagliatiM.Deep brain stimulation for primary generalized dystonia long-term outcomes[J].Arch Neurol,2009,66:465-470.
[2]孙伯民,占世昆,陈晟,等.双侧丘脑底核电刺激治疗原发性肌张力障碍[J].中华神经外科杂志,2006,12:717-719.
[3]Vitek JL,Chockkan V,Zhang JY,et al.Neuronal activity in the basal ganglia in patientswith generalized dystonia and hemiballismus[J].Ann Neurol,1999,46:22-35.
[4]Vidailhet M,Vercueil L,Houeto JL,et al.Bilateral deep brain stimulation of the globus pallidus in primary generalized dystonia[J].N Engl JMed,2005,352:459-467.
[5]Hutchison WD,Allan RJ,Optiz H,et al.Neurophysiological identification of the subthalam ic nuc leus in surgery for Parkinson’s disease[J].Ann Neurol,1998,44:622-628.
[6]Gilio F,CurràA,Inghilleri M,etal.Abnormalities ofmotor cortex excitability preceding movement in patients with dystonial[J].Brain,2003,126:1745-1754.
[7]Kumar R,Dagher A,Hutchison WD,et al.Globus pallidus deep brain stimulation for generalized dystonia:clinical and PET investigation[J].Neurology,1999,53:871-874.
