HIF-1 α基因修饰 NSCs后作用机制探讨
2010-04-25金玉玲陆晓红罗海龙吴盛华陆春风
金玉玲,陆晓红,綦 莹,罗海龙,吴盛华,陆春风
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;2.哈尔滨市儿童医院,黑龙江 哈尔滨 150000;3.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157006;4.佳木斯市中心医院,黑龙江 佳木斯 154002)
NSCs携带外源基因治疗为神经系统疾病变的治疗及机制探讨提供了广阔的前景[1],为揭示神经系统中各种转录因子作用相关机制等问题提供了良好的实验模型。扩增 AdHIF-1α--GFP后转染 NSCs,免疫细胞化学染色法检测转染后 N SCs基因表达情况、V EGF和 NF-κ B的表达情况及给予梯浓度 N F-κ B特异性抑制剂 PDTC后 AdHIF-1α--GFP修饰后 NSCs中 VEGF的表达情况。从而进一步认识HIF-1α在 CI后信号转导途径 ,为深入了解 NF-κB在发挥脑保护效用中的作用机制提供实验依据。
1 材料和方法
1.1 主要实验试剂
DMEM/F12、B27(为 Gibico产品),人基因重组表皮生长因子(EGF)、人碱性纤维生长因子(bFGF)(为 Invitrogen产品 ),兔抗 Nestin多克隆抗体、羊抗兔 IgG-CY3、兔抗HIF-1 α多克隆抗体、兔抗 NF-κB多克隆抗体、兔抗 V EGF多克隆抗体(北京博澳森),SABC(大鼠)试剂盒,HIF-1α质粒在 Ad载体中并带有 GFP标记 ,空载体 Ad带有 GFP标记(由重庆医科大学胡长林教授馈赠),HEK293-细胞33代次(北京本元正阳)。
1.2 方法
1.2.1 进行细胞培养
取新生 24h内的 Wistar大鼠,无菌取出海马,Hanks液漂洗剪碎后吹打,用 200目筛网过滤后1000r/min离心5min,弃上清,加入完全 N SCs培养液1mL,吹打成细胞悬液,接种于细胞培养瓶中,放置37℃,5%的 CO2培养箱中静置培养,每隔2d换液。7d后传代,传3代后备用。参考蔡文琴等[2]方法,采用免疫细胞化学法和荧光法进行 nestin染色鉴定是否为N SCs[3]。
1.2.2 AdHIF-1α--GFP及空 Ad--GFP的扩增
取细胞密度 70%左右 33代 HEK293细胞,PBS5mL冲洗1次;取 1mL AdHIF-1 α--GFP平铺加入培养瓶,并左右微斜,使其均匀平铺瓶底,放入细胞培养箱孵育2h后加入2%细胞维持液2mL孵育24h后,90%以上细胞变圆且漂浮,在荧光显微镜下观察,475nm波长蓝光激发光下观察508nm的绿色荧光。并在荧光显微镜下成像,将细胞悬液三冻三融后5000r/5min离心,0.22滤器抽滤后分装 EP管于-80℃冰箱冻存。采用细胞计数及 MTT方法用 Reed-Muench法计算病毒滴度及感染复数。
1.2.3 检测基因转染后 NSCs中 HIF-1 α表达
荧光检测 N SCs中 AdHIF-1 α--GFP及空载体 Ad-GFP表达,分别提取基因转染后 N SCs、空载体转染 NSCs、正常 N SCs蛋白做免疫细胞化学染色法[4]检测 HIF-1 α表达。
1.2.4 检测各组 NSCs中 N F-κB和 V EGF表达
分别提取基因转染后 N SCs、空载体转染 NSCs、正常NSCs蛋白做免疫细胞化学染色法检测 NF-κ B和 V EGF表达。
1.2.5 检测给予 NF-κ B梯浓度抑制剂后基因转染 N SCs中 V EGF表达
HIF-1α基因修饰的 NSCs中按 50μ mol/L、 150μmol/L、300 μmol/L浓度梯度加入特异性抑制剂二硫氨基甲酸酞吡咯烷(PDTC)[5],免疫细胞化学染色法检测其中 V EGF的表达变化。
1.3 统计学方法
数据用平均数±标准差 (±s)表示 ,采用 SPSS13.0统计软件进行单因素方差分析及t检验统计学处理。P<0.05表示差异显著。
2 结果
2.1 免疫组化检测基因转染后神经干细胞中 HIF-1α表达
免疫细胞化学显示,HIF-1 α染色可见几乎所有细胞胞浆中出现棕黄色颗粒,胞核呈蓝色,构成的细胞集落形状较规则,呈橄榄球形或球形,但未处理神经干细胞组及空载体神经干细胞组细胞中无HIF-1α染色阳性表达。
2.2 检测各组神经干细胞中 NF-κB表达结果
见表 1。
表 1 AdHIF-1α--GFP转染后 NSCs中 N F-κ B表达阳性细胞数比较 (±s,n=6)
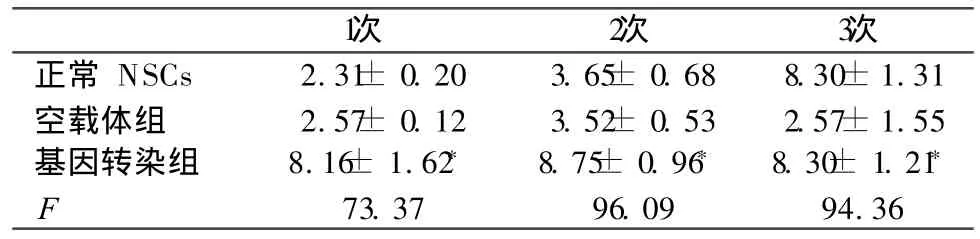
表 1 AdHIF-1α--GFP转染后 NSCs中 N F-κ B表达阳性细胞数比较 (±s,n=6)
*:与空载体组和正常组相比,P <0.05。
1次 2次 3次正常 NSCs 2.31± 0.20 3.65± 0.68 8.30±1.31空载体组 2.57± 0.12 3.52± 0.53 2.57±1.55基因转染组 8.16± 1.62* 8.75± 0.96* 8.30± 1.21*F 73.37 96.09 94.36
2.3 各组神经干细胞中 VEGF表达结果
见表2。
表2 AdHIF-1α--GFP转染后 NSCs中 VEGF表达比较 (±s,n=6)

表2 AdHIF-1α--GFP转染后 NSCs中 VEGF表达比较 (±s,n=6)
*:与空载体转染组及正常神经干细胞组相比较,P<0.05。
1次 2次 3次正常 NSCs 1.83± 0.13 1.26± 0.34 1.10±0.30空载体组 1.70± 0.25 1.54± 0.36 1.36±0.37基因转染组 9.40± 2.28* 10.57± 3.96* 10.26± 3.15*F 66.49 31.6 48.12
2.4 加入 N F-κB特异性抑制剂后 HIF-1α基因修饰的神经干细胞 V EGF的表达
见表3。
表3 转染后 N SCs给予梯浓度抑制剂 PDTC后V EGF阳性细胞数比较 (±s)
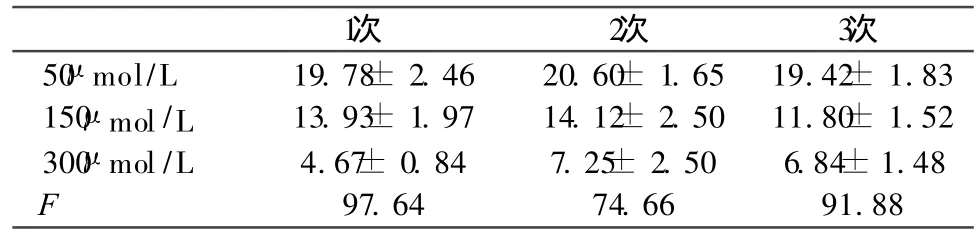
表3 转染后 N SCs给予梯浓度抑制剂 PDTC后V EGF阳性细胞数比较 (±s)
1次 2次 3次50 μ mol/L 19.78± 2.46 20.60± 1.65 19.42± 1.83 150μ mol/L 13.93± 1.97 14.12± 2.50 11.80± 1.52 300 μ mol/L 4.67± 0.84 7.25± 2.50 6.84± 1.48 F 97.64 74.66 91.88
300μ mol/L组与 150μ mol/L组相比 ,P< 0.05,有显著差异;50 μ mol/L组 与 150 μ mol/L 组相 比,P< 0.05;300 μ mol/L组 与50 μ mol/L组相比P< 0.05。
3 讨论
HIF-1α是在缺血缺氧条件下发挥重要作用的转录因子,一系列与组织耐受缺血缺氧环境有关的基因都由它激活转录[6]。我们用免疫细胞化学染色的方法显示转染 AdHIF-1α-GFP组有 HIF-1α阳性细胞的表达,而 Ad-GFP组和正常 NSCs组无 HIF-1 α阳性细胞的表达,在同样的反应条件下,AdHIF-1α-GFP组 HIF-1α阳性细胞数明显高于Ad-GFP组和正常 NSCs组。提示重组的 AdHIF-1α-GFP以转入神经干细胞并有 HIF-1α的表达。为下一步探讨目的基因 HIF-1 α的作用信号转录机制做了良好的铺垫。
很多研究发现,在脑缺氧损伤区域 N F-κ B与 V EGF表达呈正相关[7]。因此,我们大胆假设,NF-κ B是否处于 HIF-1α上调 V EGF作用通路上并起重要作用。本实验设计为以 HIF-1α修饰的 NSCs为载体,给予抑制 NF-κ B生物活性后检测 V EGF的表达,为排除不确定的影响因素,使用国内外公认的 N F-κ B特异性抑制剂 PDTC(吡咯烷二硫代氨基甲酸酯,pyrrolidindithiocarbamate)[8],以实现特异性抑制N F-κB表达的目的。PDTC是一种抗氧化剂,能有效抑制N F-κB活性及表达。作用原理主要通过两方面:一是抑制N F-κ B的 p65亚单位,一是通过其金属螯合作用。免疫细胞化学染色显示 HIF-1α修饰的 NSCs给予梯浓度 PDTC后,VEGF阳性细胞数呈梯浓度依赖性下调,各浓度组阳性细胞表达数间有统计学差异 (P<0.05)。符合我们最初的猜想。
本实验通过体外培养 HIF-1α基因修饰的 N SCs,采用免疫细胞化学染色实验方法研究 HIF-1α修饰 N SCs后各种转录因子表达 ,有助于我们认识 HIF-1α在 CI后信号转导途径,对 CI的治疗有着积极而重要的指导意义。
[1]Peel AL,Klein RL.Adeno-associated virus vectors:activiry and applications in the CNS[J].J Neurosci Methods,2000,98(2):95-104
[2]蔡文琴,王泊云.实用免疫细胞化学与核酸分子杂交技术 [M].成都:四川科学技术出版社,1994,406-512
[3]张力,江澄川,冯林音,等.人胚神经干细胞诱导分化为多巴胺能神经元的实验研究 [J].中国神经精神疾病杂志,2002,28(6):410-413
[4]J.萨姆布鲁克,E.F.费里奇,T.曼尼阿蒂斯.分子克隆实验指南[M].第2版.北京:科学出版社,1992,880-886
[5]Schreck R,Meier B,Mannel DN,et al.Dithio car bamates as potent inhibitors of nuclear factor kappa B activationin intact cells[J].J Exp Med,1992,175:1181
[6]Semenza GL.HIF-1and human disease:one highly involved factor[J].Genes Dev,2000,14(16):1983-1991
[7]Belaiba RS,Bonello S,Zhringer C,et al.Hypoxia up-regulates hypoxia-inducible factor-1alpha transcription by involving phosphatidylinositol3-kinase and nuclear factor kappaB in pulmonary artery smooth muscle cells[J].Mol Biol Cell,2007,18(12):4691-4697
[8]Fan Z,Bau B.IL-1beta induction of IL-6 and LIF in normal articular human chondrocytes involves the ERK,p38 and NFkappaB signaling pathways[J].Cytokine,2004,28(1):17-24
