CD80联合CD28/CpG ODN活化的PBMC对胃癌细胞杀伤作用的实验研究
2010-04-24郭树军李永研
方 军,郭树军,李永研
利用外周血单个核细胞(PBMC)对肿瘤细胞的杀伤作用是肿瘤治疗中近年研究较为广泛的一种方案。本文旨在对体外联合应用CD80和CD28/CpGODN共刺激活化PBMC在体外对胃癌细胞的影响及杀伤途径作出初步研究。
1 材料与方法
1.1 材料 健康人外周血由153中心医院血站提供,胃癌细胞株MKN45由第四军医大学西京医院消化内科提供,RPMI1640培养基为Gibco公司产品,新生牛血清为杭州四季青公司产品,胰蛋白酶为Sigma公司产品。单克隆抗体CD28干粉CD80、T细胞亚群、干粉均购自Immunotech公司,蒸馏水溶解至所需浓度,分装,-30℃保存。CpG ODN由上海生工生物工程公司合成,其序列为5'GGGGTC AACGTIGAGGGGGG 3',重组人IL-2为北京四环生物工程制品厂产品,淋巴细胞分离液为TBD生物技术研究所产品,噻唑蓝 (Mar)及二甲基亚砜(DMSO)为Amresco公司产品。
1.2 方法
1.2.1 外周血PBMC的分离与体外培养 100 ml血用 Ficoll密度梯度离心分离单核细胞,用RPMI1640培养(含100 ml/L灭活小牛血清),每管10 ml,分别加入维持量IL-2(20 kU/L),CD28(0.4 mg/L),CD80(0.4 mg/L)在37℃、50 ml/L CO2孵箱中培养1、2、3、4、5 d共5个时间段。
1.2.2 胃癌细胞株MKN45培养 用1~2 ml 0.25%胰蛋白酶消化2~3 min,倾出胰酶,用约2 ml RPMI 1640液轻洗1次,倾出,加2 ml 1640液吹散细胞,再加入含10%小牛血清的RPMI1640液,共10 m l。在37℃、5%CO2孵箱中培养,直至形成单层细胞,倾出培养液,加入抗体诱导的不同时间段的PBMC培养1 d。对照组不作用胃癌细胞,收获细胞,-70℃保存备用。
1.2.3 体外淋巴细胞毒试验 以上法在培养瓶中培养效应细胞,将肿瘤细胞用胰酶消化,调细胞至不同浓度,依次分为4组:实验组1和实验组2将活化的PBMC与肿瘤细胞(效靶细胞)按20∶1接种至96孔板,效、靶体积均为100 μl组2加1×108mmol/L CI-988;实验组3用CD80(0.4 mg/L)的100 ml/L胎牛血清的RPMI1640培养基培养;对照组用100 ml/L胎牛血清的RPMI1640培养基正常培养。每天胰酶消化法计数每组4孔,绘制细胞在不同条件下的生长曲线,共同培养24 h,终止培养前加入MTT10 μl(5 mg/ml),37℃含5%CO2恒温培养箱中培养4 h,弃上清液,加入DMSO 150 ml,充分溶解,570 nm波长酶标仪检测OD值。杀伤率=[1-(实验孔OD值-效应孔OD值)/靶细胞孔OD值]×100%。
1.2.4 电镜观察 将PBMC作用不同时间肿瘤细胞,用PBS清洗,加固定液,边固定边吹打,使细胞与固定液充分混匀,30min后,300r/min离心10min,弃上清,加固定液混匀过夜,离心半径8 cm 3 000 r/min离心15 min收集细胞。
1.2.5 悬浮生长细胞的凋亡检测 活化的PBMC和CD80(0.4 mg/L)和肿瘤细胞共同培养72 h后,用橡皮刮收集悬浮生长的细胞,800~1 000 r/min离心5 min,弃上清液,加入预冷的1X结合缓冲液100 μl重悬细胞,置冰浴。加入5 μl Annexin V-FITC和5 μl PI于细胞悬液中轻轻混匀。将试管置于4℃避光染色10 min。补加490 μl结合缓冲液混悬细胞,上流式细胞仪分析。
1.3 统计学处理 在SPLM软件中输入实验中各测定值,采用未配对计量资料的t检验及χ2检验进行统计学处理。
2 结 果
2.1 细胞杀伤作用 活化的外周血PBMC对肿瘤细胞均有较强的杀伤作用,效应细胞,靶细胞之比需要达到20∶1,才能达到半数杀伤率。CD80与CD28/CpG ODN活化的PBMC合用,对胃癌细胞株MKN45细胞的杀伤作用显著大于CD80本身对胃癌细胞株MKN45细胞杀伤作用(P<0.01),亦大于单独应用CD28/CpG ODN活化PBMC对胃癌细胞株MKN45细胞的杀伤作用(P<0.05),且靶细胞只达到15∶1就能达到半数杀伤率。主要指标见表1、图1。
表1 不同处理对胃癌细胞株MKN45细胞的杀伤率(n=3,±s,%)

表1 不同处理对胃癌细胞株MKN45细胞的杀伤率(n=3,±s,%)
?

图1 细胞生长曲线
2.2 电镜结果 共刺激细胞与肿瘤细胞共同培养12 h后可见,大部分细胞已经死亡,兼有坏死及凋亡细胞。早期凋亡细胞胞浆浓缩,核浓缩,染色质边集,形成花环状;出现较多的凋亡小体(图2),小体有完整的膜包裹,异染色质边集,可见电子密度致密的核碎片,膜内可见细胞器及脂质空泡;同时见活化的T细胞有较多的微绒毛、细胞体积大,胞浆变得较为丰富,核大,电子密度低,核仁明显。
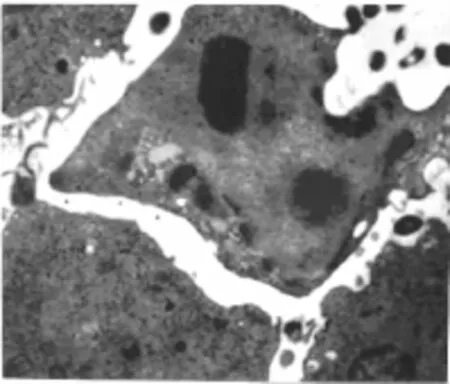
图2 早期凋亡细胞电镜图(醋酸铀及枸橼酸铅双染色6 000×)
2.3 流式细胞仪结果 流式细胞仪FCM图像可见实验组细胞群坏死细胞占 31.2%,凋亡细胞占22.1%。而对照组仅有坏死细胞0.1%,凋亡细胞1.7%。经统计学处理,有非常显著性差异(P<0.01)。
3 讨 论
T细胞受体(TCR)是参与特异性免疫的重要分子,在T淋巴细胞活化过程中识别和结合配体。研究发现正常个体在抗原刺激下,外周血淋巴细胞(PBLs)TCRVβ基因随抗原类型不同或疾病的不同临床阶段呈选择性扩增[1]。近年来对于CpG ODN的认识越来越深入,其诱生的IL-12、INF-α、TNF对肿瘤细胞均有抑制杀伤作用,并促使TH0细胞转化成为Th1细胞,因此其在肿瘤治疗方面亦渐成为热点[2-4]。国外已有人基于体外容易得到的人外周血单个核细胞(PBMC),用CD3、CD28抗体在体外扩增活化T淋巴细胞,利用激活表型为CD8+CD25+的杀伤细胞回输治疗免疫力下降引起的感染与肿瘤发生作为肿瘤免疫治疗的新手段[5]。TCR CD3复合体接受抗原或相应MOAb刺激后,可导致多个与之相关的蛋白质酪氨酸激酶(PTK)的活化,并通过一些PTK的底物来介导细胞内的效应,调控核内基因转录,导致T细胞活化增殖,发挥效应功能。至于不同的效应细胞与靶细胞比值(简∶效∶靶细胞比值)的杀伤效果评价,本文结果显示,靶细胞浓度反应比值对不同的肿瘤细胞均有一定的杀伤作用,要达到半数致死量,效∶靶细胞比值应不小于20∶1,但是CD80与CD28/CpG ODN共刺激活化PBMC合用,只要达到15∶1就能达到半数杀伤率。本文结果还显示,体外培养6 d,1 mmol/L活化T细胞和CD80(0.4 mg/L)分别可致胃癌细胞株MKN45细胞生长抑制率达91%和52%,与文献报道一致,二者联合使用杀伤作用更明显,于培养3 d和6 d,抑瘤率达40%和97%。MTT法检测杀伤率,联合应用1 mmo1/L活化外周血PBMC和1×10-8mmol/L CI-988较单用任何一种其杀细胞作用更明显(P<0.05)。联合应用二者抑瘤效果较单用任何一种措施更明显(P<0.05)。透射电镜下体外培养可见兼有凋亡与坏死征象,这种现象同时也在体外细胞培养的流式细胞仪检测中得到证实。笔者前期实验已经证实活化T细胞引起结肠癌HT-29细胞死亡的过程中有凋亡机制参与,因此认为,CD80可能通过提高结肠癌细胞对凋亡刺激的敏感性而与活化T细胞产生协同治疗作用。本文结果验证了活化外周血PBMC系统和CD80对胃癌在体外细胞培养中的杀伤作用,同时证明联合应用CD80可以提高活化外周血PBMC对胃癌细胞的杀伤作用。
[1]傅体辉.T细胞识别肿瘤的分子机制.国外医学免疫学分册,1995,18(1):23-26.
[2]Towmsend E,Allison JP.Tumor rejection after direct costimulation of CD8+T cells by B7-transfected milanona cells.Science,1994,259(5093):368-370.
[3]Faillard F.CpG:the double-edged sword.Human Gene Ther,1999,10(13):2089-2090.
[4]Walker L S,Gulbranson-Juase A,Flynn S,et a1.Costimulation and selection for T cell help for germinal centres:the role of CD28 and OX40.Immunomol Today,2OO0,21(7):333-337.
[5]任 欢,邢淑贤,徐红薇,等.CIK的体外增殖及体内外杀瘤活性的实验研究[J].中国肿瘤生物治疗杂志,1999,6(1):17-21.
