ER48660型锂/亚硫酰氯电池热分析
2010-04-21王艳峰胡欲立王家军
王艳峰,胡欲立,王家军
(西北工业大学航海学院,陕西西安 710072)
锂/亚硫酰氯电池是新一代绿色高能一次电池,具有比能量高、体积小、放电电压大、无记忆效应等突出优点,近年来经过大力发展,已经被广泛应用于航空、航天、航海等诸多领域。自从上世纪70年代以来,国内外许多科技工作者已经对锂/亚硫酰氯电池的很多特性做了广泛而深刻的研究。K.M.Abraham等人共同研究了锂/亚硫酰氯电池的循环伏安特性和电化学性能[2]。H.V.Venkatasetty等人通过向锂/亚硫酰氯电池的电解液添加不同的惰性有机电解质改变并测量了它的电化学性能[3]。F.M.Delnick深入研究了锂/亚硫酰氯电池正极钝化膜转移电荷的能力[4]。Y.L.Zhang等人通过实验发现了锂/亚硫酰氯电池的电极在LiAlCl4-SOCl2溶液中的生长机理[5]。M.Jakie等人细致研究了多孔碳对锂/亚硫酰氯电池电极性能的影响[6]。C.H.Kim等人共同研究了锂/亚硫酰氯电池负极钝化膜的生长机理[7]。P.W.Krehl等人一起研究了锂/亚硫酰氯电池的放电曲线[8]。李长明等人一起研究了锂/亚硫酰氯电池的极化曲线[9]。E.S.Takeuchi等人通过实验共同测量了锂/亚硫酰氯电池基本的热物理参数[10]。但是过去几十年对锂/亚硫酰氯电池的大量研究主要集中在它的电化学领域,对其热物理性质的研究少之又少。根据我国最近制定的锂电池安全使用规范可知,所有锂电池放电时内部最高温度不得超过80℃。原因是当锂电池放电时,由于内阻发热,极化放热及化学反应放热等可导致电池内部温度快速升高,尤其是许多电池在密闭空间内以大电流长时间放电时,内部温度上升更加明显。当温度超过一定程度时,极易导致电池放电电压急剧下降,即形成所谓的“死电池”,或使电池泄放,甚至爆炸[11]。因此当锂电池放电时对其内部进行热分析是非常必要的。本文中利用FLUENT 6.2软件对ER48660型锂/亚硫酰氯电池放电时内部温度随时间的变化关系和温度分布情况进行了计算机仿真分析,并研究了不同放电电流和不同表面传热系数对它们的影响。
1 计算模型
1.1 理论分析
理论分析部分主要建立了ER48660型锂/亚硫酰氯电池热分析的数学物理模型和计算方法,并对电池内部发热和散热情况进行了详细分析。
ER48660型锂/亚硫酰氯电池的负极是金属锂,正极是多孔碳,SOCl2既是电解液,又是正极活性物质,LiA lCl4是电解质。
电池放电时总的化学反应:

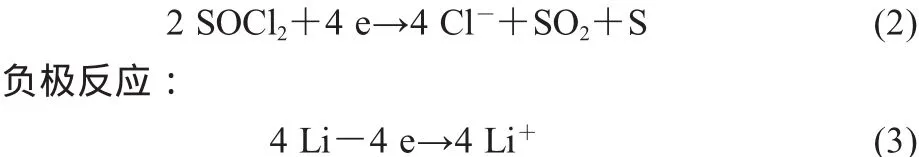
对ER48660型锂/亚硫酰氯电池进行热分析时,其相关参数如表1所示。

表1 ER48660型锂/亚硫酰氯电池热物理参数
由ER48660型锂/亚硫酰氯电池的特性可知,在放电过程中,电池内阻随温度的增加而变大,其变化范围是0.1~0.2Ω,根据欧姆定律可以知道,电池的输出电压将逐渐降低,实际应用中,为了防止电池过放危险,当放电电压低于3 V时,将停止放电。
根据ER48660型锂/亚硫酰氯电池的结构组成可知,其放电时热量传递过程包括三个环节:(1)从电池内部区域到电池内壁的热量传递;(2)从电池内壁到外壁的热量传递,即固体壁导热;(3)从电池外壁到外界环境的热量传递,即电池壳体与空气之间的自然对流传热和辐射换热。
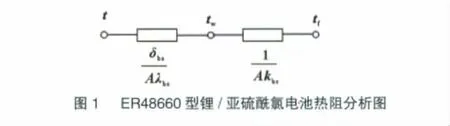
由上述分析可知,ER48660型锂/亚硫酰氯电池放电时热量传递过程的热阻分析[12]如图1所示。图中:t—电池内部温度,℃;tw—电池壁面温度,℃;tf—电池外部环境温度,℃;δbs—电池壁面厚度,m;λbs—电池壁面导热系数,W/(m·K);kbs—电池壁面表面传热系数,W/(m2·K);A—电池壁面面积,m2。
根据Johnson、Salkind和Schlai[13-14]等人的研究成果可知,锂/亚硫酰氯电池放电时热流量主要是通过内阻发热,极化放热和化学反应放热产生的。Bernadi等人认为锂/亚硫酰氯电池内部热流量是均匀产生的[15],所以电池内部区域单位体积单位时间内热生成率可以用下列公式计算:

式中:Q——电池内部单位时间单位体积内热生成率,W/m3;Ib——电池放电电流,A;Vb——电池总体积,m3;Eoc——电池开路电压,V;E——电池放电电压,V;Rb——电池内阻,Ω;r——电池半径,m。
1.2 简化假设
为了建立ER48660型锂/亚硫酰氯电池热分析的数学物理模型[16],我们首先对其做下述简化及假设:(1)由于电池内部电解液流动性很差,所以忽略内部电解液对流换热的影响;(2)由于电池内部电极辐射换热的影响很小,所以忽略内部电极辐射换热;(3)假设电池两端面绝热,内部电解液、电解质等物质各向同性,且温度只沿径向变化,沿轴向基本不变;(4)假设电池内部除热阻外其他各项热物理参数不随温度变化;(5)假设电池内部热流量是均匀产生的[15]。
根据上述简化及假设可知,ER48660型锂/亚硫酰氯电池内部热分析可简化成常物性、有内热源的三维非稳态传热问题[12]。
1.3 控制方程
1.3.1 电池内部区域微分方程及边界条件[12,17]

1.3.2 电池内壁到外壁的传热
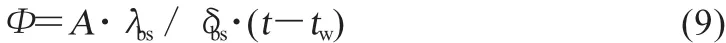
式中:Φ——从电池内部通过电池壁面传递到外界环境的热流量,W。
1.3.3 电池外壁与外界环境的传热[12,17-18]
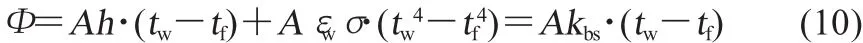
式中:Φ——从电池外壁向外界环境传递的热流量,W;h——电池外壁自然对流表面传热系数,W/(m2·K);εw——电池壁面材料的发射率;σ——斯特番-波耳兹曼常数,W/(m2·K4)。
1.4 边界条件
表2为ER48660型锂/亚硫酰氯电池热分析边界条件。

表2 ER48660型锂/亚硫酰氯电池热分析边界条件
1.5 网格划分
由于ER48660型锂/亚硫酰氯电池内部热分析可简化成常物性、有内热源的三维非稳态传热过程,因此本文中取锂/亚硫酰氯电池的1/8圆柱体进行计算机仿真分析[18],计算网格如图2所示。

2 结果分析
2.1 不同放电电流对电池内部温度随时间变化关系的影响
ER48660型锂/亚硫酰氯电池工作时,放电电流不同,单位时间单位体积内的热生成率不同,对电池内部温度梯度和温度场分布的影响也不同。利用FLUENT 6.2软件分析计算了ER48660型锂/亚硫酰氯电池以不同电流连续放电7 h,且电池表面与外界环境的表面传热系数为10W/(m2·K)时,电池内部温度随时间的变化曲线,结果如图3所示。
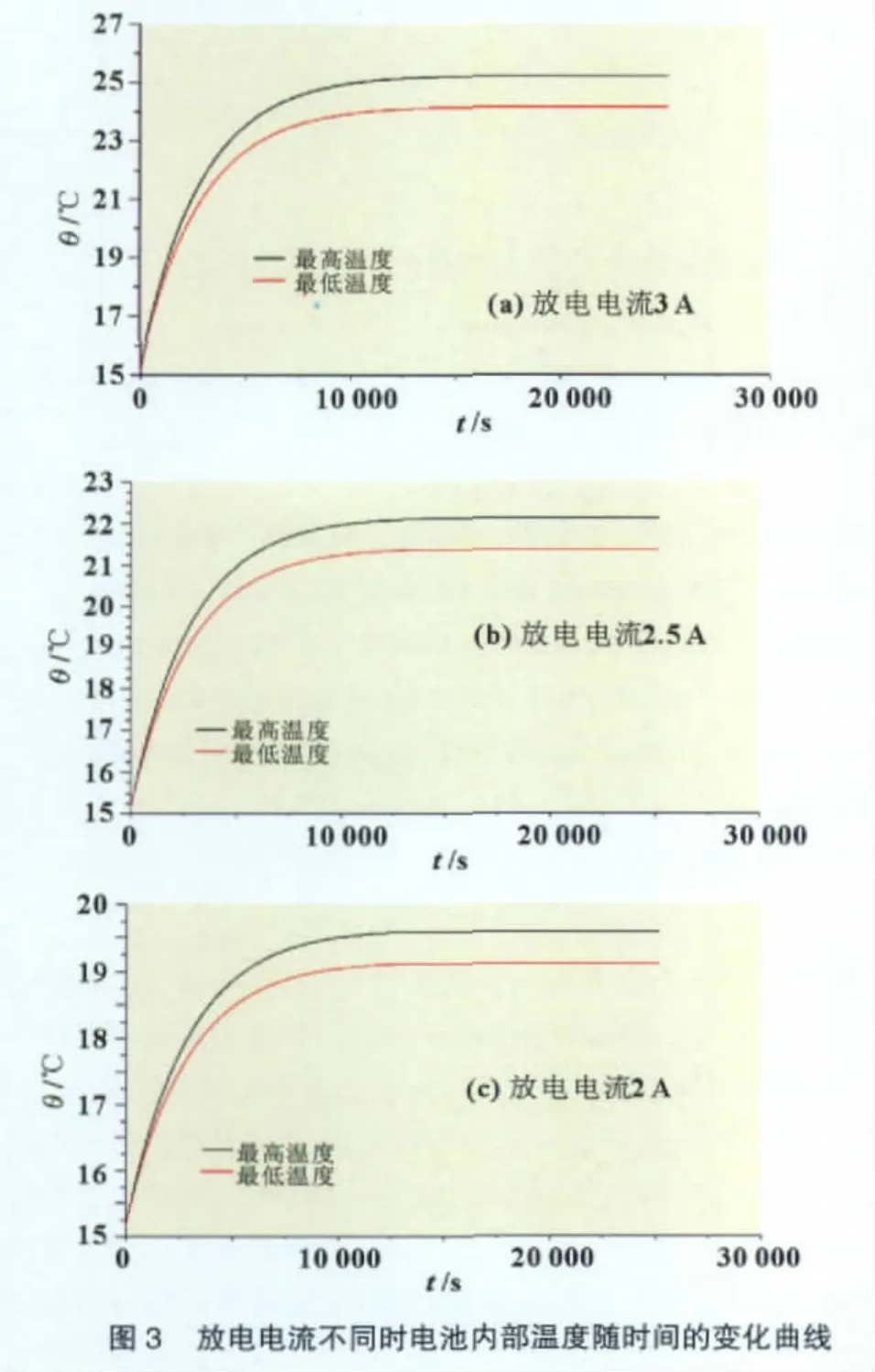
根据图3可知,电池表面传热系数是10W/(m2·K),放电时间是7 h,放电电流是3 A时,电池内部最高温度是25.1℃,温差是1.1℃;当放电电流是2.5 A时,最高温度是22℃,温差是0.8℃;当放电电流是2 A时,最高温度是19.4℃,温差是0.4℃。而上述三种情况下电池内部温度到达稳态的时间均为3 h左右。由此可知,放电电流越大,电池内部温度越高,温差也越大。造成这个现象的主要原因是:放电电流越大,产生的热流量则越多,电池内部温度就越高;同时由于电解液的传热性能较差,所以电池内部温度分布的均匀性就较差;但是当电池表面传热系数不小于10W/(m2·K)时,电池内部产生的热流量能够较快地传递到外界环境,所以虽然放电电流不同,但是电池内部温度到达稳态的时间却基本不变。
2.2 不同表面传热系数对电池内部温度分布的影响
ER48660型锂/亚硫酰氯电池与外界环境的热量传递主要是外壁与空气的自然对流换热和辐射换热,不同的表面传热系数对电池内部温度梯度和温度场分布具有重要的影响。利用FLUENT 6.2软件分析计算了ER48660型锂/亚硫酰氯电池与外界环境的表面传热系数不同时,以3 A电流连续放电7 h,电池内部温度分布情况,结果如图4所示。
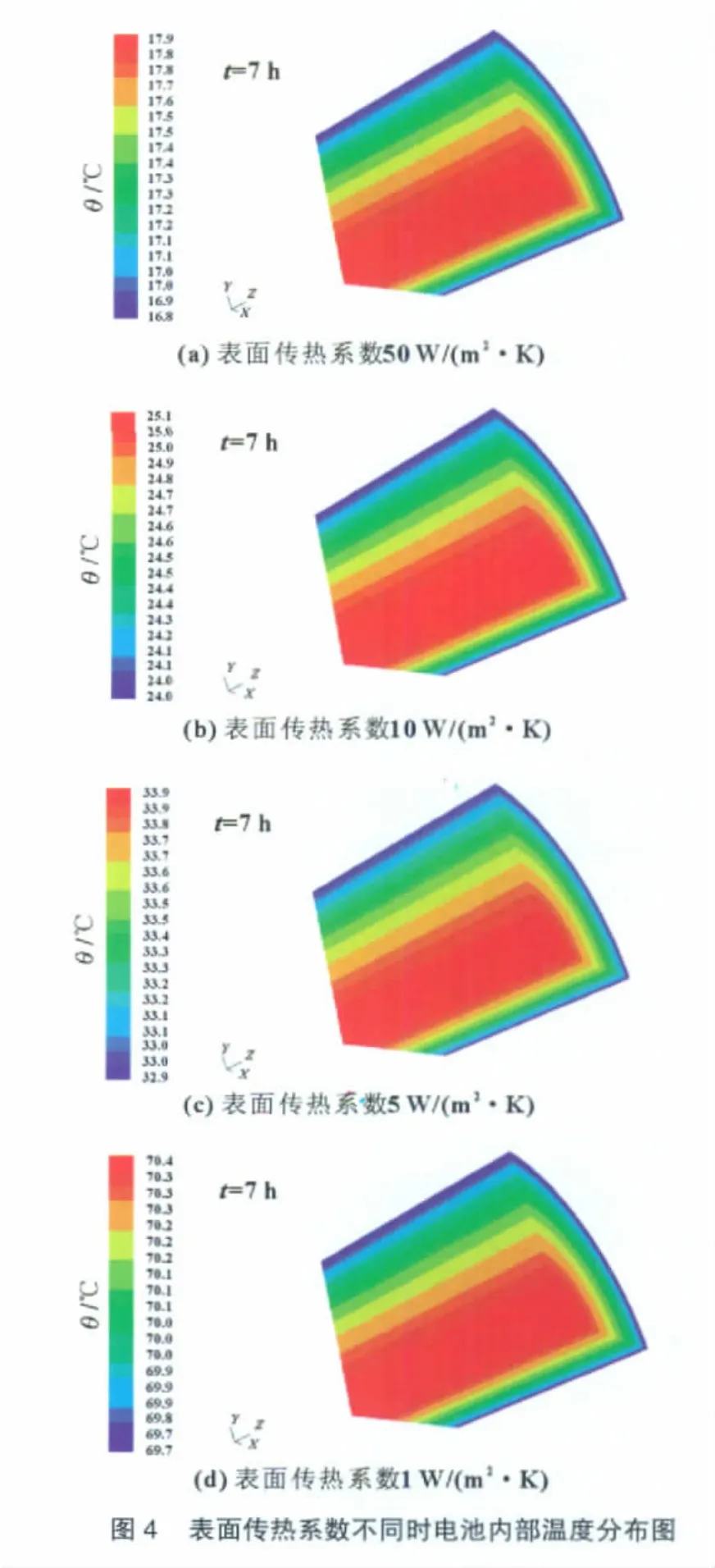
根据图4可知,当电池放电电流3 A,放电时间7 h,表面传热系数50W/(m2·K)时,电池内部最高温度是17.9℃,温差是1.1℃;当表面传热系数10W/(m2·K)时,最高温度是25.1℃,温差是1.1℃;当表面传热系数5W/(m2·K)时,最高温度是33.9℃,温差是1℃;当表面传热系数1W/(m2·K)时,最高温度是70.4℃,温差是0.7℃。即电池表面传热系数越大,到达稳态的时间越短,电池内部温度越低。当表面传热系数小于10W/(m2·K)并逐渐增大时,温差增加;当表面传热系数大于10W/(m2·K)并逐渐增大时,温差基本不变。造成这个现象的主要原因是:电池表面传热系数越大,通过电池表面散发的热流量就越多,电池内部温度就越低,到达稳态的时间就越短。当电池表面传热系数小于10W/(m2·K)时,电池表面与外界环境之间的对流换热和辐射换热不足以将到达电池壁面的热流量快速散发到外界环境,所以表面传热系数越大,温差越大;但当表面传热系数大于10W/(m2·K)时,到达电池壁面的热流量都能被很快地散发到外界环境,此时由于电池内部电解液的导电性较差,所以温差基本不变。
3 结论
本文通过理论分析并结合实际情况建立了ER48660型锂/亚硫酰氯电池热分析的数学物理模型和计算方法,并利用FLUENT 6.2软件仿真分析了ER48660型锂/亚硫酰氯电池连续放电7 h后内部温度分布情况,根据上述分析可得出如下结论:(1)电池放电电流越大,单位时间内产生的热流量越多,电池内部温度越高,温差越大;(2)电池表面传热系数越大,单位时间内通过电池表面与外界环境交换的热流量越多,电池内部温度越低,到达稳态的时间越短。当电池表面传热系数小于10W/(m2·K)并逐渐增大时,温差增大;当电池表面传热系数大于10W/(m2·K)并逐渐增大时,温差基本不变。
[1] 唐致远,陈玉红.锂/亚硫酰氯电池安全性的研究[J].电池,2006,36(1):74-76.
[2]ABRAHAM K M,MANK R M.Some chem istry in the Li/SOCl2battery[J].JElectrochem Soc,1980,127(10):2091-2096.
[3] VENKATASETLY H V.Cyclic voltammetric and spectroscopic studies of SOCL2solutions[J].JElectrochem Soc,1980,127(11):2531-2534.
[4] DELNICK FM.The kineticsof charge transfer reactions on passive LITHIUM electrodes[J].JPower Sources,1989,26(1-2):129-138.
[5] ZHANG Y L,CHA C S.Study of the surface film on lithium in LiAlCl4-SOCl2electrolyte[J].Electrochem ica Acta,1992,37(7):1211-1216.
[6]JAKICM,KOVACM.Influence of carbon black type on anode and cathode electrical properties in Li/SOCl2batteries[J].Electrochemica Asta,1995,40(17):2723-2729.
[7] KIM C H,PYUN S I.Grow th kinetics of lithium chloride layer formed on porous carbon cathodes during discharge of Li/SOCl2batteries[J].JElectrochem ica Soc,2003,150(9):A 1176-A 1181.
[8]KRECHL PW,LIANG C C.The technology of the Li/BrCl in SOCl2in organic battery system:Performance and self-discharge characteristics follow ing long-term storage[J].JAppl Electrochem,1983,13:451-458.
[9] LICM,ZHA Q X.The polarizing linesof Li/SOCl2battery'snegative electrode[J].Acta Physics-Chem ical Sinica,1989,5(2):243-245.
[10]TAKEUCHIE S,MEYER SM.Assessmentof capacity loss in lowrate lithium/brom ine chloride in thionyl chloride cells by m icrocalorimetry and long-term discharge[J].JElectrochem Soc,1990,137(6):1665-1669.
[11] WANG F,LIM D.Analysis of temperature field for batteries[J].Chinese Journalof Power Source,2010,34(3):288-291.
[12] 陶文铨.传热学[M].西安:西北工业大学出版社,2006.
[13]JOHNSON D H,AYERSA D.Design of a safe cylindrical lithium/thionyl chloride cell[J].Journalof Power Source,1984,12:61-70.
[14] CARL R S.The kinetics of the reduction of thionyl chloride[J].Journal Power Sources,1989.26:161-175.
[15] BERNADID,PAWLIKOW E,NEWMAN J.A general energy balance for battery system[J].JElectrochem Soc,1985,132(1):5-12.
[16] WANG JP,HU Y L.Analysis of temperature field for lithium-ion battery[J].Journalof Battery Technology,2008,32(2):120-131.
[17] 陶文铨.数值传热学[M].西安:西安交通大学出版社,2001.
[18] 韩占忠,王敬.FLUENT流体工程仿真计算实例与应用[M].北京:北京理工大学出版社,2004.
