热轧对Mg-Li-Al-Ce合金电极放电性能的影响
2010-04-21杨丛荣李云虎王贵领曹殿学
杨丛荣,汤 胜,李云虎,王贵领,曹殿学
(哈尔滨工程大学材料科学与化学工程学院超轻材料与表面技术教育部重点实验室,黑龙江哈尔滨 150001)
镁电化学当量高且在中性电解液中具有良好的放电特性,因而广泛用作海水激活电池、金属-过氧化氢和金属-海水中溶解氧半燃料电池等水下电源的阳极材料[1-5]。镁作为化学电源阳极存在着自腐蚀析氢、表面钝化、电位滞后、负差效应等问题,导致镁的利用率低和电池对负载变化相应慢。在镁中添加合金元素(电极添加剂)可降低镁的自腐蚀速率和抑制钝化膜的形成或促使其脱落,从而提高镁阳极的利用率和改善其放电性能。目前常用的电极添加剂有Al、Pb、Ga、Zn、Mn等。
Li是最活泼的阳极材料,其电化学当量(3.86 Ah/g)和理论比能量(13.0 kWh/kg)均高于Mg、A l和Zn等。在Mg合金中添加Li,可改善传统Mg合金的放电活性及板材轧制性能,并降低Mg合金的滞后效应[6-9]。Sivashanmugam等[6]研究了Mg-13Li作为Mg-Li/MgCl2/CuO海水激活电池阳极材料的性能,发现电池的工作电压和容量均高于以Mg-Al合金为阳极的电池,电池在8.6mA/cm2的电流密度下,阳极电流效率可达81%。Cao等[7-9]最近的研究发现,在NaCl溶液中,Mg-Li系合金的放电电流高于AZ31镁合金,且电流对电压的变化响应快。Mg-Li二元合金中随Li含量增加,放电电流增加,但合金的利用率降低。降低Mg-Li合金中Li含量同时添加A l、Ce、Zn、Mn等元素可有效提高合金的放电效率。本文研究了三种Mg-Li-Al-Ce合金在NaCl溶液中的放电行为,考察了热轧对合金电极放电电流和利用效率的影响。
1 实验
1.1 合金电极的制备
实验用铸态Mg-Li-A l-Ce合金由99.99%的高纯金属铸锭(铈以镁铈中间合金的形式加入)在真空感应炉中于氩气下熔炼而成[7]。将铸态镁合金加热到300℃下保温4 h后,以每道次10%~20%的压下量轧制5道次获得轧制镁合金样品。合金成分的质量百分比见表1。制备的合金切割成1 cm×1 cm×1mm的薄片,经800#和1 200#水磨砂纸打磨,丙酮除油,去离子水(M illi-Q)洗涤后作为测试电极,合金成分采用ICP-MS分析。
1.2 电化学测试
电化学测试在三电极体系中进行[7]。合金为工作电极,暴露于电解液中的表面积为0.95 cm2。镀有铂黑的铂网为对电极,饱和甘汞电极(SCE)为参比电极。电解液为0.7mol/dm3NaCl溶液,测试前用高纯N2脱氧15m in,测试在室温氮气保护下进行。电化学测试仪器是美国Princeton Applied Research公司生产的VMP3/Z型电化学工作站。文中电位均相对于SCE。利用效率的测量采用失重法,将放电后合金电极表面的反应产物去除后,干燥、称重,利用放电电量和合金失重量计算利用率[7]。扫描电镜(SEM)分析在日本JEOL JSM-6480A扫描电镜上进行。
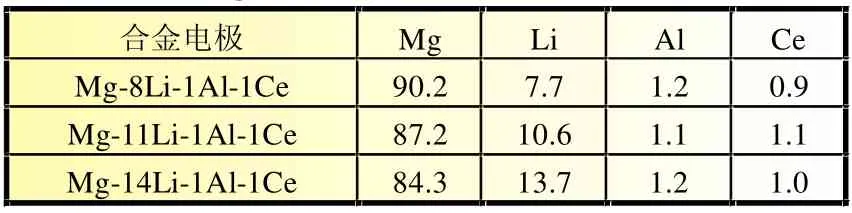
表1 Mg-Li-AI-Ce合金质量百分组成 %
2 结果与讨论
在0.7mol/dm3NaCl溶液中,三种铸态Mg-Li-Al-Ce合金的开路电位均在-1.52 V左右,轧制后合金的开路电位降至-1.61 V左右。本研究选择了比开路电位稍正的四个电位来进行电化学氧化,分别为-1.4、-1.2、-1.0 V和-0.8 V,在这四个电位下分别恒压放电1 h。图1和图2分别是三种铸态及热轧后的Mg-Li-Al-Ce合金在0.7mol/dm3NaCl溶液中于-1.0 V下恒电位氧化的电流-时间曲线。

比较图1和图2可见,三种Mg-Li-Al-Ce合金经过热轧后,其放电电流比铸态时均有显著提高。热轧后,Mg-11Li-1A l-1Ce和Mg-14Li-1Al-1Ce合金放电更加平稳,三种合金中Mg-14Li-1A l-1Ce合金的放电电流最大,热轧的Mg-14Li-1A l-1Ce合金在-1.0 V放电1 h后电流密度可达到59mA/cm2,比铸态合金提高了约16mA/cm2。上述结果表明,进行热轧处理和提高合金中Li的含量均可提高合金的放电性能。热轧对性能的提高可能是由于在热处理和轧制过程中,合金中成分分布和晶粒分布变得更加均匀所致。Li含量增加导致活性增加则可能是由于Li电位更负而放电活性更高所致。
图3为热轧后的Mg-14Li-1Al-1Ce合金在不同电势下的放电曲线。由图可见,Mg-14Li-1Al-1Ce合金的电流-时间曲线在初始放电阶段电流迅速增大,并在短时间内稳定为最大值。这是由于初始阶段合金电极表面光滑,无氧化产物,电解液可与合金表面直接接触,产生最大电流。随着放电时间的延长,氧化产物不断形成并在合金表面积累,阻断部分合金表面与电解液的接触,导致放电电流呈缓慢下降趋势。电位越正,电流下降趋势越明显;这是因为电位越正,产物的生成速率越快所致。-0.8 V下的放电曲线在约1 500 s和3 000 s处电流出现明显的突跃,这是由于附着在合金电极表面的氧化产物脱落,暴露出合金表面,从而增大反应面积所致。
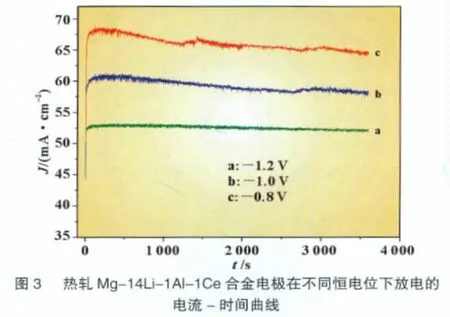
图4为铸态和热轧后的Mg-14Li-1A l-1Ce合金电极在-1.0 V恒定电势下放电1 h后电极表面的SEM图。由图可见,铸态和热轧后的合金电极在放电后晶界处均出现宽而深的裂纹,表明放电或自腐蚀溶解反应优先发生在晶界处。铸态合金的晶粒分布不均匀,表面放电程度也不均匀,出现深浅不同的凹陷。热轧后的合金晶粒分布变得更加均匀且晶粒尺寸变大,这是由于热处理匀化和压延造成的。合金电极表面基本是均匀放电,未出现明显的凹陷。表明热轧有利于提高合金的放电性能。

表2是三种铸态和热轧的Mg-Li-A l-Ce合金电极在0.7 mol/dm3NaCl溶液中-1.0 V恒电位放电1 h后测得的合金电极的利用效率。由表可见,轧制后合金电极的利用效率较铸态合金电极有所提高,这与轧制后的合金表面放电较均匀有关。而铸态合金放电时产生凹陷(图4),可能导致部分合金在未完全放电前脱落,使得其利用率较轧制的合金电极低。随合金电极中Li含量增加,合金的利用效率均显著下降,这是由于Li的自腐蚀速度比Mg快,在放电的同时发生快速的自腐蚀,导致部分合金发生化学溶解,从而降低了合金的有效利用率。因此,从利用效率的角度看来,低Li含量的合金优于高Li含量的合金。

表2 Mg-Li-AI-Ce合金电极在-1.0 V恒电位放电1 h后的利用效率
3 结论
(1)铸态Mg-Li-Al-Ce合金经过热轧后,其开路电位变负、氧化电流和利用率提高。轧制的合金表面放电更均匀。
(2)随着合金中Li含量的增加,合金的恒电位氧化电流增加,但利用率降低。
[1]MEDEIROSM G.,BESSETTER R,DESCHENESCM,et al.Magnesium-solution phase catholyte sem i-fuel cell for undersea vehicles[J].JPower Sources,2004,136:226-231.
[2]YANGW,YANG S,SUNW,etal.Nanostructured palladium-silver coated nickel foam cathode formagnesium-hydrogen peroxide fuel cells[J].Electrochim Acta,2006,52:9-14.
[3] HASVOLD O,LIAN T,HAAKAASE,et al.Clipper:A long-range,autonomous underwater vehicle using magnesium fuel and oxygen from the sea[J].JPower Sources,2004,136:232-239.
[4]HASVOLDO.Amagnesium-seawater power source for autonomous underwater vehicles[J].J Power Sources,1993,14:243-255.
[5]UDHAYAN R,MUNIYANDIN,MATHUR PB.Studies onmagneslum and its alloys in battery electrolytes[J].British Corrosion Journal,1992,27:68-71.
[6] SIVASHANMUGAM A,KUMAR T P,RENGANATHAN N G,et al.Performance of a magnesium-lithium alloy as an anode for magnesium batteries[J].JAppl Electrochem,2004,34:1135-1139.
[7] CAO D,WU L,SUN Y,et al.Electrochem ical behavior of Mg-Li,Mg-Li-Al and Mg-Li-A l-Ce in sodium chloride solution[J].JPower Sources,2008,177:624-630.
[8]CAO D,WU L,WANG G,etal.Electrochem ical oxidation behavior of Mg-Li-A l-Ce-Zn and Mg-Li-Al-Ce-Zn-Mn in sodium chloride solution[J].Journalof Power Sources,2008,183:799-804.
[9] 吴林,吕艳卓,曹雪,等.Mg-Li电极在NaCl溶液中的电化学行为[J].电化学,2009,15(20):198-201.
