紫杉醇对乳腺癌细胞紫杉醇耐药基因Txr1表达的影响
2010-04-06马雪梅白志刚张忠涛屈翔赵晓牧
马雪梅, 白志刚, 张忠涛, 屈翔, 赵晓牧
紫杉醇对乳腺癌细胞紫杉醇耐药基因Txr1表达的影响
马雪梅, 白志刚, 张忠涛, 屈翔, 赵晓牧
【摘要】
目的应用人乳腺癌细胞制备紫杉醇耐药细胞模型,探讨紫杉醇对乳腺癌细胞中紫杉醇耐药基因 Txr1 表达的影响。
方法比较紫杉醇预处理前后不同浓度紫杉醇对乳腺癌细胞的增殖和细胞周期的改变;用 RT-PCR 方法检测 Txr1、TSP1 和 MDR1 的 mRNA 水平变化;用 Western blot 检测 Txr1 和 TSP1 的蛋白质水平的变化。
结果紫杉醇预处理后,紫杉醇抑制乳腺癌细胞(MCF-7 细胞)的生长作用明显减弱。流式细胞仪分析表明,MCF-7 细胞经过紫杉醇作用后被阻滞于细胞周期的 G2M 期。紫杉醇作用于 MCF-7 细胞后,Txr1 的 mRNA 水平上调,TSP1下调,而 MDR1 表达无明显改变。类似的结果在蛋白的水平被 Western blot 进一步证实。
结论紫杉醇可能通过 Txr1 上调抑制 TSP1 的表达从而诱导肿瘤细胞的耐药性。
【关键词】乳腺肿瘤; 紫杉醇; 抗药性,肿瘤; 凝血酶敏感蛋白 1
www.cmbp.net.cn 中国医药生物技术, 2010, 5(6):429-433
乳腺癌是女性最常见的恶性肿瘤之一,并且其发病率呈逐年上升趋势。近年来,随着乳腺癌诊断手段的不断提高,治疗方法的不断完善,乳腺癌的死亡率呈现出下降的趋势[1]。在临床上乳腺癌的治疗主要采用手术、化疗、放疗和内分泌治疗相结合的综合治疗手段,并取得了显著的治疗效果,其中新型抗癌药物的出现起到重要的作用[2]。紫杉类药物是乳腺癌化疗的主要药物之一,但其存在的耐药性是当前亟需解决的问题。紫杉醇耐药的机制复杂,现有的耐药机制学说尚不能很好解释其相关机制。新耐药基因-紫杉醇耐药基因(taxol-resistance gene 1,Txr1)的发现对研究紫杉醇耐药机制提供了新的思路,但其在治疗乳腺癌中的耐药作用尚未见报道。我们拟应用乳腺癌细胞系 MCF-7,制备出对紫杉醇耐药细胞模型,研究 Txr1 的表达与MCF-7 细胞产生紫杉醇耐药的关系。
1 材料和方法
1.1 材料
紫杉醇购自协和药厂;TRIzol、Lipofectamine 2000 购自美国 Invitrogen 公司;BCA 蛋白定量试剂盒购自美国 Pierce 公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、溴化丙锭(PI)购自美国 Sigma公司;MMLV 逆转录酶购自美国 Promega 公司;Txr1 兔抗人多克隆抗体由斯坦福大学 Cohen 教授赠送;TSP1 兔抗人多克隆抗体(BA2130)、β-actin鼠抗人单克隆抗体购自美国 Sigma 公司;用含10% 的小牛血清(Gibco)的 DMEM 培养基培养的人乳腺癌细胞 MCF-7(ATCC)购自美国 Gibco公司,37 ℃,5% CO2培养箱中培养传代。
1.2 实验方法
1.2.1 紫杉醇对乳腺癌细胞株 MCF-7 耐药细胞模型的建立 在 96 孔板中接种 MCF-7 细胞(2 × l04/孔),置 37 ℃,5% CO2培养箱孵育过夜。细胞分为紫杉醇预处理组与对照组。紫杉醇预处理组分别加入不同浓度的紫杉醇(0.6、6 和 60 μg/ml),对照组加入稀释成相应浓度的紫杉醇,在培养第24、48、72、96、120 h,加入 MTT 20 μl(5 mg/ml),培养 4 h,再加入 DMSO 100 μl。溶解后用酶联检测仪(波长 A490 nm)测 OD 值,绘制细胞的生长曲线。紫杉醇预处理组细胞用 0.006 μg/ml 紫杉醇预培养 MCF-7 细胞 7 d,然后以相同条件进行上述实验,比较紫杉醇预处理与未处理两组细胞生长抑制的差异。
1.2.2 细胞周期的分析 收集对照组和紫杉醇预处理组细胞各 5 × 105个,70% 冷乙醇固定 4 ℃过夜,洗去固定液,缓冲液悬浮细胞。常温下核糖核酸酶 A(RnaseA)(10 mg/ml)20 μl 反应 1 h,再加入 PI(100 ng/ml)500 μl 避光染色 30 min,尼龙网(200 目)过滤,流式细胞仪检测,Cellquest软件分析细胞周期时相分布。
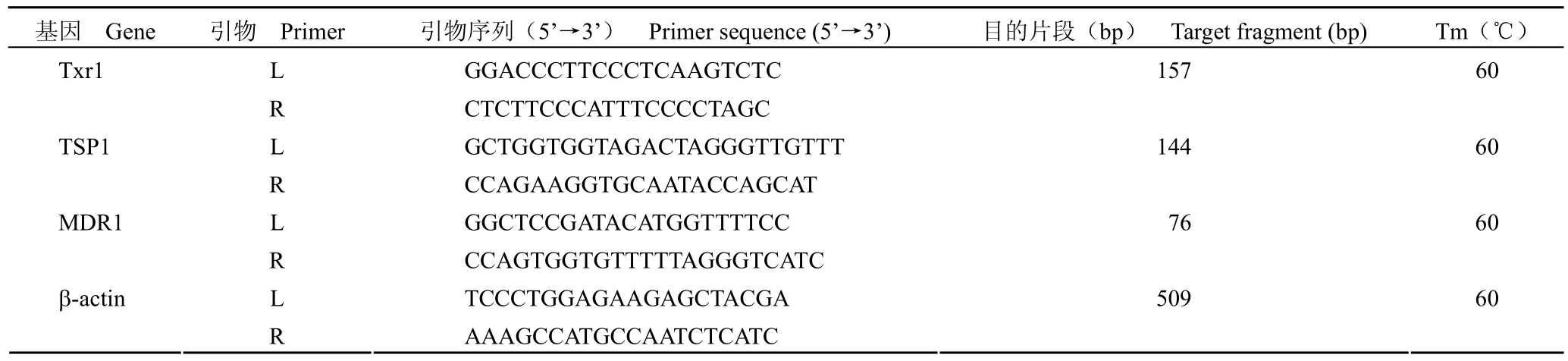
表 1 扩增基因引物Table 1 Primer of gene amplification
1.2.3 RT-PCR 分析 MCF-7 细胞相关基因的mRNA 表达 RT-PCR 检测 TXR1、TSP1、MDR1的 mRNA 表达,TXR1、TSP1、MDR1 和内参β-actin 引物 Primer Premier 5.0 见表 1。收集状态良好细胞,参照 TRIzol 试剂的说明抽提总量RNA,紫外分光光度计测定 RNA 浓度。逆转录为 20 μl 反应体系,总 RNA 2.0 μg,Oligo(dT)(10 nmol/L)1 μl,dNTP(10 mmol/L)1 μl,再加入焦碳酸二乙酯(DEPC)水,混匀,70 ℃ 5 min,冰浴 5 min,再加入 5 × M-MLV 缓冲液 4 μl,核酸酶抑制剂(40 U/μl)0.5 μl,10 mol/L dNTP 1 μl,M-MLVRT(逆转录酶)1 μl,37 ℃ 反应 60 min。PCR 反应体系为 25 μl:cDNA,1 μl;2 × MasterMix,12.5 μl;primers,各 1 μl;无菌三蒸水,9.5 μl。反应条件为 94 ℃ 预变性 5 min;94 ℃,30 s;60 ℃,30 s;72 ℃,1 min;延伸 72 ℃,7 min,30 个循环。内参为 β-actin,独立实验重复 3 次。电泳及半定量分析,扩增产物在 2% 琼脂糖凝胶中电泳(100 V,50 min),BIO-RAD Universal hood 成像系统分析各基因表达量,以各目的基因与 β-actin的灰度值之比作为相对表达量。
1.2.4 Western blot 蛋白水平 TXR1,TSP1 收集对数期生长细胞,总蛋白经 RIPA 抽提后 BCA 法蛋白定量,按照上样量为 50 μg 的量计算上样体积,余下用 SDS 上样缓冲液补足 20 μl,样品经β-2 巯基乙醇离心、加热变性处理后上样,电泳,5% 浓缩胶 60 V,12% ~ 15% 分离胶 120 V;电转移至 PVDF 膜上,5% 脱脂奶粉室温封闭 2 h,一抗(TXR1,1∶200;TSP1,1∶250;β-actin,1∶10000)4 ℃ 过夜,PBST 洗膜 3 次,HRP 标记的二抗(1∶4000)30 min,PBST 洗膜 3 次,暗室中 ECL发光。
1.3 统计学处理
采用 SPSS13.0 统计分析软件,分析各组间差异的显著性。 限定 P < 0.05 为差异有显著性,所有服从正态分布的数据均用±s表示,检验采用配对样本 t 检验或独立样本 t 检验。
2 结果
2.1 分析紫杉醇预处理对紫杉醇抑制 MCF-7 细胞增殖的影响
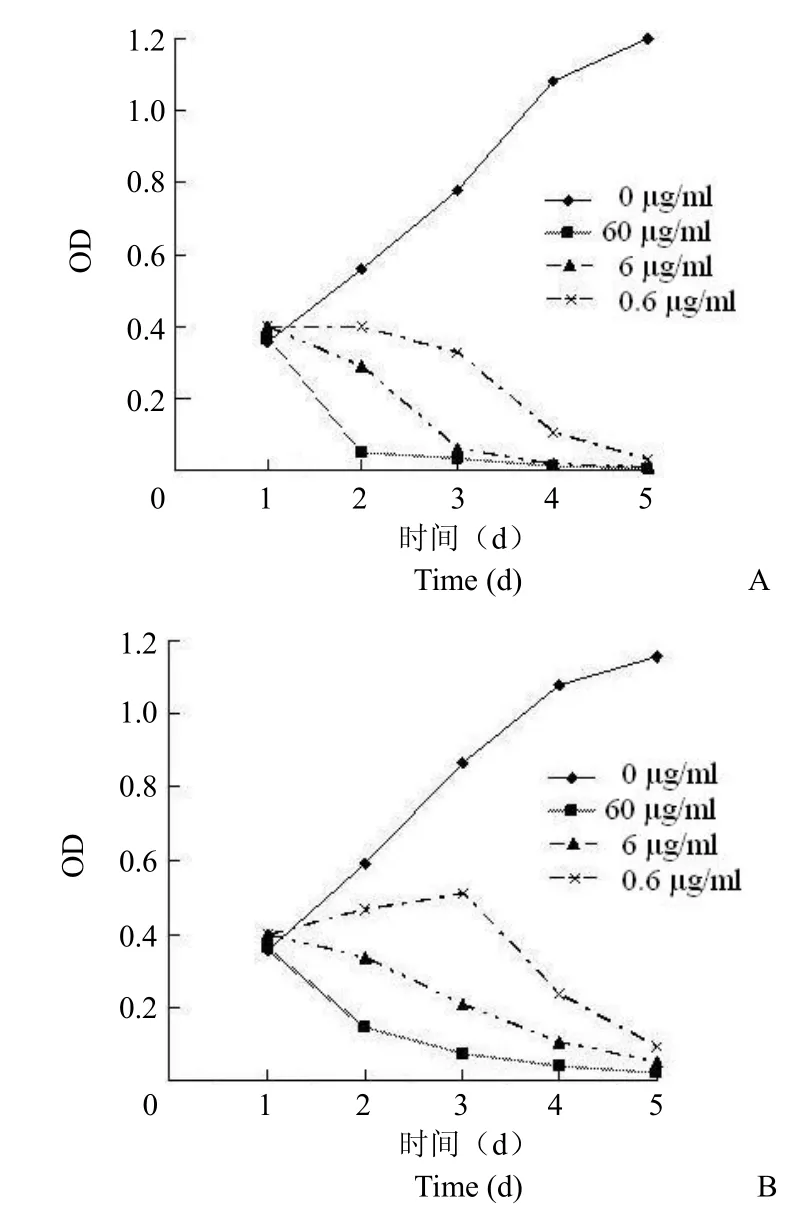
图 1 紫杉醇预处理对紫杉醇抑制 MCF-7 细胞增殖的影响(A:对照组;B:紫杉醇预处理组)Figure 1 Taxol pretreatment on the effect of Taxol inhibited proliferation of MCF-7 cells (A: Control group; B: Taxol pretreatment group)
紫杉醇对 MCF-7 细胞增殖的影响:0.6、6 和60 μg/ml 的紫杉醇均能抑制 MCF-7 细胞的生长,药物作用效果具有明显的时效和量效关系(均 P <0.01),见图 1A。然而,经紫杉醇预处理后,紫杉醇对 MCF-7 细胞增殖的抑制作用明显减弱(图 1B),与非预处理组相比两组间差异具有统计学意义。
2.2 分析紫杉醇预处理对紫杉醇抑制 MCF-7 细胞周期的影响
流式细胞仪检测表明:MCF-7 细胞经紫杉醇0.6、6 μg/ml 作用 24 h、48 h 后,G2M期细胞增多,G2M 期细胞和 S 期细胞的比值也随剂量呈递增关系;不同浓度的紫杉醇作用 MCF-7 细胞 48 h后,G2M 期细胞百分比均高于对照组(均 P <0.01),见表 2和图 2。G0G1 期和 S 期细胞减少。提示 MCF-7 细胞经过紫杉醇作用后被阻滞于G2M 期。然而,经紫杉醇预处理后,紫杉醇对MCF-7 细胞细胞周期的改变明显减小,两组间差异具有统计学意义。
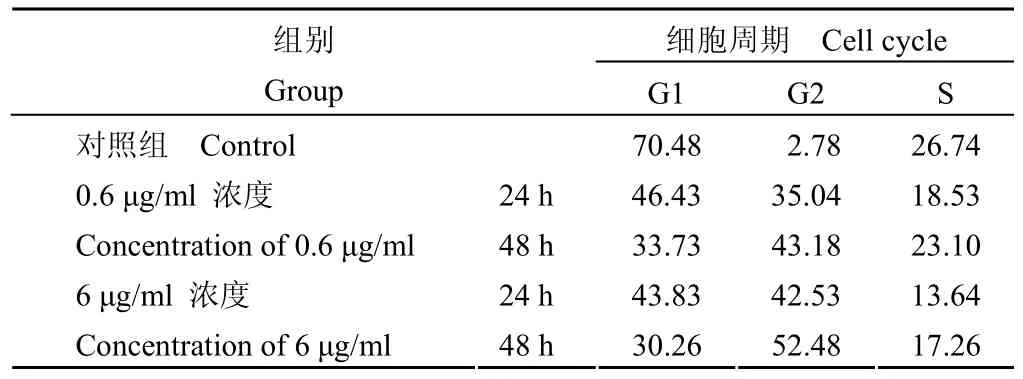
表 2 紫杉醇预处理对 MCF-7 细胞周期的影响Table 2 The effect of Taxol pretreatment on cell cycle of MCF-7
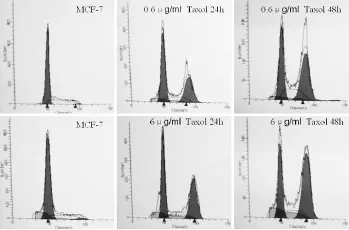
图 2 紫杉醇预处理对 MCF-7 细胞周期的影响Figure 2 The effect of Taxol pretreatment on cell cycle of MCF-7
2.3 紫杉醇预处理对 MCF-7 中 TXR1 mRNA 的表达的影响
MCF-7 细胞表达 TXR1、TSP1 和 MDR1。紫杉醇作用后,MCF-7 细胞 Txr1 mRNA上调,TSP1 mRNA 下调,而 MDR1 mRNA 表达无明显改变(图 3)。
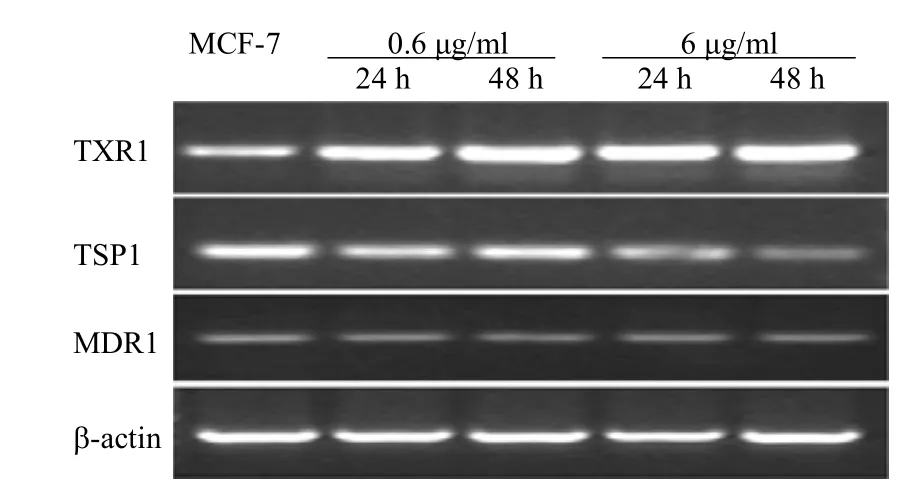
图 3 紫杉醇对 MCF-7 中 TXR1 mRNA 的表达水平的影响Figure 3 The effect of Taxol on the expression of TXR1 mRNA in MCF-7 cells
2.4 紫杉醇对 MCF-7 中 TXR1 的蛋白表达的影响
Western blot 检测结果 6 μg/ml、0.6 μg/ml 的紫杉醇作用于 MCF-7 细胞 24 h、48 h 后,TXR1的表达随药物浓度增加而增加,呈时间和剂量依赖性,见图 4。

图 4 紫杉醇对 MCF-7 中 TXR1 的蛋白表达水平的影响Figure 4 The effect of Taxol on the expression of TXR1 protein
3 讨论
紫杉醇(Taxol,Paclitaxel)是一种抑制微管解聚的药物,能促使微管蛋白迅速聚集成微管,并结合到微管上抑制微管的解聚,进而影响微管聚合与解聚的动态平衡,阻碍纺锤丝的形成,导致细胞阻滞于 G2M 期,从而使细胞有丝分裂终止[3]。本实验中,紫杉醇作用于乳腺癌细胞 MCF-7 后,细胞增殖抑制,G2M 期细胞比例明显增加,且作用具有明显的时间和剂量依赖性。然而,MCF-7 细胞用紫杉醇预处理后,紫杉醇对乳腺癌细胞 MCF-7细胞的生长抑制作用明显减弱,与对照组相比具有统计学差异,表明 MCF-7 细胞出现对紫杉醇的耐药性。
临床上紫杉醇对卵巢癌、乳腺癌、非小细胞肺癌、头颈部恶性肿瘤等有显著疗效,单独用药对乳腺癌有效率可达 56%[4]。肿瘤耐药是导致化疗失败的最主要原因,也是化疗亟需解决的问题。紫杉醇应用不久就发现有耐药性。既往研究发现,当干扰紫杉醇与微管结合的分子发生突变或多药转运蛋白 P2 糖蛋白表达上调时,将产生紫杉醇耐药[5]。细胞凋亡途径中一系列相关基因如 bcl-2、p53、erbB2 以及相关酶如 PKC、端粒酶等的活性改变,也可能与紫杉醇耐药有关[6]。目前还在对紫杉醇以及其他抗癌药耐药机制进一步深入研究[7]。
最近,Lih 等[8]发现紫杉醇耐药基因(Txr1)可下调血小板反应蛋白(thrombospondin-1,TSP1)的分泌,TSP1 具有促凋亡和抑制微血管形成作用,从而引起紫杉醇耐药。本实验中,我们发现:紫杉醇作用于乳腺癌细胞 MCF-7 后,Txr1 的 mRNA和蛋白表达均随时间延长而增加,而 TSP1 的mRNA 和蛋白表达水平随时间下降。这一研究结果与 Lih 等的发现一致,提示紫杉醇耐药基因的表达上调可能提高抑制 TSP1 诱导细胞的耐药性。有学者检测了术前未化疗的非小细胞肺癌患者的新鲜肿瘤组织中 Txr1 和 TSP1 的 mRNA 表达水平,发现肿瘤组织中具有高表达 TSP1 和低表达 Txr1的患者预后较好[9]。
由此我们分析,TSP1 可能是紫杉醇引起细胞凋亡作用的效应基因,Txr1 上调引起的 TSP1减低可能是紫杉醇诱导肿瘤细胞耐药的新机制,是对紫杉醇耐药机制的重要补充。但是 TSP1 与Txr1 间的具体作用机制还不清楚,进一步深入研究将有益于全面了解紫杉醇耐药的机制,从而进一步提高紫杉醇的治疗效果,改善乳腺癌患者的预后。
参考文献
[1] Marsh S, McLeod HL. Pharmacogenetics and oncology treatment for breast cancer. Expert Opin Pharmacother, 2007, 8(2):119-127.
[2] Moore A. Breast-cancer therapy--looking back to the future. New Engl J Med, 2007, 357(15):1547-1549.
[3] Horwitz SB. Mechanism of action of taxol. Trends Pharmacol Sci, 1992, 13(4):134-136.
[4] Sparano JA, Wang M, Martino S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med, 2008, 358(16): 1663-1671.
[5] Ferguson T, Wilcken N, Vagg R, et al. Taxanes for adjuvant treatment of early breast cancer. Cochrane Database Syst Rev, 2007(4): CD004421.
[6] Kutuk O, Letai A. Alteration of the mitochondrial apoptotic pathway is key to acquired paclitaxel resistance and can be reversed by ABT-737. Cancer Res, 2008, 68(19): 7985-7994.
[7] Hudis C, Dang C. The taxane limbo: how low can we go? J Natl Cancer Inst, 2008, 100(11):761-763.
[8] Lih CJ, Wei W, Cohen SN. Txr1: a transcriptional regulator of thrombospondin-1 that modulates cellular sensitivity to taxanes. Gene Dev, 2006, 20(15):2082-2095.
[9] Papadaki C, Mavroudis D, Trypaki M, et al. Tumoral expression of TXR1 and TSP1 predicts overall survival of patients with lung adenocarcinoma treated with first-line docetaxel-gemcitabine regimen. Clin Cancer Res, 2009, 15(11):3827-3833.
ObjectiveTo investigate the effect of Taxol resistance gene 1(Txr1) on Taxol-resistance in human breast cancer cell line in vitro.
MethodsHuman breast cancer cell line, MCF-7 was pre-treated with Taxol, and then cell proliferation and cell cycle of MCF-7 were respectively analyzed by MTT assay and flow cytometry in response to different concentration of Taxol. The expression of Txr1, TSP1 and MDR1 in mRNA and protein levels were detected by RT-PCR and western blot, respectively.
Results In response to Taxol, the inhibition of MCF-7 proliferation was reduced in Taxol pre-treated group as compared with the control group. The flow cytometry analysis indicated that MCF-7 cells were arrested at G2M phase. After Taxol pre-treatment, the expression of Txr1 mRNA are increase, expression of TSP1 mRNA was decrease, while expression of MDR1 mRNA was no significant change in MCF-7 as compared with the control. The similar changes of Txr1, TSP1 and MDR1 were also conformed in MCF-7 by western blot in protein level after Taxol pre-treatment.
ConclusionTaxol may induce taxol-resistance in cancer cells by inhibiting TSP1 expression via up-regulating of Txr1.
【Key words】Breast neoplasms; Taxol; Drug resistance, neoplasm; Thrombospondin 1
Author Affiliations:Department of General Surgery, Friendship Hospital, Capital University of Medical Sciences, Beijing 10050, China
Corresponding Author:ZHANG Zhong-tao, Email: zhangzht@yahoo.com.cn www.cmbp.net.cn Chin Med Biotechnol, 2010, 5(6):429-433
作者单位:100050 北京,首都医科大学附属北京友谊医院普通外科实验室
通讯作者:张忠涛,Email:zhangzht@yahoo.com.cn
收稿日期:2010-02-22
DOI:10.3969/cmba.j.issn.1673-713X.2010.06.006
Effect of Taxol resistance gene 1 on Taxol-resistance in human breast cancer cells
MA Xue-mei, BAI Zhi-gang, ZHANG Zhong-tao, QU Xiang, ZHAO Xiao-mu
【Abstract】
