应用AFLP技术鉴别不同地区的普洱茶晒青毛茶
2010-03-24季鹏章吕才有梁名志黄兴奇
季鹏章,吕才有,梁名志,张 俊,黄兴奇
(1.云南省农业科学院茶叶研究所,云南 昆明 650203;2.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650203;3.云南农业大学普洱茶学院,云南 昆明 650201)
应用AFLP技术鉴别不同地区的普洱茶晒青毛茶
季鹏章1,2,吕才有3,梁名志1,张 俊1,黄兴奇2
(1.云南省农业科学院茶叶研究所,云南 昆明 650203;2.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650203;3.云南农业大学普洱茶学院,云南 昆明 650201)
为鉴别不同地区的普洱茶晒青毛茶,对31个来自不同地区的普洱茶晒青毛茶进行AFLP-毛细管电泳技术分析,一共得到426个可重复的位点,多态位点百分率为94.6%,聚类分析主要分为台地茶类、老树茶类等两大类。结果表明,采用以下方法可鉴别不同来源的普洱茶晒青毛茶:从典型的主要特征峰和染色信号的最高值和次高值来区别;从峰形图的整个形状来区分;与对照的峰形图比较来区分。表明AFLP-毛细管电泳技术是一种高效的分子标记技术,能成功应用于不同区域普洱茶晒青毛茶的鉴别。
普洱茶;晒青毛茶;AFLP
普洱茶是以云南大叶种茶树的鲜叶经杀青、揉捻、日晒等工序制成的晒青毛茶为原料,再经发酵、蒸揉、成型制成各种形状的成品普洱茶[1]。晒青毛茶是普洱茶特异品质的物质基础。普洱茶有“青饼”和“熟普”之分,以晒青毛茶为原料,压制成“青饼”,目前市场流通中交易常称为“生普”(生茶),是普洱茶的历史原形;“熟普”(熟茶)是“生普”在后期经渥堆后发酵所形成的品质独特的一类茶叶[2]。普洱茶因其独特品质和保健功效,产业发展十分迅速。用著名古茶园所产鲜叶制作的老树茶晒青,品质优于用台地茶园所产鲜叶制作的台地茶晒青,价格居高不下;但古茶园晒青产量有限,导致了假冒著名老树茶的大量出现。与此同时,市场上出现了部分用中小叶种、大理茶等非云南大叶种鲜叶制作的假冒“普洱茶”晒青,严重影响了普洱茶的声誉。老树茶是指由百年以上的古茶园所产鲜叶加工而成的普洱茶,云南省现有古茶园4万hm2;台地茶是指采制于新中国成立后发展建立的密植条栽茶园,云南省现有该类茶园近20万hm2。
晒青毛茶的鉴定目前主要依据感官审评、内含化学成分分析等方法,然而,上述方法存在分析费用高、标准不一致等问题。多种分子标记技术已成功应用于茶叶、茶树的鉴别,如RAPD[3-4]、RFLP[5]、5S rRNA[6]、AFLP[7]。本实验在收集云南不同区域的31份普洱茶晒青毛茶的基础上,采用AFLP 毛细管电泳技术对其进行分析,旨在区分不同区域的老树茶、区分老树茶与台地茶,为普洱茶原产地保护提供参考,促进普洱茶的持续健康发展。
1 材料与方法
1.1 材料、试剂与仪器
材料:共收集晒青毛茶样本31个,包括普洱茶的主要原产地——云南省西双版纳州、普洱市、临沧市等地的晒青毛茶。临沧二嘎子茶经鉴定为大理茶种(Camellia taliensis大理茶)、佛香茶为中小叶种(C. sinensis var. sinensis茶),其余样本都是云南大叶种(C. sinensis var. assamica阿萨姆茶)所制晒青毛茶(表1)。

表1 普洱茶晒青毛茶来源Table 1 Sun-dried tea samples in this study
Taq酶、MgCl2、10×PCR buffer Fermentas MBI公司;EcoRI酶、MseI酶、T4连接酶试剂盒 日本Toyobo公司;琼脂糖 西班牙Pharmacia公司。
CEQ8000遗传分析系统 美国贝克曼库尔特公司;5415R离心机 德国 Eppendorf 公司;PTC-200型PCR仪 美国MJ公司。
1.2 DNA的提取和AFLP-PCR的扩增
采用改进的CTAB法[8],用于正式扩增的样品都用RNA酶A进行纯化。纯化后的DNA用紫外分光光度计测定260nm和280nm波长处的光密度值。用于PCR反应的总DNA浓度稀释到200ng/μL。扩增反应参照文献[9]。
1.3 AFLP-毛细管电泳
整个流程在遗传分析系统上完成,采用荧光标记技术和毛细管电泳分离技术,扩增产物在高分辨率毛细管中电泳分离,激光激发荧光采集数据,电泳结果通过软件自动统计分析并转化为“0、1”矩阵备用,同时导出电泳分离图谱。
1.4 数据处理和分析
输入得到的0、1矩阵,用NTSYSpc 2.0[10]对除M1~M8之外的M9~M19、P1~P5、L1~L7等23个样本进行UPGMA聚类分析。同时分析31个样本的电泳分离图谱。
2 结果与分析
2.1AFLP引物组合的扩增结果
两对选中的AFLP引物共扩增出可重复的426条带,检测出403个多态性(P=94.6%),平均每对引物扩增的总带数为213条,多态性条带201.5。引物E-AAC/ M-CTG的P=94.62%,引物E-AAC/M-CTA的P=94.58% (表2)。

表2 所用引物组合及其检测效率Table 2 Primers used in AFLP and their screening efficiency
2.2 聚类分析
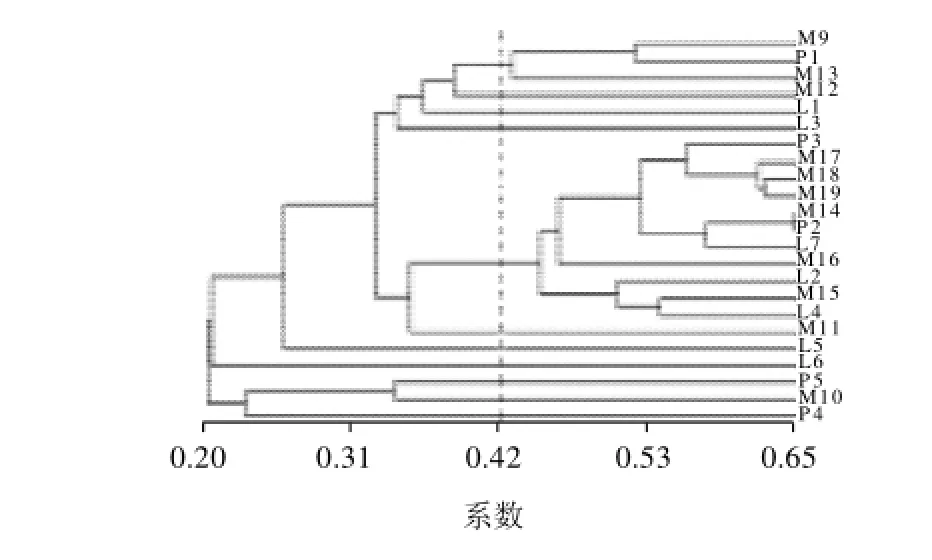
图1 23个晒青毛茶的UPGMA 聚类图Fig.1 UPGMA dendrogram based on Jaccard similarities of 23 tea samples
根据Jaccard相似性系数[11],对M9~M19、P1~P5、L1~L7等23个样品进行UPGAM 聚类(图1),相似性系数在0.33左右时,可分为2个大的类群,5个小类群。第一个大类群由勐宋大安(M9)、紫芽(M12)、布朗山(M13)、孟连(P1)、临沧1(L1)、蚂蚁堆(L3)等6个样品构成;第二个大类群由紫娟(M11)、曼迈(M14)、老茶树(M15)、格朗和(M16)、老班章(M17)、巴达(M18)、勐混(M19)、普洱1(P2)、普洱2(P3)、临沧2 (L2)、勐库(L4)、黑条子茶(L7)等12个样品构成;5个小类群分别是佛香(M10)、普洱饼(P4)、澜沧大山(P5)、白莺山(L5)和二嘎子茶(L6)。
2.3 AFLP-毛细管电泳图谱分析

表3 31个晒青毛茶引物E-AAC/M-CTG的毛细管电泳图谱主要峰值Table 3 Main peak values of 31 tea samples in AFLP fingerprint patterns using primer combination E-AAC/M-CTG

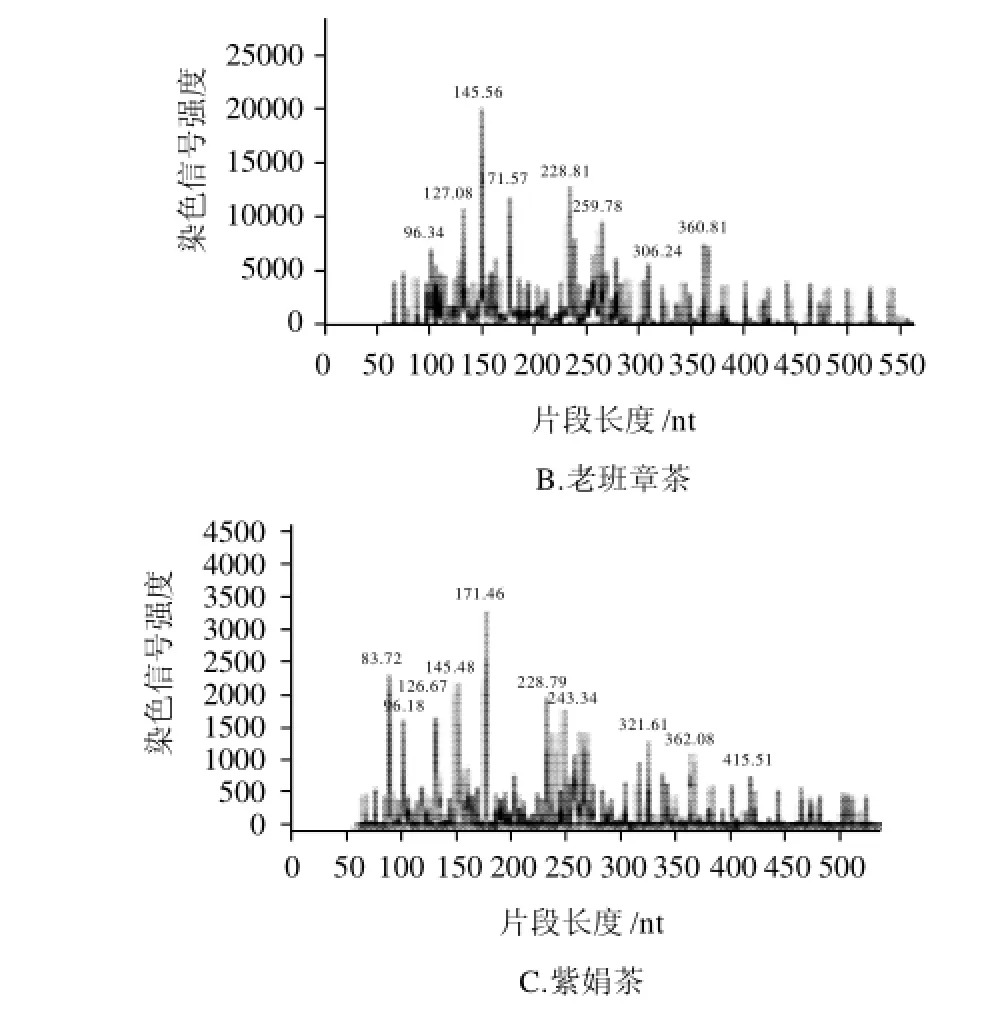

表4 31个晒青毛茶引物E-ACC/M-CTA的毛细管电泳图谱主要峰值Table 4 Main peak values of 31 tea samples in AFLP fingerprint patterns using primer combination E-ACC/M-CTA
两对31个AFLP-毛细管电泳图谱都有一定的差异,见图2和表3、4。引物E-AAC/M-CTG 则有明显的差异,如二嘎子茶96、215特征峰,佛香茶的234特征峰,紫娟的83、198、200特征峰,勐库茶的199、511特征峰,澜沧大山的210特征峰;引物E-AAC/M-CTA的如白莺山332特征峰等。此外,对于图形比较类似的样品,可以依据染色信号的最高值和次高值来进行比较,如勐海格朗和、老班章、巴达,引物E-AAC/MCTA 最高值都是337,但次高值分别为176、132、169。因而可成功地将三者区分出来。
3 讨 论
3.123 个晒青毛茶的聚类分析
从聚类图可以看出第一个大类群由勐宋、布朗山等6个样品构成,6个样品都为台地茶,分析第一大类群由台地茶构成。第二个大类群由老班章、勐混、巴达、曼迈、格朗和等12个样品构成。这12个样品中老班章、勐混、巴达、曼迈、格朗和、老茶树、勐库和黑条子茶等多数样本为老树茶,分析第二大类群主要由老树茶构成。此外,5个小类群中,佛香茶(C. sinensis var. sinensis)、临沧二嘎子茶(C. taliensis)与云南大叶种亲缘关系较远。而临沧白莺山则推测白莺山是茶树种质资源库,生长有大理茶等其他茶组植物,白莺山茶可能混杂有其他茶组植物的基因[12-13],因而与大叶种亲缘关系较远。
3.2 晒青毛茶AFLP-毛细管电泳鉴别技术分析
陈亮等[3]应用RAPD标记对原产于云南等地的24份野生茶树资源进行分子鉴定研究。结果表明,RAPD标记在鉴定茶树种质资源方面非常有效。有3种独立的方法可以用于茶树种质资源的分子鉴定:特殊的标记;特异的谱带类型;不同引物提供谱带类型的组合。16个特异标记的存在和3个特异标记的缺失可以鉴定14份资源;Singh等[4]用从市场上购来的10个不同品牌的红茶、绿茶,提取DNA,用RAPD鉴别,并认为该方法用来证明某著名品牌的茶叶的来源,有极大的应用性。Matsumoto等[5]用RFLP技术,以PAL基因为探针鉴别日本绿茶的遗传差异,集合2种限制性内切酶,2.3kb的探针能从阿萨姆种茶中鉴别出日本绿茶。Dhiman等[6]报道从5S rRNA基因片段设计了种间的特异PCR探针,并成功地检测到在茶叶样品中掺杂的腰果壳。从上述报道可看出,分子标记在茶树种质和产品鉴别是可行的。
本研究所用的AFLP-毛细管电泳技术,一对引物可扩增出200多个位点,位点差异在1bp都能检测到,更容易检测出材料的细微差异,同时采用高效自动化技术,降低了人为操作带来的误差,易于对扩增样本进行标准化分析,提高了数据的可靠性。通过对31个晒青毛茶的AFLP分析,31个晒青毛茶的AFLP毛细管电泳图谱都有差异,可以通过以下方法来区分不同地区的晒青毛茶、区分老树茶与台地茶:①从典型的主要特征峰和染色信号的最高值和次高值来区别,如勐库茶的199、511特征峰和澜沧大山的210特征峰;②从峰形图的整个形状来区分;③与对照的峰形图比较来区分。此外,该技术还可以用于鉴别非云南大叶种加工的晒青毛茶,如本实验中的佛香茶、二嘎子茶,二者与云南大叶种晒青的AFLP图谱有明显的区别。说明AFLP-毛细管电泳技术可用于普洱茶的真伪鉴别。
不同区域晒青毛茶的鉴别技术是非常复杂的,梁名志等[14]以云南省的古茶园和台地茶园的蒸青茶、晒青茶为样品,从感官审评、内含品质化学成分和矿物质元素检测分析得出:老树茶与台地茶确有差异,但很难用感官审评、内含品质化学成分和矿物质元素检测等方法来区分。云南普洱茶产地广泛,本次研究用AFLP-毛细管电泳虽取得一定进展,但并没有覆盖所有普洱茶典型产地。今后要对普洱茶典型产地继续开展AFLP-毛细管电泳分析,通过数据、图谱的积累,形成一整套完整的不同古茶山的AFLP-毛细管电泳数据库,应用于不同产地普洱茶晒青毛茶的鉴别。将更能发挥出AFLP-毛细管电泳技术的优势,为云南普洱茶产业的健康发展服务。
[1]田洋, 肖蓉, 徐昆龙, 等. 普洱茶加工过程中主要成分及相关性研究[J]. 食品科学, 2010, 31(11): 20-24.
[2]宁蓬勃, 郭抗抗, 王晶钰, 等. 云南普洱茶砷和汞的含量分析[J]. 食品科学, 2010, 31(8): 150-153.
[3]陈亮, 王平盛, 山口聪. 应用RAPD分子标记鉴定野生茶树种质资源研究[J]. 中国农业科学, 2002, 35(10): 1186-1191.
[4]SINGH M, BANDANA, AHUJA P S. Isolation and PCR amplification of genomic DNA from market samples of dry tea[J]. Plant Mol Biol Rep, 1999, 17: 171-178.
[5]MATSUMOTO S, KIRIWA Y, TAKEDA Y. Differentiation of Japanese green tea cultivars as revealed by RFLP analysis of phenylalanine ammonia-lyase DNA[J]. Theor Appl Genet, 2002, 104: 998-1002.
[6]DHIMAN B, SINGH M. Molecular detection of cashew husk (Anacardium occidentale) adulteration in market samples of dry tea (Camellia sinensis) [J]. Letter Planta Med, 2003, 69: 882-884.
[7]季鹏章, 黄兴奇, 王平盛, 等. 古茶园台地茶园遗传多样性的AFLP分析研究[J]. 遗传, 2009, 31(1): 101-108.
[8]DOYLE J. DNA protocols for plants-CTAB total DNA isolation[C]// HEWITT G M, JOHNSTON A. Molecular techniques in taxonomy. Berlin: Springer, 1991: 283-293.
[9]BALASARAVANAN T, PIUS P K, RAJ K R, et al. Genetic diversity among south Indian tea germplasm (Camellia sinensis, C. assamica and C. assamica spp. lasiocalyx) using AFLP markers[J]. Plant Sci, 2003, 165: 365-372.
[10]ROHLF F J. NTSYS-pc 2.0 numerical taxonomy and multivariate analysis system[CP]. New York: Exeter Software.
[11]JACCARD P. Nouvelles rescherches sur la distribution florale[J]. Bull Soc Vaud Sci Nat, 1908, 44: 223-270.
[12]唐一春, 王平盛, 许玫, 等. 云南云县白莺山古茶资源考察[J]. 中国茶叶, 2007(5): 12.
[13]陈文雄, 季鹏章, 黄兴奇, 等. 本山茶与勐库茶疑似杂交后代的RAPD鉴定[J]. 北方园艺, 2008(10): 153-155.
[14]梁名志, 夏丽飞, 张俊, 等. 老树茶与台地茶品质比较研究[J]. 云南农业大学学报, 2006, 21(4): 493-497.
AFLP Fingerprinting for Identifying Geographical Origins of 31 Sun-dried Tea (Maocha) Samples
JI Peng-zhang1,2,LCai-you3,LIANG Ming-zhi1,ZHANG Jun1,HUANG Xing-qi2
(1. Institute of Tea Research, Yunnan Academy of Agricultural Sciences, Kunming 650203, China;2. Institute of Biotechnology and Genetic Germplasm, Yunnan Academy of Agricultural Sciences, Kunming 650203, China;3. College of Pu , er Tea, Yunnan Agricultural University, Kunming 650201, China)
Amplified fragment length polymorphisms (AFLPs) markers were employed to identify the geographical origins of 31 sundried tea samples, which was a material for Pu , erh tea processing. A total of 420 polymorphic bands out of 426 reproducible products were amplified. Percentage of polymorphic loci (P) was 94.6%. Dendrogram generated after UPGMA clustering by NTSYS software indicated that 31 samples could be divided into conventional and ancient tea type. There were three methods to identify ancient tea and conventional tea, and to discriminate ancient tea from other geographical origins using AFLP marker: (1) based on the main peak value and the highest and second highest value of dye signal of tea samples. (2) based on the whole AFLP diagram of different samples. (3) cmpare target tea AFLP diagram with control tea group AFLP diagram. The result showed that AFLP marker was an effective tool and a robust method in discrimination of sun-dried tea (Maocha).
Pu , erh tea;sun-dried tea;amplified fragment length polymorphism (AFLP)
TS272.5
A
1002-6630(2010)24-0264-04
2010-08-19
“十一五”国家科技支撑计划项目(2007BAD58B06);云南省应用基础研究计划重点项目(2006C0012Z)
季鹏章(1975—),男,副研究员,博士,研究方向为茶树种质资源与遗传改良。E-mail:pengzhji@126.com
