低聚糖阿魏酸酯含量的快速测定方法
2010-03-23赵阳阳欧仕益林奇龄林海伟
赵阳阳,欧仕益,*,林奇龄,2,林海伟
(1.暨南大学食品科学与工程系,广东 广州 510632;2.华南理工大学轻工与食品学院,广东 广州 510641)
低聚糖阿魏酸酯含量的快速测定方法
赵阳阳1,欧仕益1,*,林奇龄1,2,林海伟1
(1.暨南大学食品科学与工程系,广东 广州 510632;2.华南理工大学轻工与食品学院,广东 广州 510641)
分别以麦麸、玉米芯、玉米麸皮为原料,采用酶法制备低聚糖阿魏酸酯,探讨其快速检测方法,并通过高效液相色谱法验证该法的准确性。结果表明,采用Amberlite树脂分离纯化可除去样品中的低聚糖(不含结合态的阿魏酸)、双波长分光光度法(345nm和375nm)结合还原糖法可用于对低聚糖阿魏酸酯进行准确定量。
低聚糖阿魏酸酯;阿魏酸;测定;双波长分光光度法;高效液相色谱法
阿魏酸(ferulic acid,FA),化学名称为3-甲氧基-4-羟基肉桂酸,是植物界普遍存在的一种酚酸。阿魏酸是公认的天然安全的自由基淬灭剂和抗氧化剂,对过氧化氢、羟自由基、超氧阴离子自由基、过氧化亚硝基都有强烈的清除作用[1-2]。Prasad等[3]研究表明,阿魏酸能有效降低紫外辐射对人体淋巴细胞的氧化程度。阿魏酸在植物中主要通过酯键与细胞壁多糖和木质素交联,或自身酯化或醚化形成双阿魏酸,从而构成细胞壁的一部分[4],其含量为0.4%~3.6%,因原料来源而异[5-8]。
低聚糖阿魏酸酯(feruloylated oligosaccharides,FOs)是指低聚糖中不同位置上的糖羟基与阿魏酸羧基酯化形成的一类化合物,可采用酶法或酸法水解麸皮、秸秆获得[9-12]。近年来,国内外在低聚糖阿魏酸酯的制备、功能研究领域有大量的报道。研究表明,低聚糖阿魏酸酯的抗氧化能力显著高于游离阿魏酸和VC[13-16],能增加体内抗氧化酶活性并具有良好的益生菌增殖活性[12,17-18]。但是,由于纤维质水解的随机性,水解后获得的产物低聚糖的聚合度存在不均一性,加上不同原料阿魏酸含量差异,造成不同来源的低聚糖阿魏酸酯结合的阿魏酸含量存在显著差别,给低聚糖阿魏酸酯的检测增加了难度,因此,建立快速、准确的低聚糖阿魏酸酯检测方法十分必要。
本研究首先对酶解产物进行分离纯化,获得纯度较高的低聚糖阿魏酸酯,探讨了双波长分光光度法测定低聚糖阿魏酸酯的方法,并与高效液相色谱法进行对比分析,以期为低聚糖阿魏酸酯含量提供快速便捷的定量检测方法。
1 材料与方法
1.1材料与试剂
小麦麸皮 南方面粉厂;玉米芯购自山东农村;玉米麸皮 石家庄市大地饲料有限公司。
戊聚糖酶、Viscozyme L酶液 诺维信公司;精制木瓜蛋白酶 远天酶制剂公司;耐高温α-淀粉酶 广州裕立宝生物科技有限公司;阿魏酸标准品 Sigma公司;甲醇、冰乙酸(均为色谱纯);其他试剂均为分析纯。
1.2 仪器与设备
HH-4恒温水浴锅 江苏金坛市宏体仪器厂;TGL-16G-A冷冻离心机 上海安汀科学仪器厂;SHA-BA恒温振荡器 江苏省金坛市神科仪器厂;UV-9600紫外-可见分光光度计 北京瑞利分析仪器公司;RE-52C旋转蒸发仪 上海亚荣生化仪器厂;LC-20AT高效液相色谱分析系统 日本岛津公司。
1.3 方法
1.3.1 原料预处理
按薛枫等[19]的方法进行原料预处理。将粉碎过筛(60目)的玉米麸皮、麦麸、玉米芯在105℃条件下干燥4h,用淀粉酶、木瓜蛋白酶去除其中的淀粉和蛋白质,过滤,残渣水洗、烘干,制得去淀粉去蛋白原料备用。
1.3.2 低聚糖阿魏酸酯的制备
按Yuan等[12]的方法进行。
将2g木聚糖酶粉和1g Viscozyme L酶液分别溶于pH4.5的盐酸溶液,定容至1000mL,获得0.3g/100mL混合酶液。分别称取10g预处理后的麦麸、玉米芯、玉米麸皮,用200mL的0.3g/100mL混合酶液于50℃恒温振荡器中酶解6h。酶解后,沸水中加热灭酶10min,离心(4000r/min,20min),经布滤并洗滤渣,合并滤液定容到200mL,获得粗低聚糖阿魏酸酯溶液。
1.3.3Amberlite树脂分离纯化阿魏酸酯及糖、酯含量测定
经预处理(醇泡、水洗至无醇味)的Amberlite树脂备用装柱(湿法上柱),分别取适量粗低聚糖阿魏酸酯溶液样品上样,解吸方法为先以纯水除去杂质,再以一定体积分数的乙醇溶液解吸,收集解吸液,测定其中的阿魏酸、糖含量。
Amberlite树脂分离纯化条件:上样量:30mL;玻璃层析柱:10mm×280mm;树脂量:10mL;流速:0.5mL/min;水洗量:60mL;解吸液(体积分数60%的乙醇溶液):50mL。
1.3.4 双波长分光光度法测定低聚糖阿魏酸酯的含量[11]
取适当稀释的低聚糖阿魏酸酯酶解液0.1mL,与0.9mL的0.1mol/L硼砂-甘氨酸缓冲溶液(pH10)混合,在345nm和375nm波长处测定混合溶液的吸光度。根据阿魏酸的摩尔吸光系数(M-1cm-1):=19662、=7630和低聚糖阿魏酸酯摩尔吸光系数(M-1cm-1):ε345=23064、ε375=31430计算低聚糖阿魏酸酯中阿魏酸的物质的量浓度。
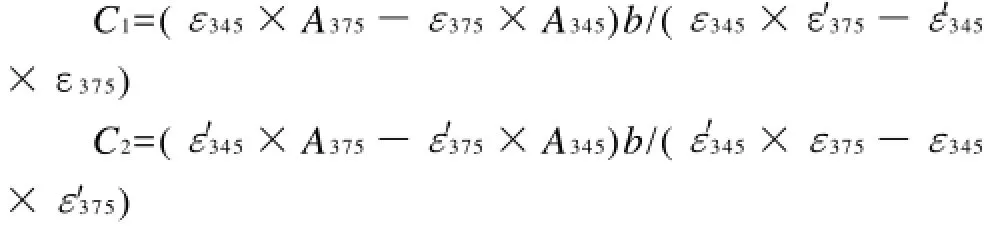
式中:C1为游离阿魏酸浓度/(mol/L); C2为低聚糖阿魏酸酯中的阿魏酸浓度/(mol/L);b为比色皿厚度/ cm;A345为波长345nm的OD值;A375为波长375nm的OD值。
1.3.5 糖含量测定
以105℃干燥至质量恒定的无水木糖为标准品制作标准曲线,得回归方程y=0.751x-0.0112,R2=0.9997。
还原糖含量的测定:采用3,5-二硝基水杨酸(DNS)法[20](以木糖计,g/L)。
可溶性总糖含量的测定:取10mL粗低聚糖阿魏酸酯溶液于100mL三角瓶中加入10mL 6mol/L HCl溶液及15mL蒸馏水,沸水浴加热水解30min,冷却后以6mol/ L NaOH溶液中和,移至100mL容量瓶中定容,稀释适当倍数[21]按DNS法测定。
平均聚合度(DP)=可溶性总糖含量/还原糖含量。各处理重复3次。
1.3.6HPLC法测定低聚糖阿魏酸酯的含量[22]
取粗低聚糖阿魏酸酯浓缩液(10mL)用NaOH溶液(10mL,2.0 mol/L )于35℃暗处碱解60min,取出冷却后,加HCl溶液(5mL,2.0mol/L)调至近中性。同时用HPLC法直接测定碱解液中游离阿魏酸含量。色谱分析条件:色谱柱:Eclipse XDB-C18(4.6mm×250mm,5μm);流动相:体积分数1%醋酸溶液-甲醇(72:28,V/V);检测波长:313nm;流速:1mL/min;柱温:40℃;进样量10μL;以保留时间定性,面积归一法计算相对含量。
阿魏酸标准品回归方程的制作:分别配制25、50、75、100、125μg/mL的阿魏酸标准品乙醇溶液,得峰面积y与质量浓度x的线性回归方程为y=45919x+27805,R2=0.9995。
2 结果与分析
2.1 双波长分光光度法测定粗低聚糖阿魏酸酯溶液中的阿魏酸含量
Amberlite树脂吸附低聚糖阿魏酸酯而不吸附低聚糖,从而实现低聚糖阿魏酸酯的分离纯化[12]。
本研究采用Amberlite树脂分离纯化粗低聚糖阿魏酸酯,并用双波长分光光度法测定低聚糖阿魏酸酯中的阿魏酸含量,结果如表1所示。由表1可以看出,采用
Amberlite树脂分离纯化后,纯化物中还原糖和总糖含量都显著降低,平均聚合度大大增加,说明Amberlite树脂可有效除去酶解液中的游离低聚糖和单糖。
为验证双波长分光光度法测定低聚糖阿魏酸酯中的阿魏酸含量(表2)的准确性,本研究先采用HPLC法测定低聚糖阿魏酸酯中的游离阿魏酸,而后将低聚糖阿魏酸酯碱解使结合态的阿魏酸游离出来,采用HPLC法测定总阿魏酸含量,结果如表3所示。

表1 麦麸、玉米芯和玉米麸皮酶解液采用Amberlite树脂分离前后的还原糖、总糖和平均聚合度的变化Table 1 Contents of reducing sugars and total soluble sugars and average degrees of polymerization of enzymatic hydrolysates from wheat bran, corn cob and corn bran before and after Amberlite resin separation

表2 麦麸、玉米芯和玉米麸皮酶解液中的阿魏酸含量和经Amberlite树脂吸附后的解吸液中阿魏酸含量Table 2 Determination of ferulic acid in enzymatic hydrolysates from wheat bran, corn cob and corn bran and their Amberlite resin purification products by DW spectrophotometry

表3 麦麸、玉米芯和玉米麸皮酶解液及经Amberlite树脂吸附后的解吸液碱处理前后HPLC测定的阿魏酸含量Table 3 Determination of ferulic acid in enzymatic hydrolysates from wheat bran, corn cob and corn bran and their pre- and post-alkalosis Amberlite resin purification products by HPLC method
比较表2、3可以看出,双波长分光光度法测定的游离阿魏酸含量与HPLC法差别较大,表明本法不适合测定游离阿魏酸含量;但用于测定麦麸、玉米芯、玉米麸皮样液中阿魏酸酯中结合态阿魏酸的含量时,其相对误差分别为6.72%、0.23%、9.69%,相对标准偏差(RSD)分别为4.92%、0.16%、7.2%,即与HPLC法基本一致,说明本法用于测定低聚糖阿魏酸酯中阿魏酸含量是可行的,即本实验建立的分析方法准确可靠。
与单独测定各待测液相比较,分别取上述待测液按表4等比例混合,按上述含量测定方法分别测定游离阿魏酸和粗低聚糖阿魏酸酯溶液中阿魏酸含量,其RSD分别为4.15%、5.25%、4.89%、6.95%和1.46%、3.55%、1.61%、4.74%,说明该法测定的重复性及稳定性较好。

表4 麦麸、玉米芯和玉米麸皮酶解液中的阿魏酸含量和经Amberlite树脂吸附后的混合解吸液中阿魏酸含量Table 4 Determination of ferulic acid in mixed enzymatic hydrolysates from wheat bran, corn cob and corn bran and mixtures of their Amberlite resin purification products by DW spectrophotometry
2.2HPLC直接检测低聚糖阿魏酸酯的含量
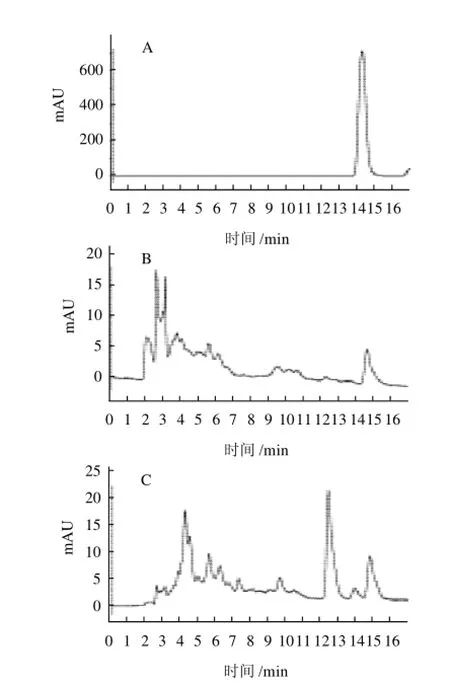

图1 阿魏酸标准样品(A)、麦麸和玉米芯低聚糖阿魏酸酯(B、C)及其碱解液(D、E)的HPLC图谱Fig.1 HPLC chromatogram of ferulic acid standard (A), feruloylated oligosaccharides prepared from wheat bran and corn cob (B and C) and their alkaline hydrolysates (D and E)
图1 比较了低聚糖阿魏酸酯及其碱解液的HPLC图谱。可以看出,由麦麸和玉米芯制备的粗低聚糖阿魏酸酯溶液在碱解前都出现了许多色谱峰,但碱解后麦麸只出现了阿魏酸的色谱峰,玉米芯分别只出现了阿魏酸和香豆酸的色谱峰。由于糖类没有紫外吸收,因此麦麸和玉米芯低聚糖阿魏酸酯的色谱峰都为低聚糖阿魏酸酯,说明酶解后制备出的低聚糖阿魏酸酯成分复杂,难以获得标准样品采用HPLC进行定量检测,故体现了该法检测的必要性。
3 结 论
本研究采用Amberlite树脂可纯化低聚糖阿魏酸酯,通过双波长分光光度法(345nm和375nm)可准确测定结合在低聚糖阿魏酸酯上的阿魏酸含量,实现对低聚糖阿魏酸酯的表征。结合在低聚糖阿魏酸酯上的阿魏酸含量,通过高效液相色谱法对双波长分光光度法进行准确度验证,其RSD分别为4.92%、0.16%、7.2%,说明具有较好的准确性;且通过对混合样品的检测,其RSD分别为1.46%、3.55%、1.61%、4.74%,说明具有较好的稳定性和重复性。
[1]胡铮瑢, 刘玉环, 阮榕生, 等. 阿魏酸、对香豆酸碱法制备及应用研究进展[J]. 食品科学, 2009, 30(21): 438-441.
[2]MUSSATTO S I, DRAGONE G, ROBERTO I C. Ferulic and pcoumaric acids extraction by alkaline hydrolysis of brewespent grain [J]. Industrial Crops and Products, 2007, 25: 231-237.
[3]PRASAD N R, RAMACHANDRAN S, PUGALENDI K V, et al. Ferulic acid inhibits UV-B-induced oxidative stress in human lymphocytes [J]. Nutrition Research, 2007, 27(9): 559-564.
[4]欧仕益, 张璟. 酶解麦麸产品抗氧化活性研究[J]. 食品与机械, 2005, 21(6): 17-19.
[5]XU Feng, SUN Runcang, SUN Jinxia, et al. Determination of cell wall ferulic and p-coumaric acids in sugarcane bagasse[J]. Analytica Chimica Acta, 2005, 552: 207-217.
[6]TORRE P, ALIAKBARIAN B, RIVAS B, et al. Release of ferulic acid from corn cobs by alkaline hydrolysis[J]. Biochem Eng J, 2008, 40(3): 500-506.
[7]FERREIRA P, DIEZ N, FAULDS C B, et al. Release of ferulic acid and feruloylated oligosaccharides from sugar beet pulp by Streptomyces tendae [J]. Bioresource Technology, 2007, 98(8): 1522-1528.
[8]BURANOV A U, MAZZA G. Extraction and purification of ferulic acid from flax shives, wheat and corn bran by alkaline hydrolysis and pressurised solvents[J]. Food Chemistry, 2009, 115(4): 1542-1548.
[9]YUAN X P, WANG J, YAO H Y. Production of feruloyl oligosaccharides from wheat bran insoluble dietary fibre by xylanases from Bacillus subtilis[J]. Food Chemistry, 2006, 95(3): 484-492.
[10]ISHII T. Structure and functions of feruloylated polysaccharides[J]. Plant Sci, 1997, 127: 111-127.
[11]SAULNIER L, VIGOUROUX J, THIBAULT J F. Isolation and partial characterization of feruloylated oligosaccharides from maize bran[J]. Carbohydr Res, 1995, 272: 241-253.
[12]YUAN X P, WANG J, YAO H Y. Antioxidant activity of feruloylated oligosaccharides from wheat bran[J]. Food Chemistry, 2005, 90: 759-764.
[13]OU S Y, KWOK K C. Ferulic acid: pharmaceutical functions, preparation and applications in foods[J]. J Sci Food Agric, 2004, 84(11): 1261-1270.
[14]张璟, 欧仕益, 张宁. 麦麸酶解产品清除自由基的体外实验研究[J].营养学报, 2005, 27: 25-29.
[15]MASUDA T, MIZUGUCHI S, TANAKA T, et al. Isolation and structure determination of new antioxidative ferulic acid glucoside esters from the rhizome of Alpinia speciosa, a Zingiberaceae plant used in Okinawan food culture[J]. J Agric Food Chem, 2000, 48(5): 1479-1484.
[16]焦霞, 陈静, 欧仕益. 麦麸酶解产物对糖尿病大鼠氧化应激损伤的保护作用[J]. 食品与机械, 2006, 22(2): 27-29.
[17]MOURE A, GULLON P, DOMINGUEZ H, et al. Advances in the manufacture, purification and applications of xylo-oligosaccharides as food additives and nutraceuticals[J]. Process Biochemistry, 2006, 41(9): 1913-1923.
[18]COURTOIS J. Oligosaccharides from land plants and algae: production and applications in therapeutics and biotechnology[J]. Current Opinion in Microbiology, 2009, 12(3): 261-273.
[19]薛枫, 欧仕益, 汪勇, 等. 双酶法降解玉米麸皮制备低聚糖和阿魏酸的研究[J]. 粮食与饲料工业, 2006(10): 17-19.
[20]王宪泽. 生物化学实验技术原理和方法[M]. 北京: 中国农业出版社, 2002.
[21]王远, 欧仕益. 利用麦麸制备低聚木糖的研究[J]. 湖南农业大学学报: 自然科学版, 2009, 35(4): 441-445.
[22]OU S Y, LUO Y L, HUANG C H, et al. Production of coumaric acid from sugarcane bagasse[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 253-259.
Rapid Determination of Feruloylated Oligosaccharides during Production
ZHAO Yang-yang1,OU Shi-yi1,*,LIN Qi-ling1,2,LIN Hai-wei1
(1. Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China;2. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China)
In this work, feruloylated oligosaccharides were prepared from each of three raw materials, namely, wheat bran, corn cob and corn bran, by enzymatic hydrolysis. A rapid method for determining feruloylated oligosaccharides was developed and verified by high performance liquid chromatography. Non-feruloylated oligosaccharides were removed by Amberlite resin chromatography, and the purified feruloylated oligosaccharide could be determined by using dual wavelength (DW) spectrophotometry (345 nm and 375 nm) coupled with the determination of reducing sugars after acidolysis.
feruloylated oligosaccharides;ferulic acid;determination;dual wavelength spectrophotometry;highperformance liquid chromatography
TS207.3
A
1002-6630(2010)18-0329-04
2010-06-07
广东高校科技成果产业化重大项目(cgzhzd0709)
赵阳阳(1987—),女,硕士研究生,研究方向为功能食品。E-mail:zhaoyangyangcg@126.com
*通信作者:欧仕益(1963—),男,教授,博士,研究方向为食品化学及功能食品。E-mail:tosy@jnu.edu.cn
