根霉产凝乳酶的固态发酵条件优化
2010-03-22韩玲玲潘道东
韩玲玲,潘道东,2,*
(1.南京师范大学 国家乳品加工技术研发分中心,江苏 南京 210097;2.宁波大学生命科学与生物工程学院,江苏 宁波 315211)
根霉产凝乳酶的固态发酵条件优化
韩玲玲1,潘道东1,2,*
(1.南京师范大学 国家乳品加工技术研发分中心,江苏 南京 210097;2.宁波大学生命科学与生物工程学院,江苏 宁波 315211)
对根霉产凝乳酶固体发酵条件进行研究。通过单因素分析和响应面试验设计,确定根霉产凝乳酶的发酵条件及发酵培养基的最佳组成为:24℃发酵7d;麸皮与江米质量比为0.96∶1、培养基固液比(m/V)为0.99∶1、奶粉添加质量分数为0.81%,所产的凝乳酶活力达到72.92SU/mL。
根霉;凝乳酶;响应面法
凝乳酶是干酪生产过程中一种重要的酶。传统的凝乳酶来源于小牛的皱胃,但随着干酪市场需求的日益增加,通过宰杀小牛来获得凝乳酶不能完全满足干酪的生产需要,因此很多研究者不断地寻找其替代品[1-2]。微生物凝乳酶从1965年起开始取代小牛皱胃酶,成功的弥补了小牛皱胃酶短缺的问题并在奶酪制造业与干酪产业中得到广泛的应用[3]。目前发现四十多种微生物可产凝乳酶,这些微生物主要是细菌、放线菌和真菌。常用的凝乳酶菌种有3种:米黑毛霉、微小毛霉和寄生内座壳菌(栗疫菌)。目前已有多种应用这3种菌生产的商品凝乳酶上市。现在应用最多的微生物凝乳酶是由微小毛霉生产的[4-5]。刘振民等发现酒药中主要菌系——根霉,具有一定的产凝乳酶的活力,可作为凝乳酶的潜在生产菌株[6]。
微生物发酵产酶一方面和菌种的性质有关,另一方面还同外界培养条件和培养方式有直接的关系。固态发酵技术以其发酵设备的简易性、相对便宜的成本构成,特别对于丝状真菌,固态发酵能够更好地模拟菌种的自然生长条件,对于特定的发酵产物更为有力[7]。
本实验采用根霉作为菌种利用固态发酵方式产凝乳酶,研究对产凝乳酶有影响的因素和发酵培养基的组成,以期找出其产酶的最佳固态发酵条件。
1 材料与方法
1.1 材料与试剂
根霉由南京师范大学生命科学学院南京微生物工程中心保存;脱脂奶粉 上海光明乳业股份有限公司;所用试剂均为分析纯。
1.2 培养基
斜面种子培养基[8-9]:称取200g去皮马铃薯,切碎后,水煮沸30min,纱布过滤,加入15~20g琼脂和20g葡萄糖,定容至1000mL,倒斜面,121℃灭菌
20min,制备孢子数为106个/mL的霉孢子悬浮液,备用;发酵基础培养基:10g麸皮加10g江米和20mL蒸馏水,pH值自然,121℃杀菌20min。
1.3 方法
1.3.1 酶液的制备提取
取40g基础培养基于250mL锥形瓶中,121℃杀菌20min。接种已调整孢子数为106个/mL的霉孢子悬浮液,28℃培养4d,然后加入80mL蒸馏水,置于8℃浸提15h,离心或者过滤(每组做3个平行实验取平均值),取上清液测酶活力。
1.3.2 凝乳酶活力测定[10]
取5mL的100g/L脱脂乳液于35℃保温5min,加入0.5mL酶液(也置于35℃保温),立即摇匀,准确记录从加入酶液到凝固的时间/s。40min凝固1mL 100g/L脱脂乳的酶量定义为一个索氏单位(Soxheh unit,SU)。

式中:t为凝乳时间/s;n为稀释倍数。
1.3.3 响应面分析法设计
根据文献报道和单因素试验,在基础培养基的基础上,选择其中对凝乳酶酵影响较大的因素(麸皮∶江米、培养基固液比、奶粉添加量),利用Design Expert 7.1.3软件进行试验设计和数据处理,研究影响较大的因素的主效应和交互效应对产凝乳酶量的影响,以获得最佳配比。每一自变量的低、中、高试验水平分别以-1、0、1进行编码,各试验组的编码与取值见表1。

表1 发酵培养基响应面试验设计因素水平编码Table 1 Factors and levels of experimental design for fermentation media
2 结果与分析
2.1 根霉产凝乳酶固态发酵条件的优化
2.1.1 基础培养基的确定
培养基总干物料为20g,分别调整麸皮和江米的比例,加入20mL蒸馏水,接种2mL种子液,24℃培养4 d,测定酶活力。
由图1可知,当麸皮和江米的质量比1∶1时,根霉产酶量最大,可能在该比例时,培养基中的各种营养素能基本满足根霉产酶的需求;当麸皮含量过大时,会造成菌丝大量迅速生长,易老化,从而产酶量减少,而江米含量过大时,可能由于合成凝乳酶的某种营养素含量较少而产酶不多。
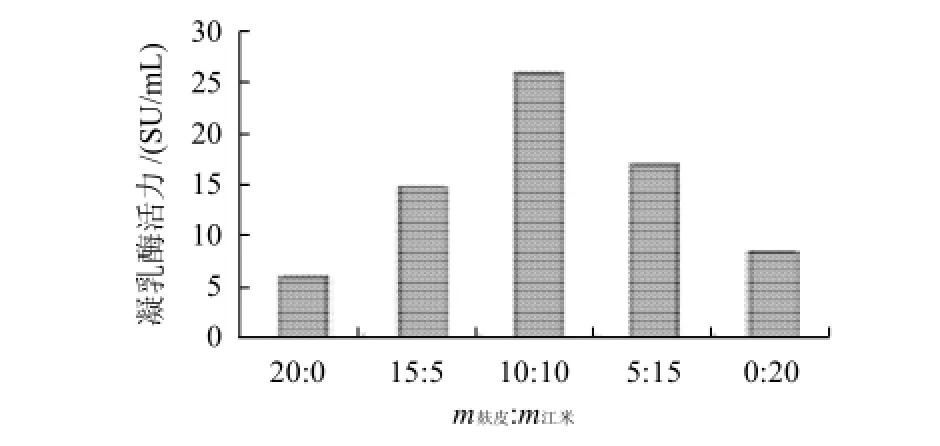
图1 基础培养基的确定Fig.1 Basic compositions of media
2.1.2 培养时间和温度对根霉产酶的影响
在基础培养基上接种2mL种子液,分别于20、24、28、32℃培养7d,每天定时测酶活力。

图2 培养时间和温度对根霉产酶的影响Fig.2 Effects of fermentation time and temperature on chymosin productivity
由图2可知,根霉在24℃发酵7d,酶活最大。从各温度、时间下根霉产酶的曲线可以看出,根霉在24℃条件下培养产酶最好。温度过高,根霉生长加快,易老化,产酶减少。温度过低则根霉生长过慢,产酶少。所以最佳的培养温度和时间是24℃培养7d。
2.1.3 培养基固液比对根霉产酶的影响
在20g固体基料(10g麸皮,10g江米)的基础上,分别调整固体基料和水分的比例,接种2mL种子液,24℃培养7 d,每天定时测酶活力。

图3 培养基固液比对根霉产酶的影响Fig.3 Effect of solid-liquid ratio on chymosin productivity
由图3可知,培养基中固体基料与水分的最适比例为 1∶1,此时凝乳酶的酶活达到最高。固体培养基的含水量对霉菌的生长和凝乳酶的产生有着重要的影响,加水量太少,无法满足根霉生长产酶所需水分;而加水量过多又不利于固体培养基的通气和散热。
2.1.4 接种量对根霉发酵产酶的影响
在基础培养基上分别接入不同体积的种子液,24℃培养7 d,每天定时测酶活力。
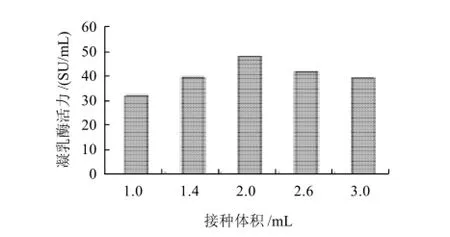
图4 接种量对根霉产酶的影响Fig.4 Effect of inoculum amount on chymosin productivity
由图4可知,当接种体积为2mL时,根霉产酶最多。可能是因为接种量过少,生长较慢,发酵周期长;而接种量过大时,又会导致菌丝生长过旺盛,进而造成固体培养基局部迅速升温以及加速菌体老化,影响产酶量。
2.2 发酵培养基固态发酵条件的优化
2.2.1 不同外加碳源对根霉产酶的影响
在基础培养基上分别加入质量分数为3%的淀粉、葡萄糖、果糖、麦芽糖、乳糖和蔗糖,接种2 m L种子液,24℃培养7d,每天定时测酶活力。
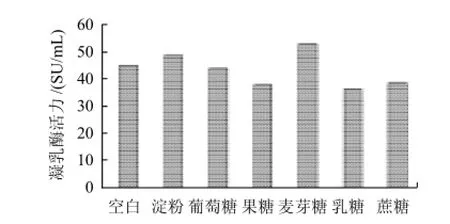
图5 不同外加碳源对根霉产酶的影响Fig.5 Effect of carbon source on chymosin productivity
由图5可知,麦芽糖和淀粉促进了根霉产凝乳酶,且麦芽糖是最佳的外加碳源,而葡萄糖、果糖、乳糖和蔗糖对酶的形成有抑制作用。
2.2.2 麦芽糖添加量对产酶的影响
在基础培养基上分别加入不同质量分数的麦芽糖,接种2mL种子液,24℃培养7d,每天定时测酶活力。
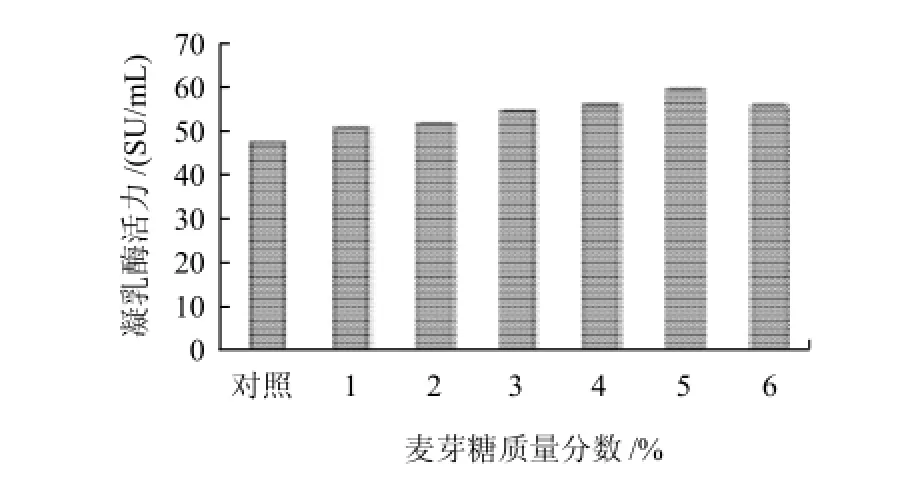
图6 麦芽糖添加量对产酶的影响Fig.6 Effect of maltose addition amount on chymosin productivity
如图6所示,在一定范围内,随着麦芽糖的添加质量分数增大,产酶量增多。当麦芽糖质量分数为5%时,凝乳酶活力最高。继续增加时反而减少。
2.2.3 不同外加氮源对根霉产酶的影响
在基础培养基上分别添加质量分数为1%的柠檬酸三铵、硫酸铵、磷酸二氢铵、胰蛋白胨、干酪素和奶粉,接种2mL种子液,24℃培养7d,每天定时测酶活力。
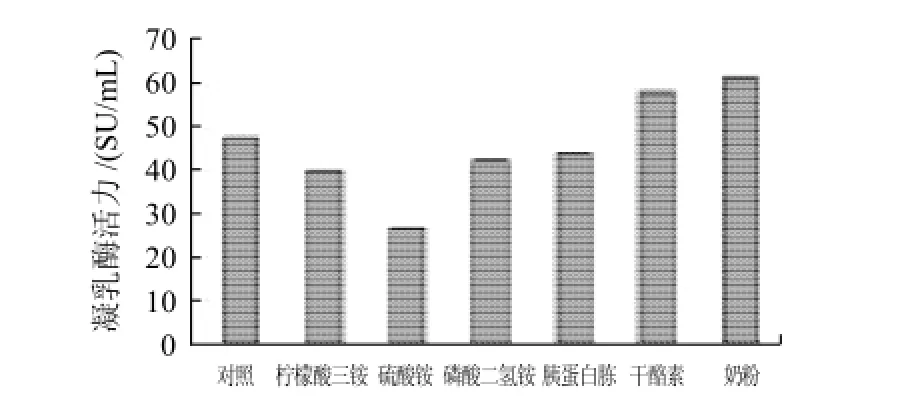
图7 不同氮源对产酶的影响Fig.7 Effect of nitrogen source on chymosin productivity
如图7所示,不同的氮源对根霉产酶影响不同。柠檬酸三铵、硫酸铵、磷酸二氢铵和胰蛋白胨抑制了根霉产凝乳酶的能力,而干酪素和奶粉对其起了促进作用,奶粉促进作用更强。
2.2.4 奶粉添加量对根霉产酶的影响
在基础培养上分别添加不同质量分数的奶粉,接种2mL种子液,24℃培养7d,每天定时测酶活力。

图8 奶粉添加量对根霉产酶的影响Fig.8 Effect of milk powder amount on chymosin productivity
如图8所示,当奶粉质量分数为1%时,产酶量最大。这可能是因为此时的氮源即能满足菌丝的生长,又能提供蛋白质合成时所需的氮源。而当其质量分数增高时,C/N减小,菌体生长过于旺盛,营养物质过多的用于菌体的生长,导致产酶量的下降。
2.3 响应面优化发酵条件

表2 响应面试验结果Table 2 Data of response surface experiments
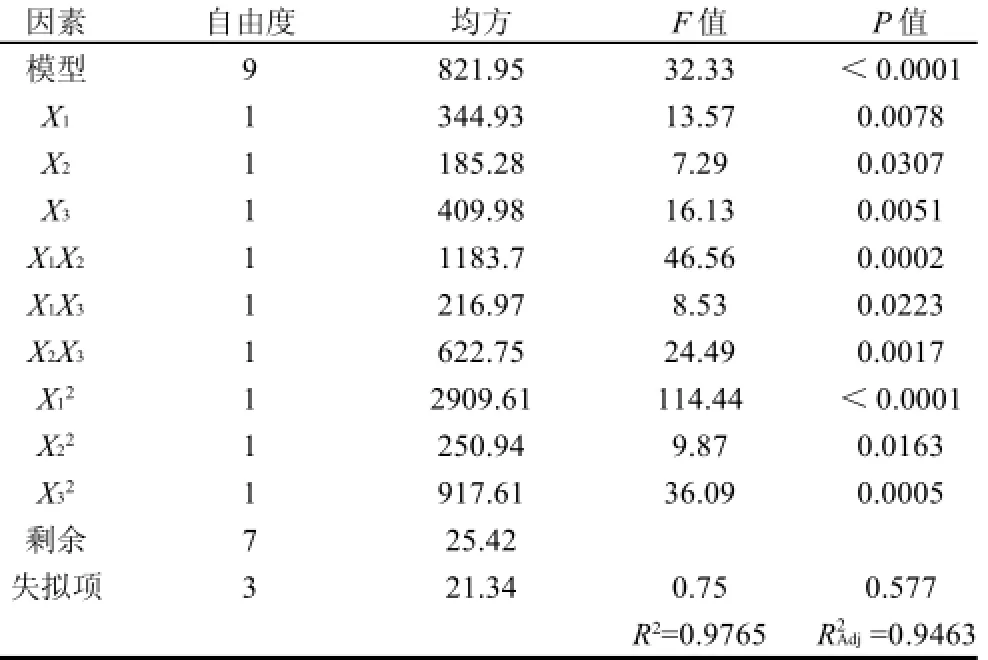
表3 响应面试验结果回归方差分析Table 3 Variance analysis of regression
响应面分析试验根据Box-Behnken设计进行了17组试验,其中5组中心点重复试验,结果见表2。利用Design Expert 7.1.3软件对表2试验数据进行多元回归拟合,得到回归方程如下:
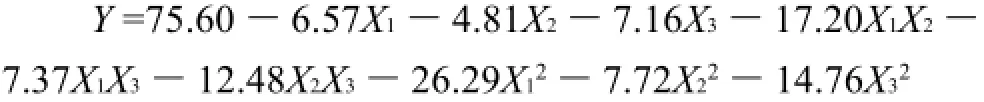
表3方差分析表明,本实验所选用的二次多项模型具有高度的显著性(P<0.0001)。其决定系数为0.9765,校正决定系数为0.9463,且失拟性检验不显著(P=0.577>0.05),说明所拟合的回归方程合适,对试验拟合情况较好。
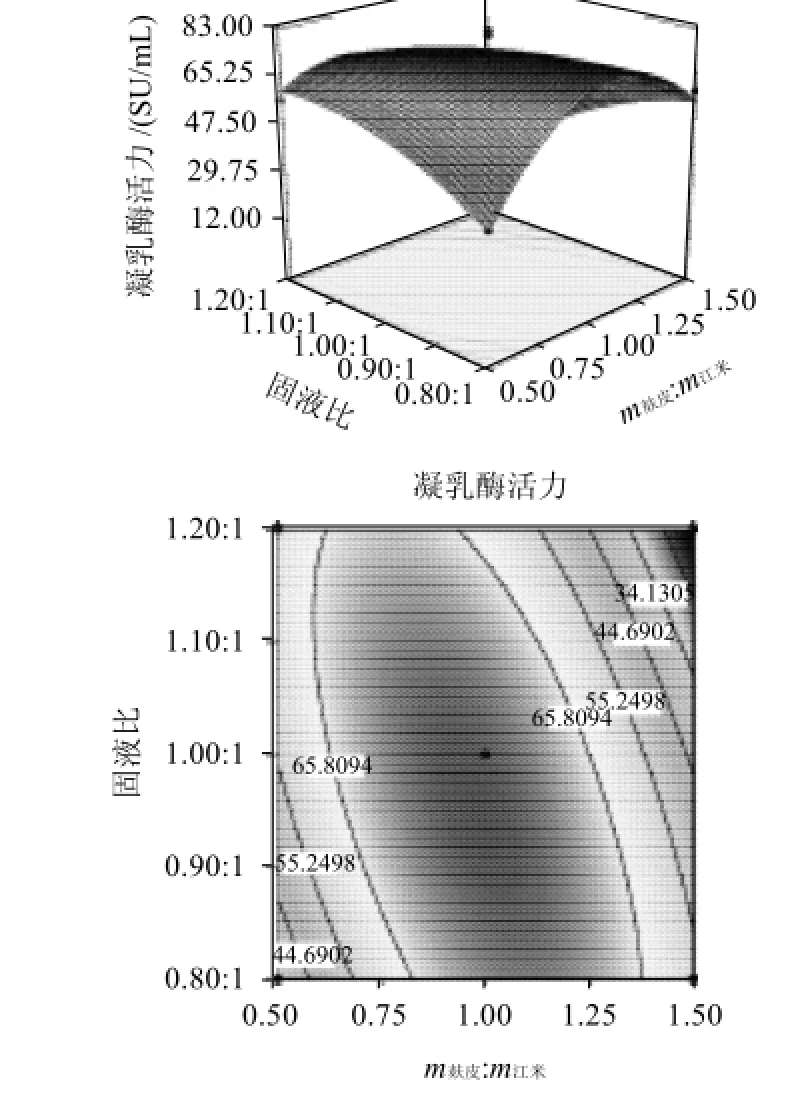
图9 培养基固液比与麸皮和江米质量比的响应面及等高线图Fig.9 Response surface chart and contour line ofY=f(X1,X2)

图10 奶粉质量分数与麸皮和江米质量比的响应面及等高线图Fig.10 Response surface chart and contour line ofY=f(X1,X3)

图11 培养基固液比与奶粉质量分数的响应面及等高线Fig.11 The response surface chart and contour line ofY=f(X2, X3)
从表3和图9~11可以看出,各个因素在所选择的范围内对凝乳酶的产生都有显著的影响(P<0.05)。从响应面分析的立体图和等高线图可看出,各因素之间存在一定的交互作用。根据Box-Behnken试验所得的结果和二次多项回归方程,利用Design Expert7.1.3软件获得了m麸皮∶m江米(X1)、培养基固液比(X2)、奶粉添加质量分数(X3)的最佳组合分别为:0.96∶1、0.99∶1、0.81%,其对应的响应值(Y)为76.71SU/mL。为进一步确定计算结果,按最佳条件做验证实验,凝乳酶活力为72.92SU/mL。进一步证实了分析的可靠性。
3 结 论
通过对根霉产凝乳酶固态发酵条件的研究,确定最佳培养温度和时间为24℃发酵7d;最佳接种量为2mL孢子数为106个/mL的霉孢子悬浮液;通过单因素分析和响应面试验设计确定最佳培养基组成为:m麸皮∶m江米为0.96∶1、固液比为0.99∶1、奶粉添加质量分数为0.81%,所产的凝乳酶活力为72.92SU/mL。
[1]HASHEM A M. Optimization of milk-clotting enzyme productivity by Penicillium oxalicum[J]. Bioresource Technology, 1999, 70(2)∶ 203-207.
[2]曾剑超. 国内凝乳酶及其代替品的研发进展[J]. 中国牛业科学, 2008, 34(2)∶ 48-50.
[3]张红梅, 刘钟滨. 凝乳酶的研究进展[J]. 同济大学学报∶ 医学版, 2004, 25(3)∶ 254-257.
[4]姜成林. 放线菌产生各种有用物质的初步探索[J]. 微生物学通报, 1988, 15(1)∶ 16-19.
[5]郭光远, 姜成林, 马俊. 微生物凝乳酶的研究Ⅰ∶ 菌株的筛选、发酵、制备及毒性[J]. 微生物学通报, 1988,15(5)∶ 207-210.
[6]刘振民. 酒药中凝乳酶菌株筛选及产酶条件研究[J]. 食品与发酵工业, 2002, 27(5)∶ 8-11.
[7]滕国新. 酒曲中根酶凝乳酶性质及对扣碗酪凝乳质地影响的研究[D].北京∶ 中国农业大学, 2005.
[8]沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京∶ 高等教育出版社, 1989∶ 267-304.
[9]李顺鹏. 微生物学实验指导[M]. 北京∶ 中国农业出版社, 2003∶ 74-76.
[10]骆承庠. 酒药中凝乳酶特性及产酶条件的研究[J]. 食品科学, 2000, 21(2)∶ 3-6.
Optimization of Solid-state Fermentation Condition for Chymosin Production by Rhizopus
HAN Ling-ling1, PAN Dao-dong1,2,*
(1. Branch Center of National Dairy Products Processing Technology Development, Nanjing Normal University, Nanjing 210097, China;2. College of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China)
In this study, the solid-state fermentation conditions for producing chymosin with Rhizopus were optimized through single factor experiments and response surface methodology. The optimal fermentation conditions were media with solid-liquid ratio of 0.99∶1 (m/V), bran-rice ratio of 0.96∶1 (m/m), milk powder addition amount of 0.81% (m/m) and fermentation at 24 ℃for 7 days. The activity of chymosin produced at this optimal condition reached up to 72.92 SU/mL.
Rhizopus;chymosin;response surface methodology
TQ925
A
1002-6630(2010)09-0156-05
2009-07-12
国家自然科学基金项目(30972130);“十一五”国家科技支撑计划项目(2006BAD04A12);国家“863”计划项目(2007AA10Z357)
韩玲玲(1983—),女,硕士研究生,研究方向为乳品科学。E-mail:linghan2007@126.com
*通信作者:潘道东(1964—),男,教授,博士,研究方向为乳品科学。E-mail:daodongpan@163.com
