苏丹红Ⅲ对肌红蛋白的荧光猝灭及分子模拟研究
2010-03-21朱少萍蔡炳锋
朱少萍,蔡炳锋,毛 慧,赵 波,*
苏丹红Ⅲ对肌红蛋白的荧光猝灭及分子模拟研究
朱少萍1,蔡炳锋2,毛 慧2,赵 波2,*
(1.常州工学院理学院,江苏 常州 213002;2.江苏省生物功能材料重点实验室,南京师范大学化学与材料科学学院,江苏 南京 210097)
利用荧光光谱结合分子柔性对接模拟技术研究在模拟生理条件下苏丹红Ⅲ(Sudan Red Ⅲ)与肌红蛋白(myoglobin,Mb)的作用机理。结果表明:苏丹红Ⅲ对Mb的荧光猝灭作用是由于二者之间形成复合物而导致的静态猝灭,苏丹红Ⅲ与肌红蛋白的表观结合常数KA为7.13×103L/mol,结合位点数约为1;苏丹红Ⅲ与Mb分子的第一个活性口袋周围的氨基酸残基通过疏水作用、亲水作用和氢键作用结合。苏丹红Ⅲ与Mb分子中的Trp、Tyr、Phe等氨基酸残基之间的疏水相互作用,主要是与Phe33、Phe43 和 Phe138等之间的作用,导致了Mb的内源荧光的静态猝灭和最大发射峰的无序位移。
苏丹红Ⅲ;肌红蛋白;相互作用;荧光猝灭;分子模拟
苏丹红是人工合成的偶氮类工业染料,包括苏丹红Ⅰ以及其衍生物苏丹红Ⅱ、Ⅲ、Ⅳ。其中苏丹红Ⅲ(Sudan Red Ⅲ)化学名称为1-[4-(苯基偶氮)苯基]偶氮-2-萘酚,结构如图1所示。由于苏丹红颜色鲜艳、价格低廉,常被一些非法企业用作食品染料。全球多数国家禁用苏丹红染料为食品添加剂[1-4]。早在1996年,我国《食品添加剂使用卫生标准》中就明令禁止使用苏丹红为食品色素。

图1 苏丹红Ⅲ的分子结构Fig.1 Molecular structure of Sudan redⅢ
IARC将苏丹红Ⅲ列为三类致癌物,其初级代谢产物4-氨基偶氮苯被列为二类致癌物[1],此外,苏丹红能造成人体组织缺氧,引起中枢神经系统、心血管系统受损,甚至导致不孕[2-4],因此控制并检测食品中的苏丹红有非常重要的意义。
苏丹红Ⅲ对动物的致突变性和致癌性与其代谢产物苯胺、萘酚的关系已经得到广泛研究[5-6], 而苏丹红Ⅲ与生物大分子的相互作用研究较少,采用分子模拟与光谱学实验相结合的手段来研究其与动物体内蛋白质如肌红蛋白的的作用机理尚未见文献报道。
肌红蛋白(myoglobin,Mb)是哺乳动物细胞,尤其是肌细胞贮存和分配氧的蛋白质。肌红蛋白由一条多肽链和一个血红素辅基构成,含153个氨基酸残基,由于其结构简单且具有血红素类蛋白的生物活性,而成为研究蛋白质与其他分子相互作用的一种重要的模型蛋白[7]。
本实验基于荧光猝灭的光谱学检测手段,结合分子柔性对接模拟技术研究苏丹红Ⅲ与蛋白质的相互作用的分子机理,这对于揭示苏丹红类化合物的毒性-结构关系,实现基于分子结构的毒性预测,得出有类似毒化作用的化合物结构有极其重要的作用。
1 材料与方法
1.1 材料、试剂与仪器
苏丹红Ⅲ(Sudan Red Ⅲ,苏丹红Ⅲ储备液是将0.0018g苏丹红Ⅲ溶解于无水甲醇中配制,浓度为1.0× 10-4mol/L) 国药集团化学试剂有限公司;无水甲醇 美国天地公司;马心肌红蛋白(Mb,用pH为7.4的Tris(三羟甲基甲烷)-HCl缓冲溶液,配制成1.0×10-5mol/L的储备液,由于荧光实验是模拟人体条件下的反应,Tris-HCl 缓冲溶液中含有0.1mol/L NaCl 以维持离子强度,置于冰箱中保存) 美国Sigma公司;其他试剂均为分析纯;实验中用水均为二次去离子水。
Cary Eclipse型荧光光谱仪 美国Varian公司。
1.2 荧光光谱的测定
移取2mL Mb储备液于1cm 的石英比色皿中,用微量注射器逐次加入不同量的苏丹红Ⅲ溶液,每次加入后混合均匀,使得苏丹红Ⅲ与Mb的浓度比分别是0、0.05、0.1、0.2、0.3、0.4,静置反应完全后,在最大激发波长230nm进行荧光扫描,记录280~780nm 波长范围内的荧光光谱。
1.3 分子模拟
结合农林院校的特点发挥农林类院校的专业优势,使学生在“生态文明”的建设中能掌握生态建设的相关理论与实践方法,有针对性和差异性的培养学生的涉农、涉林类基础知识,使学生在个人目标的实现中,突出自身专业优势和知识结构的差异,形成学生多元的文化基础。
分子力学与分子动力学模拟采用美国Accelrys公司Discovery Studio 2.0(DS 2.0)软件包完成,苏丹红 Ⅲ 分子的初始结构由软件包生成,Mb的晶体结构数据来自Brookhaven 蛋白质数据库(Protein Data Bank Code: 1ymb)[8],依据软件程序将Mb中存在的空腔定义为活性口袋,取Mb活性口袋周围的氨基酸残基作为对接的受体,用Flexible Docking工具在CHARMm力场的作用下,将苏丹红Ⅲ分子作为配体柔性对接到受体Mb中,通过比较对接结果的Libdock Score来获得最优的苏丹红Ⅲ的稳定构象并进行分子模拟。
2 结果与分析
2.1 荧光光谱

图2 苏丹红Ⅲ和Mb混合溶液的荧光发射光谱Fig.2 Fluorescence spectrum of Sudan red Ⅲand Mb at different concentration ratios
由图2可知,随着苏丹红Ⅲ浓度的增加,Mb在332nm波长处的最大发射峰的形状没有变化,而发射峰的强度逐渐降低,表明苏丹红Ⅲ使Mb的荧光发生了有规律的猝灭。Mb的内源荧光主要来源于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基。图2显示荧光最大发射峰的位置发生了无序位移,这可能是由于Mb在与不同浓度的苏丹红Ⅲ结合的过程中,对上述几种荧光生色团所处的微环境的影响不同,总的宏观表现是无序的,其光谱性质则表现为荧光最大发射峰的无序位移。
2.2 荧光猝灭机理
荧光物质分子与溶剂分子或其他溶质分子之间发生的,导致荧光强度下降的作用称为荧光猝灭。对于动态猝灭和静态猝灭,Stem-Volmer方程为[9-11]:

式中:F0和F分别是未加和加入猝灭剂时的荧光强度;Q为猝灭剂;KS和 KD分别为动态猝灭常数和静态猝灭常数,忽略式(1)右边的二次项,则方程变为:

式(2)表明猝灭剂与F0/F之间存在线性关系,式中:KQ=(KS+ KD),τ0是未加入猝灭剂时荧光分子的平均寿命,生物大分子的τ0约为10-8s[12-14],Kq为荧光猝灭速率常数。由式(2)可知:

根据图2和式(2),做出相应的Stern-Volmer图(图3)。
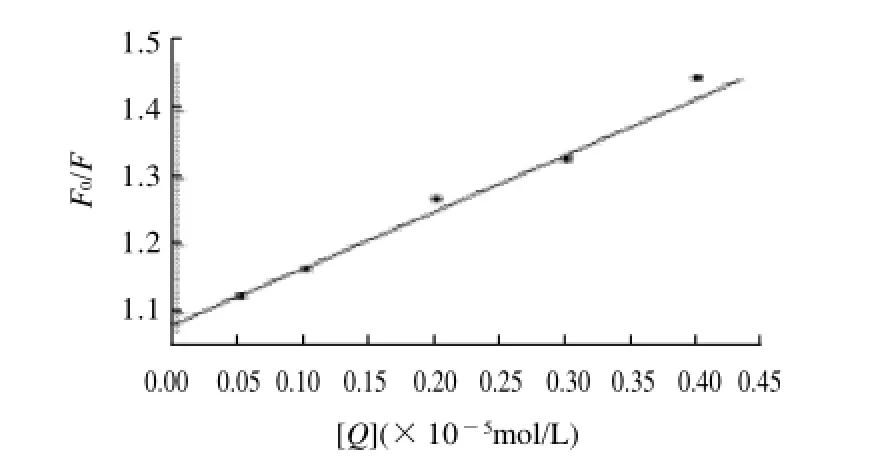
图3 苏丹红Ⅲ与Mb相互作用的Stern-Volmer曲线Fig.3 Stern-Volmer plot for the interaction of Sudan red III and Mb
2.3 苏丹红Ⅲ和Mb结合位点数及表观结合常数
对于因猝灭剂与荧光分子之间的结合引起的静态荧光猝灭,荧光物质与猝灭剂之间的关系可由式(4)[16]推导出来:

根据图2和式(4)得到图4,由直线的斜率和截距可以计算出苏丹红Ⅲ和Mb的表观结合常数KA为7.13× 103L/mol,两者之间具有较强的相互作用;结合位点数n为0.773,说明苏丹红Ⅲ与Mb相互作用时近似形成1:1的复合物。
2.4 分子模拟

图4 lg[(F0-F)/F]与lg[Q]的线性拟合曲线Fig.4 Fitting plot of lg[(F0-F)/F] vs. lg[Q]
为了进一步从理论上确定苏丹红Ⅲ与Mb键合的机理和模式,采用分子动力学柔性对接的方法模拟两者在真空状态下相互作用的具体结合情况。依据DS2.0软件包的分析,Mb分子中存在3个活性口袋。将苏丹红Ⅲ定义为配体,充分考虑了Mb活性口袋周围氨基酸残基的柔性,采用Flexible Docking 模块与之对接,再采用分子动力学模拟研究对接后的相互作用信息。为模拟人体条件,分子动力学模拟过程中的Solvation计算也增加了补偿离子Na+和Cl-。配体苏丹红Ⅲ经柔性对接共获得9种不同构象,以程序中自带的打分函数所得Libdock Score最高的构象作为最优的苏丹红Ⅲ对接构象[17-18],并以此进一步进行分子动力学模拟。苏丹红Ⅲ-Mb复合物的最稳定构型如图5所示。

图5 苏丹红Ⅲ与Mb的相互作用图Fig.5 Molecular interaction between Sudan red Ⅲ and Mb
由图5可知,苏丹红Ⅲ与Mb的第一个活性口袋周围的氨基酸残基存在氢键、疏水、亲水等作用。图5A以线状模式表示Mb分子的第一个活性口袋周围的疏水氨基酸残基,苏丹红Ⅲ分子中的苯环和萘环与T r p、Tyr、Phe等氨基酸残基之间存在疏水相互作用,其中Phe33、Phe43 和 Phe138与苏丹红Ⅲ分子中的萘环较接近,产生了对接,这就很好地解释了Mb内源荧光静态猝灭且无序位移的实验结果,揭示了Mb荧光猝灭的分子机理。图5A以球棒模式表示的是亲水氨基酸残基,共有3个:His64、His93、His97。苏丹红Ⅲ分子中萘环上的邻羟基容易与Mb中亲水氨基酸组氨酸(His93)上的五元含氮杂环中的N(E2)之间形成亲水作用。此外,苏丹红Ⅲ还与极性氨基酸残基Lys42形成氢键作用,该氢键的键长为2.85A°,键角为159.7°。亲水作用和氢键的形成也加快了电子转移的速率,稳定了苏丹红Ⅲ分子在活性口袋中的位置[19]。
运用Calculate Interaction Energy工具来计算对接之后苏丹红Ⅲ-Mb之间的结合能。结果显示苏丹红Ⅲ和Mb相互作用的势能是-1.702×103kJ/mol,进一步说明苏丹红Ⅲ与Mb之间存在很强的相互作用。
3 结 论
实验结果表明苏丹红Ⅲ是较强的猝灭剂,对Mb的内源荧光的猝灭是由于二者之间形成了基态复合物。分子模拟揭示了它们相互作用的分子机理。苏丹红Ⅲ在Mb上的结合部位是Site 1活性口袋,苏丹红Ⅲ与其周围的氨基酸残基发生了疏水作用、亲水作用和氢键作用。苏丹红Ⅲ与Mb分子中的Trp、Tyr、Phe等氨基
酸残基之间存在疏水相互作用,主要是与Phe33、Phe43和Phe138等之间的作用,导致了Mb的内源荧光的静态猝灭和最大发射峰的无序位移。
苏丹红Ⅲ致畸、致癌、致突变的毒理可能是由于其与生物体蛋白中的某些具体氨基酸残基发生强烈的作用,致使蛋白质失去原有的活性或发生突变。本实验采用荧光光谱法结合分子模拟技术研究了模拟生理条件下人工合成工业染料苏丹红Ⅲ与肌红蛋白相互作用的分子机理,确定了其作用位点,揭示了分子水平上它们的精细作用信息,包括苏丹红Ⅲ的关键基团和蛋白分子的有重要作用的氨基酸残基。分子模拟技术能提供分子层次的作用情况,弥补实验手段的不足,对于揭示分子作用机理是一种十分有效的研究手段。这些研究对于揭示食品中的非法染料类添加剂在动物体内的代谢动力学、毒性、毒性与分子结构的关系,并实现基于分子结构的毒性预测,得出有类似毒化作用的化合物结构都有着极其重要的作用。
[1]王伟红, 闰香君, 童殿军. 苏丹红的理化性质与人体毒性[J]. 实用预防医学, 2006, 13(6): 1681-1682.
[2]潘志明, 李忠, 王冰, 等. 食品中苏丹红检测研究进展[J]. 世界科技研究与发展, 2007, 29(6): 14 - 18.
[3]李吉平, 高宏伟, 刘文森, 等. 辣椒制品中苏丹红Ⅰ~Ⅳ号检测方法比较研究[J]. 食品研究与开发, 2008, 29(2): 109-111.
[4]郑红, 韩鸿萍, 李晶, 等. 苏丹红Ⅲ分子印迹聚合物的合成与性能研究[J]. 青海大学学报:自然科学版, 2006, 124(13): 61-64.
[5]宋燕, 李宁. 食品中苏丹红的危险性评估[J]. 国外医学: 卫生学分册, 2005, 32(3): 129-132.
[6]孙文辉, 高洪, 刘海峰. 苏丹红与食品安全[J]. 动物医学进展, 2008, 29(4): 103-105.
[7]马静, 郑学仿, 唐乾, 等. 光谱法研究Cu2+与肌红蛋白的相互作用[J]. 高等学校化学学报, 2008, 29(2): 258-263.
[8]WHEELER K E , NOCEK J M, CULL D A, et al. Dynamic docking of cytochrome b5 with myoglobin and alpha-hemoglobin: heme-neutralization squares and the binding of electron-transfer-reactive configurations[J]. J Am Chem Soc, 2007, 129: 3906-3917.
[9]MICHAEL J, PIANA K, ZAHIR O. Investigation of metal ions binding of humic substances using fluorescence emission and synchronous-scan spectroscopy[J]. J Environ Sci Health B, 2000, 35: 87-102.
[10]CHONG Qiujiang, MING Xiagao, XIAN Zhemeng. Study of the interaction between daunorubicin and human serum albumin, and the determinayion of daunorubicin in blood serum samples[J]. Spectrochimica Acta Part A, 2003, 59: 1605-1610
[11]郭艳丽, 阎宏涛, 裴若会. 不同粒径金纳米微粒对荧光素钠的猝灭效应研究[J]. 光谱学与光谱分析, 2008, 28(2): 380-383.
[12]LAKOWICZ J R, WEBER G. Quenching of protein fluorescence by oxygen detection of structural fluctuations in proteins on the nanosecond time scale[J]. Biochemistry, 1973, 12(21): 4171-4179.
[13]张红梅, 王彦卿, 张根成, 等. 分子光谱法研究铝酞菁与牛血红蛋白的相互作用[J]. 分析试验室, 2007, 26(3): 119-122.
[14]DU Hong, XIANG Junfeng, ZHANG Yazhou, et al. A spectroscopic and molecular modeling study of sinomenine hydrochloride binding to transferring [J]. Bioorg Med Chem Lett, 2007, 17(6): 1701-1704.
[15]刘媛, 秦川, 侯菲儿, 等. 贝加因黄酮与不同异构体人血清白蛋白相互作用机制研究[J]. 化学学报, 2009, 67(7): 629-636.
[16]王彦卿, 张红梅, 张朝平. 荧光光谱法研究茶碱与血红蛋白的相互作用[J]. 化学试剂, 2006, 28(3): 156-158.
[17]WANG Jing, WANG Xi, CHEN Feng, et al. Development of competitive direct ELISA for gossypol analysis[J]. J Agric Food Chem, 2005, 53: 5513-5517.
[18]FUKUNISHI H, TERAMOTO R, TAKADA T, et al. Bootstrap-based consensus scoring method for protein-ligand docking[J]. J Chem Inf Model, 2008, 48(5): 988-996.
[19]ZHAO Guangjiu, LIU Jianyong, ZHOU Lichuan. Site-selective photoinduced electron transfer from alcoholic solvents to the chromophore facilitated by hydrogen bonding: A new fluorescence quenching mechanism [J]. J PhysChem B, 2007, 111(30): 8940-8945.
Effect of Sudan Red III on Fluorescence Quenching of Myoglobin and Molecular Modeling of Their Interaction
ZHU Shao-ping1,CAI Bing-feng2,MAO Hui2,ZHAO Bo2,*
(1. School of Science, Changzhou Institute of Technology, Changzhou 213002, China;2. Jiangsu Key Laboratory of Biofunctional Materials, College of Chemistry and Materials Science, Nanjing Normal University, Nanjing 210097, China)
The molecular interaction mechanism between Sudan red III and myoglobin (Mb) was investigated by fluorescence spectrum combined with molecular modeling under the mimic physiological conditions. Results showed that the fluorescence of Mb was quenched by Sudan red III due to the complex formation between them. This kind of fluorescence quenching was a static quenching. Molecular modeling revealed that Sudan red III could bind to the Site 1 of Mb. Hydrophobic interaction and hydrogen bond formation contribute to the binding of Sudan red III. The hydrophobic interaction and hydrophilic interaction between Sudan red III and Trp, Tyr, Phe residues in Mb resulted in static fluorescence quenching of Mb and disordered displacement of maximum emission peak. These interactions were focused on the residues of Phe33, Phe43 and Phe138 in Mb.
Sudan red III;myoglobin;interaction;fluorescence quenching;molecular modeling
TS202.3
A
1002-6630(2010)21-0165-04
2010-08-02
江苏省科技厅自然科学基金项目(K2009407);上海市科委2010年度“科技创新行动计划”生物医药和农业科技领域重点科技攻关项目(10391901800)
朱少萍(1971—),女,讲师,硕士,主要从事有机分析、食品安全预警研究。E-mail:zhushaoping18@163.com
*通信作者:赵波(1969—),男,教授,博士,主要从事食品安全预警和检测研究。E-mail:zhaobo@njnu.edu.cn
