固态发酵菜籽肽功能特性研究
2010-10-19鞠兴荣何海艳王立峰
鞠兴荣,何海艳,何 荣,王立峰,,袁 建
(1.南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210003;2.江南大学食品学院,江苏 无锡 214122)
固态发酵菜籽肽功能特性研究
鞠兴荣1,何海艳1,何 荣2,王立峰1,2,袁 建1
(1.南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210003;2.江南大学食品学院,江苏 无锡 214122)
研究固态发酵制备菜籽多肽的功能特性,同时与菜籽蛋白功能特性进行比较。结果表明,发酵菜籽肽具有良好溶解性,在pH2.0~12.0范围内,保持较高的氮溶解指数(NSI>85%),而菜籽蛋白在pH8.0以下会凝聚沉淀;在20~80℃温度范围内,菜籽蛋白的吸水力和吸油力变化不大,而发酵菜籽肽的吸水力和吸油力则随着温度的升高而降低;在2~5g/100mL质量浓度范围内,菜籽肽的乳化性优于菜籽蛋白;发酵菜籽肽也具有良好的起泡性和泡沫稳定性,但是不具有凝胶性;另外,在0~500μg/mL质量浓度范围内,菜籽肽对DPPH自由基的清除能力与其质量浓度成线性相关(R2=0.9912),IC50为328μg/mL。
固态发酵;菜籽肽;功能性质
Abstract:The functional properties of rapeseed peptides (RSP) derived from solid-state fermentation were studied and compared with those of rapeseed protein (RP) in this work. The results showed that in comparison with RP, RSP had a better solubility and could keep a high NSI over 85% at a wide range of pH 2.0 to 12.0, while RP had a worse solubility when the value of pH was lower than 8.0. Neither the water-binding nor oil-binding capacities of RP had an obvious change at a varying temperature between 20℃ and 80 ℃, while those of RPS decreased as temperature increased. RSP also showed better emulsifying capacity in a large concentration range (2 to 5 g/100mL) when compared with RP. At the same time, RSP had better foaming capactiy and foam stability but had worse gel properties. Besides, RSP had the ability to scavenge DPPH free radicals, which was positively linearly correlated with concentration over a range from 0 to 500μg/mL (R2=0.9912), and the IC50 was 328μg/mL.
Key words:solid-state fermentation;rapeseed peptides;functional properties
所谓功能特性是指蛋白、肽在配制、加工、储藏和制取过程中的理化性质,包括溶解性、吸水力、乳化性、吸油力、黏度、胶凝性和起泡性等[1],其功能特性的优劣取决于蛋白质、肽本身的大小与结构、环境因素(浓度、pH值、离子强度等)以及其他成分(水、糖、气味等)的存在[2]。菜籽蛋白质水解得到的多肽不仅具有良好的酸溶性、低黏度、抗凝胶形成性,而且在体内消化吸收快,蛋白质利用效率高[3];低分子质量的菜籽肽具有低抗原性,不会产生过敏性反应;低分子质量的肽具有良好的生理活性,如抗氧化、抗肿瘤等生物活性[4-5],可作为运动营养剂、老年食品等。
本研究通过与碱溶酸沉工艺制备得到的菜籽分离蛋白进行比较,研究枯草芽孢杆菌固态发酵得到的菜籽肽的功能特性,为发酵菜籽肽在食品中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
菜籽分离蛋白,粗蛋白质量分数为85.55%(干基,N×6.25);发酵菜籽肽,粗蛋白质量分数为84.3%(干基,N×6.25),实验室自制[6]。
2,2-二苯基-1-苦味肼基(DPPH)、抗坏血酸(VC)、α-生育酚(VE) Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
PHS-3C型精密数显pH计、722N紫外-可见分光光度计 上海精密科学仪器厂;GL-20B型高速冷冻离心机上海安亭科学仪器厂;数显高速剪切乳化机 上海磨具厂;ALpHA2-4 型真空冷冻干燥机 德国Christ公司;质构分析仪 英国Stable Micro System公司。
1.3 方法
1.3.1 发酵菜籽多肽的制备
从活化后的菌种保藏斜面中挑取两环枯草芽孢杆菌接种于种子培养基中,8层纱布封口,35℃、120r/min,摇床培养24h,使菌体达到108个/mL。按3×107个/mL的接种量将液体种子接入已灭菌的无菌水中,无菌水中事先加入葡萄糖(0.26g/100mL )和KH2PO4(0.26g/100mL),调pH值为7.0,即得发酵剂[7]。
将菜籽粕粉碎至颗粒径大小为500μm,灭菌,按固液比1:2加入发酵剂,调节发酵温度为32℃,环境湿度为90%,定时搅拌通风,发酵3d后取样,按固液比1:15加蒸馏水溶解发酵培养基,搅拌30min,5000×g离心15min,取上清液真空浓缩,冷冻干燥得菜籽肽粉,备用。
1.3.2 菜籽蛋白、肽凝胶的制备
Li等[8]的方法,并略作改进。取一定量菜籽蛋白和菜籽肽,溶于0.1mol/LNaCl溶液中,配制成质量浓度为15g/100mL、pH7.5溶液,磁力搅拌2h,使菜籽蛋白、肽充分溶解。取10mL已溶解的菜籽蛋白、肽于10mL小烧杯中,置于50℃的水浴中,保温30min,取出置于95℃的水浴中,保温15min,然后将其置于4℃的冰箱中存放24h,取出陈化30min,研究菜籽蛋白、肽的凝胶性。
1.3.3 菜籽肽溶解性的测定
采用凯氏定氮法测定。称取菜籽蛋白和菜籽肽各0.5g,溶解于50mL不同pH值(2~l2)的缓冲溶液中(0.05mol/L),室温下磁力搅拌30min,2000×g离心20min,取上清液,按公式(1)计算溶解度。

1.3.4 菜籽肽吸水力的测定
参照参考文献[9]测定。取10mL离心管,称质量(m1)。准确称取干质量(m0)0.5g菜籽蛋白质或肽于离心管中,加蒸馏水2mL,用细铁丝搅动均匀,成稀糊状。将装有蛋白质溶液的离心管置于水浴锅中45℃保温30min,取出于冰水浴中冷却30min。2000×g离心20min,去除上清液,称离心管质量(m2),按公式(2)计算吸水力(WHC)。

1.3.5 菜籽肽吸油力的测定
参照参考文献[10]测定。称取0.5g菜籽蛋白质或肽于10mL离心管中,加入3mL大豆色拉油,磁力搅拌5min,分别于25、45、65、85℃水浴中保温30min,2000×g离心20min,吸去上层未吸附油,称质量。按公式(3)计算吸油能力。
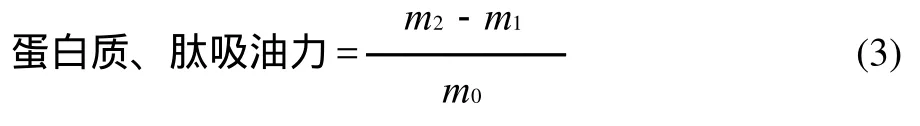
式中:m0为样品的质量/g;m1为样品的质量+离心管的质量/g;m2为吸油后样品质量+离心管的质量/g。
1.3.6 菜籽肽起泡性及泡沫稳定性的测定
参照Pedroche等[11]方法测定。称取0.2g菜籽蛋白质、肽,溶解于20mL pH7.0的缓冲液中,配成质量浓度为1g/100mL的溶液,室温磁力搅拌30min后,于乳化分散机中10000r/min分散1min,将样品全部转移至25mL量筒内,计下泡沫的高度(h0,0min),静置l0、30、 60、 90、120min后,分别测定泡沫的高度(h1),按公式(4)、(5)计算起泡性和泡沫稳定性。
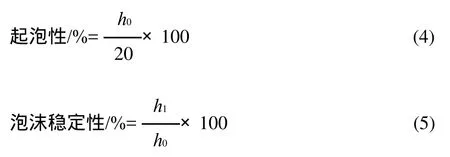
1.3.7 菜籽肽乳化性及乳化稳定性的测定
参照Pearce等[12]方法测定。将菜籽蛋白、肽溶解于50mL、0.1mol/L的NaH2PO4-Na2HPO4缓冲液(pH8.0),配制成不同质量浓度的菜籽蛋白、肽溶液,取出15mL按照油、蛋白质或肽体积比1:3的比例向蛋白质、肽溶液中加入大豆色拉油,最终体积为20mL。室温10000r/min乳化均质1min,分别在0、10min从底部取样。以0.1g/100mL SDS稀释100倍,测定波长500nm处的吸光度,以SDS溶液为空白,0时刻的吸光度表示乳化性,乳化稳定性用乳化稳定指数表示。
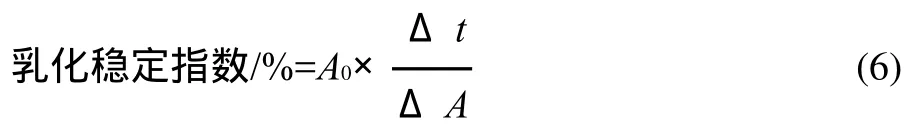
式中:A0为0时刻的吸光度;Δt为时间差,10min;ΔA为Δt内的吸光度差值。
1.3.8 菜籽肽凝胶性的测定
用质构仪(TPA)测定凝胶的强度,选用直径为10mm的圆柱状平头冲头(探头型号P/0.5)。测前速度:2mm/s;测试速度:1mm/s;测后速度:2mm/s;穿刺距离:10mm;时间:5s。做3次平行实验,取平均值得到凝胶质构参数。
1.3.9 清除DPPH自由基能力的检测
采用DPPH氧化法测定[13]。在洁净试管中加入不同发酵时间的样品溶液,再加入2mL的DPPH 无水甲醇溶液(0.1mmol),混匀,室温下避光静置30min后,测波长517nm处的吸光度,按公式(7)计算菜籽肽清除DPPH自由基的能力。

式中:A0为DPPH自由基无水乙醇溶液(空白对照)的吸光度;Ai为DPPH自由基无水乙醇溶液+样品的吸光度;Aj为无水乙醇+样品的吸光度。
1.3.10 菜籽肽分子质量测定
参照文献[6]采用凝胶过滤色谱法测定。色谱条件:Superose 1210/300GL(10mm×300mm)柱;流动相50mmol/L磷酸盐缓冲液pH值7.0,0.15mol/L NaCl;流速0.5mL/min;进样体积500μL;检测波长215nm。分子质量标准品为牛血清白蛋白(分子质量MW67000D)、细胞色素(MW12700D)、钴胺酰胺(VB12,MW1355D)、Gly-Gly-Tyr-Arg(MW451.48D)。
1.4 数据分析
每组指标测定重复3次,取平均值。采用方差分析(ANOVA)对数据进行差异性检验,结果均采用平均值±标准差表示。
2 结果与分析
2.1 菜籽肽的溶解性
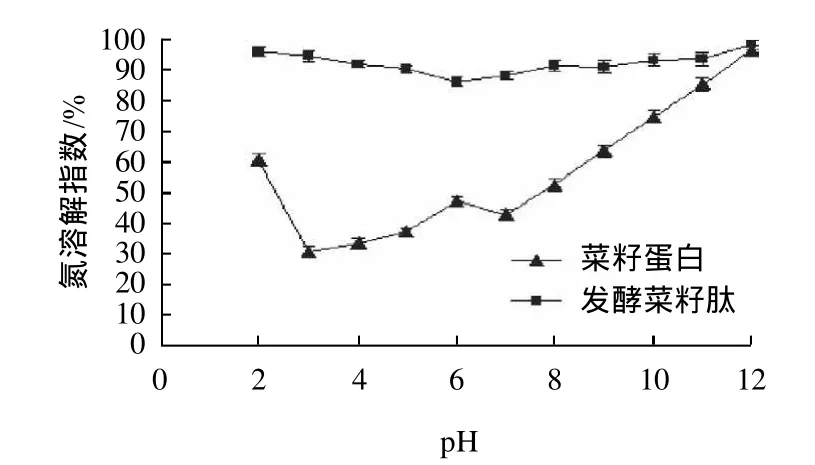
图1 不同pH值时菜籽蛋白和发酵菜籽肽的溶解性Fig.1 Effect of pH on solubility of RSP and RP
蛋白质、肽的溶解性直接影响到它在食品工业中的应用,因为蛋白质的溶解性对其他功能性质如吸水性、起泡性、乳化性和凝胶等有直接的影响,不溶性蛋白质在食品中的应用是非常有限的。图1显示了不同pH值条件下菜籽蛋白和菜籽肽的溶解性,在pH3.0~5.0范围内,菜籽蛋白溶解性较低,而pH值高于8.0以后随pH值的升高,溶解性逐渐增大,pH12.0时菜籽蛋白NSI值可以达到90%以上;在pH3.0~4.0和pH7.0菜籽蛋白溶解性出现最低点,可能是该pH值是菜籽蛋白的等电点[14],而偏离等电点(pH12.0,pH2.0)时蛋白质有较高的溶解性。另外,与菜籽蛋白相比,发酵菜籽肽在较宽的pH值(2.0~12.0)范围内都保持较高的溶解性,这主要是发酵时产生的蛋白酶水解大分子蛋白为小分子蛋白肽的原因,发酵提高了菜籽蛋白的溶解性。
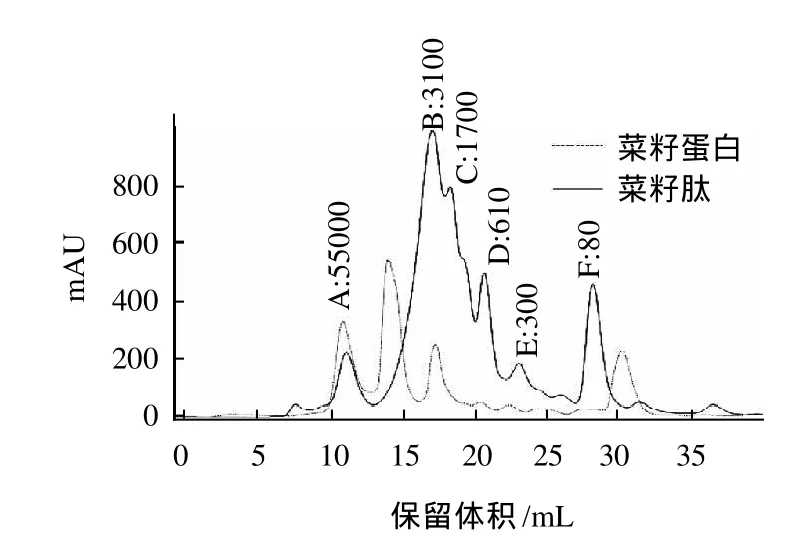
图2 菜籽肽的分子质量分布Fig.2 Molecular weight distribution profile of RSP
利用凝胶过滤色谱对菜籽肽分子质量分布进行研究,由图2可以看出,菜籽粕固态发酵后,大分子质量蛋白质被水解成小分子质量菜籽多肽,且主要是分子质量为300~3000的短肽,正是由于菜籽肽中含有较多的小分子质量物质,才提高了菜籽肽的溶解性。
2.2 菜籽蛋白和发酵菜籽肽的吸水力、吸油力
蛋白质、肽的吸水力与吸油力受pH值、温度、离子强度的影响。具有较高吸水力与吸油力的蛋白质、肽可以作为强化剂添加到食品中,改善其感官品质。由于菜籽肽在较宽的pH值下都具有较高的溶解性,因此功能性质的研究不考虑pH值对其的影响。由图3可以看出,随着温度的升高(20~80℃),菜籽蛋白的吸水力与吸油力变化不大,而发酵菜籽肽的吸水力和吸油力则随着温度的升高而降低。在较高温度时,菜籽肽吸油力较低,而在较低温度时,菜籽肽的吸油力较强,这主要是因为在较低温度时油的黏性较大所致。另外,总体上看,不同温度下,菜籽蛋白的吸水力和吸油力都高于发酵菜籽肽,原因可能是发酵菜籽肽分子质量较小,界面面积较小,对油和水的吸附能力较弱。此结果与Cumby等[15]的研究结果一致。

图3 不同温度下菜籽蛋白和发酵菜籽肽的吸水力和吸油力Fig.3 Effect of temperature on water and oil-binding capacities of RSP and RP
2.3 菜籽肽起泡性及泡沫稳定性
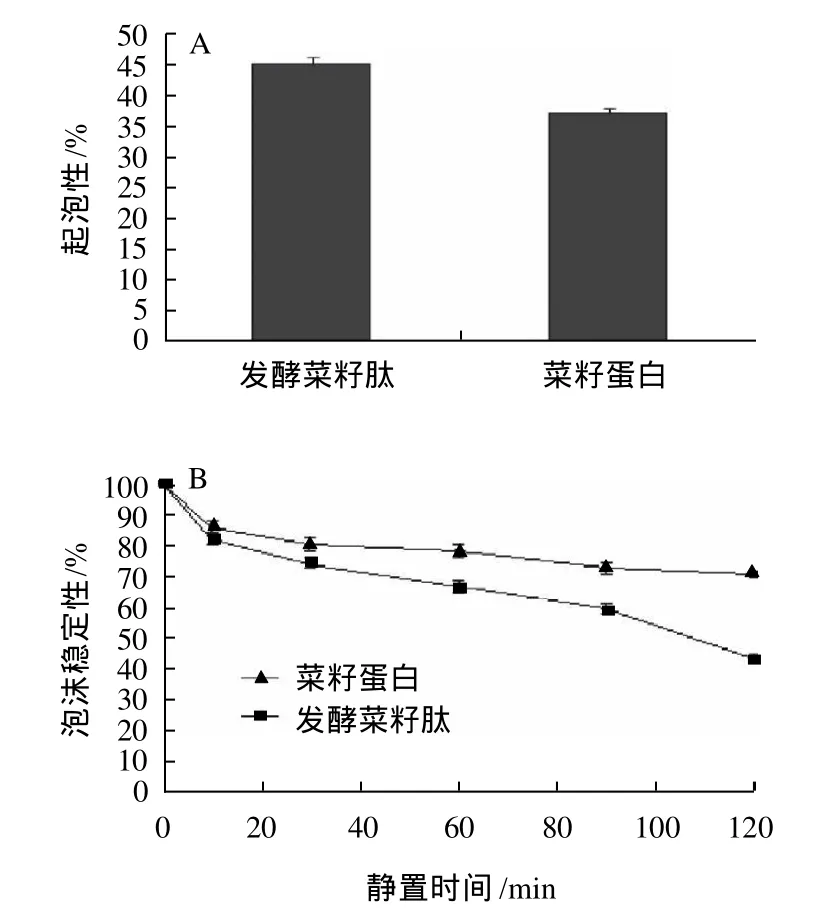
图4 菜籽蛋白、发酵菜籽肽的起泡性及泡沫稳定性Fig.4 Comparisons on foaming capacity and foam stability of RSP and RP
蛋白质、肽的起泡能力主要取决于其溶解性,蛋白质高溶解性是良好的起泡能力和稳定性的先决条件[16]。由图4可以看出,发酵菜籽肽的起泡性和泡沫稳定性优于菜籽分离蛋白,这是因为在pH7.0时发酵菜籽肽比菜籽蛋白有较好的溶解性,同时,起泡性受表面张力的影响,蛋白质水解后,水解物黏度降低,低表面张力对泡沫的形成比较有利。
2.4 菜籽肽的乳化性及乳化稳定性

图5 菜籽蛋白、发酵菜籽肽的乳化性及乳化稳定性Fig.5 Comparisons on emulsifying capacity and emulsion stability of RSP and RP
蛋白质、肽的溶解度与其乳化容量或乳状液稳定性之间通常存在正相关,不溶性蛋白质对乳化作用的贡献很小,但不溶性蛋白质颗粒常常能够在已经形成的乳状液中起到加强稳定作用[17]。另一方面,蛋白质的质量浓度对其乳化性和乳化稳定性有着直接的影响,乳化性和乳化稳定性随蛋白液质量浓度的增加而增大。由图5可以看出,发酵菜籽肽和菜籽蛋白的乳化性和乳化稳定性都随着质量浓度的增加而增大,在高质量浓度下(≥2g/100mL)发酵菜籽肽的乳化性要高于菜籽蛋白的乳化性,而发酵菜籽肽的乳化稳定性在一定质量浓度范围内(1~5g/100mL)要低于菜籽蛋白的乳化稳定性,原因可能是蛋白质水解后,疏水性残基暴露在蛋白质表面,降低了油水界面的张力,而提高了其乳化能力[18]。
2.5 菜籽肽的凝胶性

表1 菜籽蛋白、发酵菜籽肽的凝胶性Table 1 Comparisons on gel properties of RSP and RP
凝胶化作用和形成凝胶结构是食品蛋白质重要的功能性质,通过对蛋白质的限制性改性可以提高其凝胶性,而小分子多肽一般不具有凝胶性。由表1可以看出,与发酵菜籽肽相比,菜籽蛋白具有较好凝胶性。菜籽蛋白的硬度较高,但是其脆度和内聚性都低于菜籽肽,原因是菜籽蛋白水解成小分子肽后,蛋白质-蛋白质相互作用减弱,加热时分子之间交联程度降低,无法形成凝胶[19]。
2.6 菜籽肽清除DPPH自由基能力
DPPH自由基是一种被广泛使用的自由基,在有机溶剂中非常稳定,呈紫色,在517nm处有一个特征吸收峰,当其遇到自由基清除剂时,DPPH的孤电子被配对,其乙醇溶液的颜色从深紫色转变成黄色,吸光度变小。因此,可通过测定吸光度的变化来评价对DPPH自由基的捕获效果。该方法灵敏、简便、实用且重现性好,一般常用于天然有机化合物和植物提取物的抗氧化活性考察[20]。
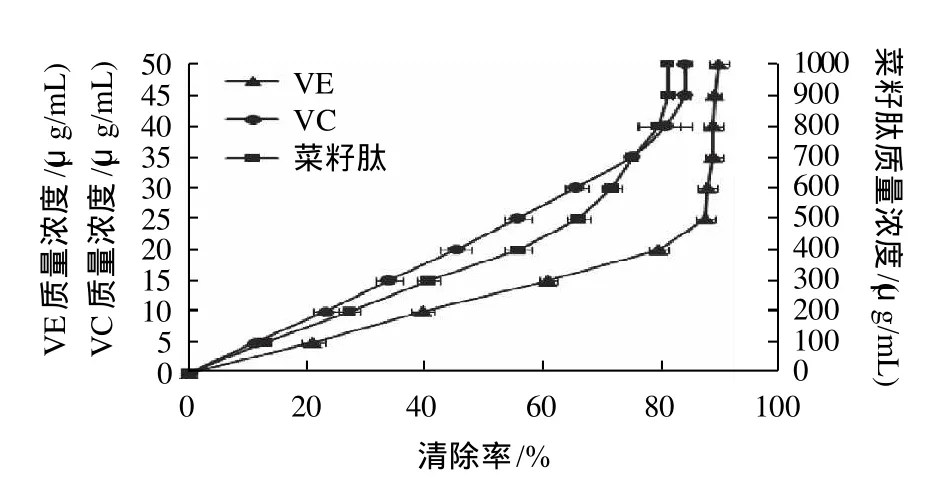
图6 菜籽肽清除DPPH自由基的能力Fig.6 Comparison on DPPH free radical scavenging capacity of VC,VE and RSP
由图6可知,菜籽肽具有较好的清除DPPH自由基的能力。在较低的质量浓度范围内(0~1000μg/mL),随质量浓度的增加逐渐增强,在质量浓度为900μg/mL时达到最大值80%(该值比大豆发酵产物高出很多,50mg/mL,60%)[21],之后再增加质量浓度,对DPPH自由基的清除能力变化不大;在低质量浓度范围(0~500μg/mL),菜籽肽对DPPH自由基的清除能力与其质量浓度成线性相关(R2=0.9912),IC50为328μg/mL。但是总体看来菜籽肽对DPPH自由基的清除能力要低于VC和VE。
3 结 论
发酵菜籽肽具有良好溶解性,在pH2.0~12.0范围内保持较高的氮溶解指数(NSI>85%),而菜籽蛋白在pH8.0以下会凝聚沉淀,溶解性较低。因此,与菜籽蛋白相比,菜籽肽更适合于酸性饮料的开发。
与菜籽蛋白相比,发酵菜籽肽具有良好的乳化性能,在较宽的pH值范围和较大的质量浓度范围(2~5g/100mL)内均表现出良好的乳化性和乳化稳定性;发酵菜籽肽也具有良好的起泡性和泡沫稳定性,但是凝胶性较差;吸水力及吸油力不及菜籽蛋白;另外,在0~500μg/mL质量浓度范围,菜籽肽具有较高的DPPH自由基清除能力。发酵菜籽肽经进一步纯化后可作为添加剂添加到搅打食品中,如糖果、糕点、蛋黄酱等中,改善其感官品质的同时,也提高了其营养功能。
参考文献:
[1] 王璋, 许时婴, 汤坚. 食品化学[M]. 北京:中国轻工业出版社, 2005:145-151.
[2] DAMODARAN S. Food proteins and their applications[M] . NewYork:CRC Press, 1997:19-21.
[3] PINTERITS A, ARNTFIELD S D. Improvement of canola protein gelation properties through enzymatic modification with transglutaminase[J]. Lwt-Food Science and Technology, 2008, 41(1):128-138.
[4] ZHANG Shaobing, WANG Zhang, XU Shiying, et al. Purification and characterization of a radical scavenging peptide from rapeseed protein hydrolysates[J]. Journal of the American Oil Chemists Society, 2009,86(10):959-966.
[5] XUE Zhaohui, YU Wancong, WU Moucheng, et al.in vivoAntitumor and antioxidative effects of a rapeseed meal protein hydrolysate on an S180 tumor-bearing murine model[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(11):2412-2415.
[6] 严梅荣, 鞠兴荣, 王丹丹, 等. 碱提酸沉淀方法制取菜籽蛋白质的研究[J]. 中国粮油学报, 2009, 24(6):72-75.
[7] 何荣, 鞠兴荣, 袁建, 等. 固态发酵生产菜籽肽及其清除自由基能力的研究[J]. 食品科学, 2009, 30(19):259-262.
[8] LI Xianghong, CHENG Yunhui, YI Cuiping, et al. Effect of ionic strength on the heat-induced soy protein aggregation and the phase separation of soy protein aggregate/dextran mixtures[J]. Food Hydrocolloids, 2009,23(3):1015-1023.
[9] 周瑞宝. 植物蛋白功能原理与工艺[M]. 北京:化学工业出版社, 2008:356.
[10] SINHA R, RADHA C, PRAKSH J, et al. Whey protein hydrolysate:Functional properties, nutritional quality and utilization in beverage formulation[J]. Food Chemistry, 2007, 101:1484-1491.
[11] PEDROCHE J, YUST M M, LQARI H, et al. Brassica carinata protein isolates:chemical composition, protein characterization and improvement of functional properties by protein hydrolysis[J]. Food Chemistry,2004, 88:337-346.
[12] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J]. J Agri Food Chem, 1978, 26(3):716-723.
[13] LI Yanhong, JIANG Bo, ZHANG Tao. Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106:444-450.
[14] KRAUSE J P, SCHWENKE K D. Behaviour of a protein isolate from rapeseed (Brassica napus) and its main protein components -globulin and albumin -at air/solution and solid interfaces, and in emulsions[J].Colloids and Surfaces B:Biointerfaces, 2001, 21(1/3):29-36.
[15] CUMBY N, ZHONG Y, NACZK M, et al. Antioxidant activity and water-holding capacity of canola protein hydrolysates[J]. Food Chemistry,2008, 109 (1):144-148.
[16] YOSHIE-STARK Y, WADA Y, SCHOTT M, et al. Functional and bioactive properties of rapeseed protein concentrates and sensory analysis of food application with rapeseed protein concentrates[J]. Lwt-Food Science and Technology, 2006, 39(5):503-512.
[17] CHABANON G, CHEVALOT I, FRAMBOISIER X, et al. Hydrolysis of rapeseed protein isolates:Kinetics, characterization and functional properties of hydrolysates[J]. Process Biochemistry, 2007, 42(10):1419-1428.
[18] TESSIER B, HARSCOAT-SCHIAVO C, MARC I. Selective separation of peptides contained in a rapeseed (Brassica campestrisL.) protein hydrolysate using UF/NF membranes[J]. Journal of Agricultural and Food Chemistry, 2006, 54(10):3578-3584.
[19] HYUN E H, KANG Y J. Gelation of rapeseed protein with microbial transglutaminase[J]. Korean Journal of Food Science and Technology,1999, 31(5):1262-1267.
[20] PRIOR R L, CAO G H.in vivoTotal antioxidant capacity:comparison of different analytical methods [J]. Free Radical Biol Med, 1999, 27(11/12):1173-1181.
[21] MOKTAN B, SAHA J, SARKAR P K. Antioxidant activities of soybean as affected byBacillus-fermentation to kinema[J]. Food Research International, 2008, 41(6):586-593.
Functional Properties of Rapeseed Peptides Derived from Solid-state Fermentation
JU Xing-rong1,HE Hai-yan1,HE Rong2,WANG Li-feng1,2,YUAN Jian1
(1. Key Laboratory of Grain and Oils Quality Control and Deep-Utilizing Technology of Jiangsu Province, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210003, China;2. School of Food Science and Technology,Jiangnan University, Wuxi 214122, China)
TS221
A
1002-6630(2010)21-0045-05
2010-05-26
国家“863”计划项目(2007AA10Z331);农业科技成果转化资金项目(2009C10045)
鞠兴荣(1957—),男,教授,博士,研究方向为食品营养及功能性成分开发。E-mail:xingrongju@163.com
