雷公藤多糖甙对大鼠脑缺血/再灌注损伤的影响
2010-03-19李庆军方树友
方 莉,李庆军,方树友
1)郑州大学医院检验科郑州 450001 2)郑州大学第一附属医院神经内科郑州 450052△女,1969年3月生,本科,主管技师,研究方向:神经疾病,E-mail:qrsy327@163.com
脑缺血/再灌注损伤机制迄今尚未完全阐明。近年研究[1]表明,TNF-α在缺血性脑血管病中起重要作用。脑缺血诱导的细胞因子如肿瘤坏死因子 α (tumor necrosis factorα,TNF-α)等表达在脑炎症反应中起重要作用。雷公藤多糖甙(multi-glycosides of tripterygium wilfordii Hook F.,GTW)为雷公藤(tripterygium wilfordii Hook F.,TWHF)提取物,含有多种活性成分。体外实验[1]表明 GTW可抑制TNF-α的产生。作者建立了大鼠局灶性脑缺血/再灌注损伤模型,观察GTW对血清TNF-α水平的影响,探讨脑血管病的发病机制及GTW的药理作用。
1 材料与方法
1.1 实验动物和试剂 健康Wistar大鼠132只,雌雄不限,体质量 250~300 g,由河南省实验动物中心提供。GTW:10mg购自湖南株州市制药三厂出品,批号20070302。TNF-α放射免疫分析药盒购自北京北免东雅公司。
1.2 动物模型的建立 大鼠局灶性脑缺血/再灌注损伤模型参照Longa等[3]方法建立,大鼠清醒后,观察大鼠的体征,出现以下体征者表明模型的制作成功:①左侧Homer's征。②右前肢瘫痪,将鼠尾提起,大鼠不能充分伸展右前肢;当动物右旋时其右前肢拖在腹下,与左前肢交叉成剪刀状;当左旋时,其右前肢掌面向上,被拖在身体的右侧。无上述体征者舍弃。
1.3 实验分组 大鼠 132只,随机分为4组,每组33只:Ⅰ组为假手术组,进行手术操作,但不穿线;Ⅱ组为手术组,即脑缺血/再灌注损伤组;Ⅲ组为脑缺血/再灌注损伤+生理盐水治疗组;Ⅳ组为脑缺血/再灌注损伤+GTW治疗组。Ⅳ组于实验前3 d开始灌胃给药,GTW量为30mg/kg,每天2次,术前1 h加灌 1次。Ⅲ组给予等体积生理盐水。Ⅰ、Ⅱ、Ⅲ组及Ⅳ组分别于 1、3、6、12及 24 h时间点处死,每时间点6只,留取血清用放免法测定TNF-α含量。缺血 1 h/再灌注 24 h后每组断头处死每组 3只大鼠,取脑制作病理组织切片,HE染色后观察。
1.4 统计学处理 采用SPSS 10.0对各组大鼠不同时间点血清TNF-α含量进行单因素方差分析,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 各组大鼠局灶性脑缺血/再灌注损伤后病理改变 Ⅰ组无梗死灶,神经元结构、形态正常,无间质水肿(图1A);Ⅱ组(图1B)和Ⅲ组(图1C)呈点状坏死,神经元胞体缩小,变形、核固缩,胞浆浓缩呈深伊红染色,间质水肿明显(神经元纤维疏松,神经元、胶质细胞以及血管周围腔隙增大)。Ⅳ组多数神经元结构较完整,形态相对正常,间质水肿明显减轻(图1D)。
2.2 不同的再灌注时间各组大鼠血清中TNF-α的变化 见表1。
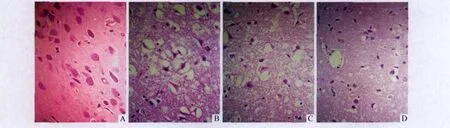
图1 各组大鼠脑组织病理形态(HE,×400)A,B,C,D:分别为Ⅰ、Ⅱ、Ⅲ及Ⅳ组。

表1 不同的再灌注时间各组大鼠血清中TNF-α的变化(n=6) μg/L
3 讨论
Liu等[4]观察到在缺血后 1 h缺血侧神经元即有TNF-αmRNA的表达,12 h达高峰。该实验结果显示,在大鼠脑缺血1 h/再灌注3 h时TNF-α浓度开始升高,6 h达高峰,随后下降,但 24 h仍高于假手术组,提示脑缺血/再灌注过程中TNF-α合成增加。
TNF-α对神经元无直接毒性,而是通过广泛的间接途径产生继发性损伤[5-7],诱导和刺激包括炎症介质、细胞坏死及凋亡相关因子在内的急性期蛋白分泌;参与并促进脑缺血急性期“瀑布效应”,刺激兴奋性氨基酸的释放,促进脑缺血后NMDA受体的激活及钙超载损伤的级联效应,激活核因子NF-κB调节黏附分子、细胞因子和化学因子的合成和分泌,影响胶质细胞、基质金属蛋白酶表达和破坏细胞间通信,恶化脑缺血后内环境紊乱和组织损伤,触发多种凋亡机制,介导神经元的凋亡,因此,下调TNF-α水平可以改善脑缺血的预后。
作为抗炎药物GTW能明显抑制TNF-α的产生。体外实验[8]证实TWHF能明显抑制单核巨噬细胞、淋巴细胞分泌 TNF-α。在某些炎症性动物模型研究[9]中发现,TWHF能明显降低这些模型中炎症细胞因子如TNF-α、IL-1β等的浓度,减轻炎症反应,促进机体恢复。该实验中也有类似发现,大鼠脑缺血再灌注损伤后,GTW可以降低再灌注3~24 h时的血清 TNF-α的水平,Ⅳ组为脑缺血/再灌注损伤后30mg/kg雷公藤多糖甙治疗组,结果表明多数神经元结构较完整,形态相对正常,间质水肿明显减轻。该研究提示 GTW可以减轻脑缺血/再灌注后炎症反应,从而减轻脑缺血/再灌注损伤,对脑缺血/再灌注损伤有保护作用。
[1]Lamberten KL,Clausen BH,Babcock AA,et al.Microglia protect neurons against ischemia by synthesis of tumor necrbsis factor[J].JNeurosci,2009,29(5):1 319
[2]Chang DM,ChangWY,Kuo SY,etal.The effects of traditional antirheumatic herbal medicines on immune response cells[J].JRheumatol,1997,24(3):436
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke,1989,20(1):84
[4]Liu T,Clark RK,McDonnell PC,et al.Tumor necrosis factor-alphaexp ression in ischem ia neurons[J].Stroke,1994, 25(7):1 481
[5]Gong C,Qin Z,Betz AL,etal.Cellular localixation of tumor necrosis factor alpha followng focal cerbral ischcm ia in m ice brain res[J],1998,801(1/2):1
[6]Uno H,Mastsuyam T,Akita H,et al.Induction of tumor necrosis factor-alpha in the mouse hippocampus following transient forebrain ischemia[J].J Cereb Blood Flow Metab,1997,17(5):491
[7]Zera T,Ufnal M,Szczepanska-Sadowska E.Central TNF-alpha elevates blood pressureand sensitizes to central pressor action of angiotensinⅡin the infarcted rats[J].J Physiol Pharmacol,2008,59(8):117
[8]Nijboer CH,Heijnen CJ,Groenendaal F,et al.Alternate pathways preserve tumor necrosis factor-alpha p roduction after nuclear factor-kappa B Inhibition in neonatal cerebral hypoxia-ischemia[J].Stroke,2009,40(10):3 362
[9]Adibhatla RM,Hatcher JF.Secretory phospholipase A 2ⅡA is up-regulated by TNF-alpha and IL-1alpha/beta after transient focal cerebral ischemia in rat[J].Brain Res, 2007,1 134(1):199
