热化疗对Raji细胞生长、JNK通路及热休克蛋白70表达的影响*
2010-03-19刘新奎1琳3张明智2
刘新奎1,2),王 琳3),张明智2)#
1)郑州大学第一附属医院病案管理科;河南省高等学校临床医学重点学科开放实验室郑州 450052 2)郑州大学第一附属医院肿瘤科郑州 450052 3)郑州大学第一附属医院放疗科;河南省高等学校临床医学重点学科开放实验室郑州 450052
#通讯作者,男,1959年1月生,博士,教授,主任医师,研究方向:恶性淋巴瘤的基础与临床,E-mail:mingzhi_zhang@126.com
淋巴瘤是一组原发于淋巴结和(或)结外部位淋巴组织的淋巴细胞或组织细胞的恶性肿瘤[1]。淋巴瘤的临床治疗主要有化疗、放疗及造血干细胞移植治疗,但均存在选择性不高的缺点,治疗中常出现较明显的毒副反应,且易复发。热疗被认为是继手术、放疗、化疗及生物疗法之后的第 5种治疗肿瘤的方法[2]。该研究中作者将加热与治疗淋巴瘤常用的化疗药物阿霉素联合应用,观察其对人淋巴瘤Raji细胞生长以及c-Jun氨基末端激酶(JNK)信号转导通路和热休克蛋白70(HSP70)表达的影响,探讨热化疗作用的可能机制,为肿瘤热疗的临床实践提供理论依据。
1 材料与方法
1.1 细胞株、主要试剂与仪器 细胞株:Raji细胞株购自中国科学院细胞研究所。主要试剂:阿霉素注射液(太极集团四川太极制药有限公司)、噻唑蓝(Sigma公司)、鼠抗人HSP70单克隆抗体(美国Santa Cruz公司)、兔抗人JNK抗体和p-JNK (Thr183/Tyr185)抗体(美国Cell Signaling公司)、辣根酶标记山羊抗小鼠 IgG和辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。主要仪器:垂直电泳槽、电转仪、Sunrise酶标仪及恒温水浴箱。
1.2 实验分组 参考临床常用剂量,按如下方式进行分组:单纯化疗组(加入3.00 mg/L阿霉素,37℃培养24 h)、单纯热疗组(43℃水浴加热30 min,37℃培养24 h)、热化疗组(加入3.00mg/L阿霉素, 43℃水浴加热 30 min,37℃培养 24 h)及对照组(37℃培养24 h)。
1.3 细胞增殖率测定 采用MTT法检测。取对数生长期的细胞,常规消化制成单细胞悬液,调整细胞密度为2.5×104mL-1,接种于 96孔板,每孔 0.2 mL,置37℃、体积分数5%CO2培养箱中培养24 h,按1.2中设计处理细胞后放回37℃、体积分数 5% CO2培养箱继续培养48 h;每孔加入5 g/L MTT液20μL,继续孵育4 h,取出培养板,加入150μL二甲基亚砜(DMSO),微量振荡器振荡10 min,以DMSO调零,酶联免疫检测仪检测492 nm波长下每孔的吸光度(A)值。每组设 6个复孔,重复 3次。细胞生长增殖率=(实验组A值/对照组A值)×100%。
1.4 各组细胞JNK、磷酸化JNK(p-JNK)及HSP70蛋白的检测 离心收集各组细胞,将约 1× 106个细胞置于细胞裂解液中,在冰水浴中反复吹打进行破碎,4℃、10 000 r/m in离心10 min,吸取上清液,即为细胞提取液。进行总蛋白定量,调整蛋白浓度一致后,进行SDS-PAGE电泳,然后转移至硝酸纤维素膜上,分别以鼠抗人 HSP70抗体、兔抗人JNK抗体和兔抗人p-JNK抗体为一抗,辣根酶标记山羊抗小鼠或抗兔IgG为二抗,进行Western Blot分析,化学发光法显色后,应用GeneTool图像分析软件进行定量分析。
1.5 统计学处理 应用SPSS 13.0对数据进行分析。对各组细胞增殖率、p-JNK及HSP70蛋白的表达行析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 各组细胞增殖率、p-JNK及HSP70蛋白的表达比较 见图1、2,表1~3。
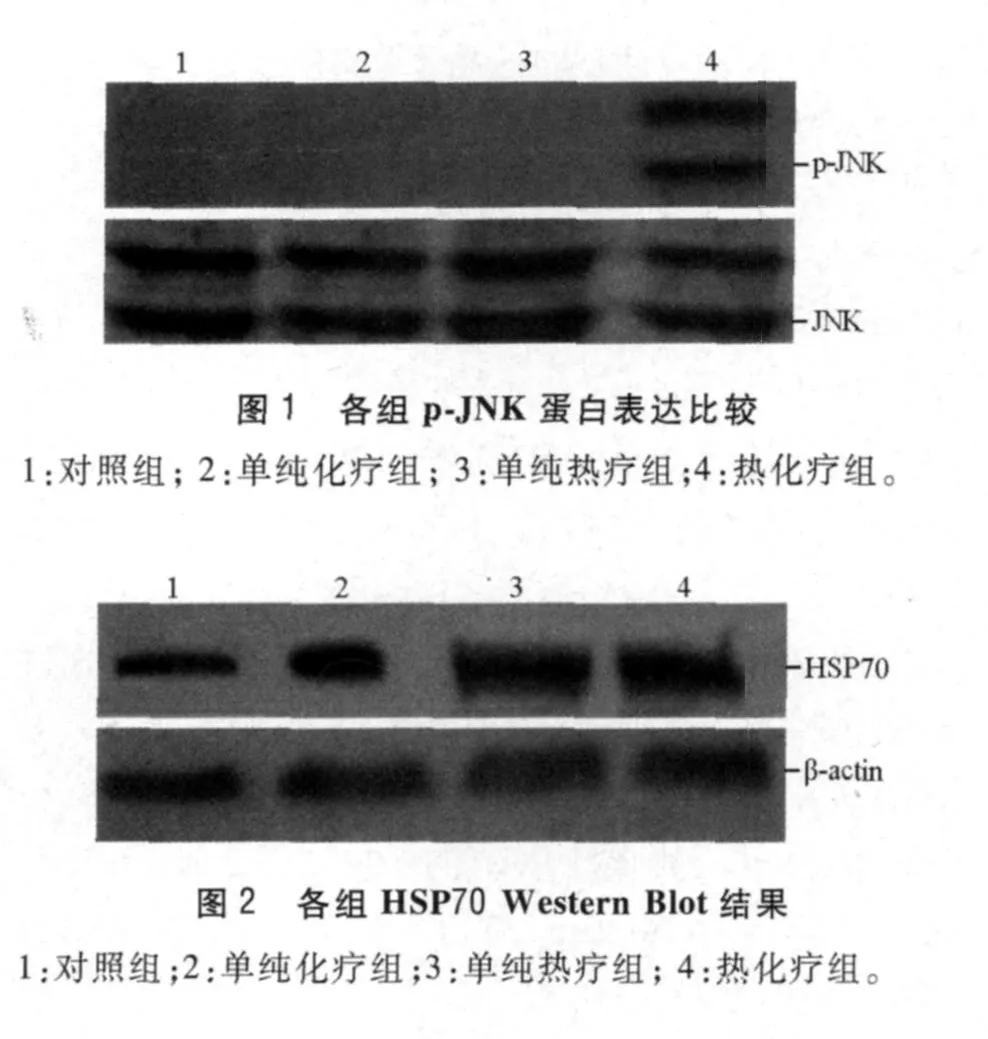

表1 各组细胞增殖率比较(n=3) %
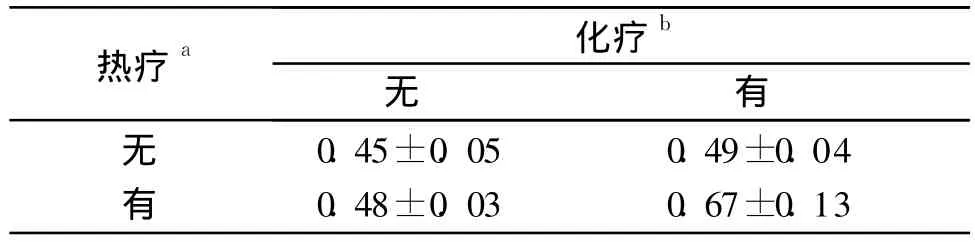
表2 各组细胞p-JNK水平比较(n=3)
3 讨论
由于实体瘤瘤体中心血供较周边差,中心多为乏氧细胞,对化疗和放疗不敏感,而对热较敏感;相反瘤体外周血供较中心血供好,外周细胞对化疗较热疗敏感,因此,热疗结合化疗能更有效地杀伤肿瘤细胞,同时,热化疗联合能增强化疗药物对肿瘤细胞的杀伤作用[5-6],逆转肿瘤细胞的耐药[7]。该研究结果显示,热疗或化疗单独作用均可抑制细胞增殖,而热化疗联合则有协同作用,与以上研究结果相符。
丝裂原活化蛋白激酶(MAPKs)信号转导通路是细胞应激反应中主要的信号转导途径之一,与细胞的增殖分化密切相关。其中JNK是MAPKs中的重要组成之一,在细胞应激过程中被上级激酶MAPKKs磷酸化其Thr183和Tyr185 2个作用位点而被激活,并通过磷酸化以及功能性修饰它的分子靶标来调控多种细胞的生理功能,尤其在细胞生长增殖及凋亡方面有重要作用[8-9]。该研究中,热疗或化疗单独作用均可使p-JNK水平升高,而热化疗联合则有协同作用,说明热化疗联合对Raji细胞生长的抑制作用可能是通过 JNK信号转导通路而发生的。
研究[10-12]显示,加热可以诱导 HSPs表达增加,导致细胞热耐受能力的提高。HSP70家族是HSPs中最保守和最主要的一类,在细胞应激后生成最为显著。该研究结果显示,单纯热疗或化疗均使HSP70表达升高,而与单纯热疗组相比,热化疗组HSP70表达降低,结合热化疗组细胞增殖率降低的结果,说明热化疗联合的协同作用可能对抗了HSP70对肿瘤细胞的保护作用,从而更好地抑制了肿瘤细胞的生长。
综上所述,热化疗联合可抑制Raji细胞增殖,这种抑制作用可能是通过激活 JNK信号转导通路或部分抑制HSP70蛋白的表达来完成。
[1]马静秋,梁辉,董戴玉,等.淋巴瘤骨髓侵犯临床特点分析[J].临床血液学杂志,2005,18(4):226
[2]张阳德,彭健.肿瘤治疗新方法:热疗[J].中国现代医学杂志,2003,13(10):43
[3]Kukoja-Taradi S,Taradi M,Andreis I.Thermotherapy of tumors[J].Lijec Vjesn,1994,116(3/4):102
[4]张洪新,刘燕,郭卫平,等.阿霉素加热化疗对人肝癌细胞耐药模型-7721/Adm多药耐药性的影响[J].中华物理医学与康复杂志,2000,12(6):366
[5]张继贤,张启昆,万毅新.阿霉素热化疗诱导 A 549细胞凋亡及线粒体跨膜电位的变化[J].中国临床药理学与治疗学,2004,9(6):662
[6]Hashimoto T,Shibata MA,Ito Y,et al.Elevated levels of intracelar Ca2+and apoptosis in human lung cancer cells give heat shock[J].Int J Hyperthermia,2003,19(2): 178
[7]王琳,杨继要,吴逸明.热化疗对肺部肿瘤细胞生长影响的研究[J].环境与职业医学,2007,24(2):201
[8]Johnson GL,Lapadat R.Mitogen-activated protein kinase pathwaysmediated by ERK,JNK and p38 protein kinases [J].Science,2002,298(5 600):1 911
[9]Seger R,Krebs EG.The MAPK signaling cascade[J]. FASEB J,1995,9(9):726
[10]卢宏,王建平,刘春岭,等.雌二醇预处理对大鼠脑缺血再灌注损伤脑组织HSP70表达的影响[J].郑州大学学报:医学版,2005,40(4):639
[11]盛光辉.谷氨酰胺对胃癌患者术后血清白细胞介素-8和热休克蛋白-70水平的影响[J].郑州大学学报:医学版,2009,44(4):822
[12]Lachapelle G,Radicioni SM,Stankiewicz AR,et al.Acute acidification or amiloride treatment suppresses theability of Hsp70 to inhibit heat-induced apoptosis[J].Apoptosis, 2007,12(8):1 479
