强力霉素对退变腰椎间盘中MMP-3表达水平的调控
2010-03-17李曾昊李宁宁肖荣驰
李曾昊,李宁宁,肖荣驰
(桂林医学院附属医院脊柱骨病外科,广西 桂林 541001)
椎间盘退变是椎间盘突出的基础。而退变常伴随着椎间盘基质成分合成和降解的失衡,基质金属蛋白酶(matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制因子(tissue inhibitor ofmetalloproteinases.TIMPs)失衡是导致基质过度降解的根本原因[1]。本实验利用新型MMPs抑制剂强力霉素作用于腰椎间盘退变大鼠模型,通过免疫组织化学及Western-bloting方法检测MMP-3在腰椎间盘组织中的表达水平,探讨强力霉素对退变腰椎间盘中MMP-3表达水平的调控。
1 研究对象与方法
1.1 研究对象
选取SD大鼠40只,雄性,平均月龄3个月,体重(300土50) g(广西医科大学实验动物中心提供)。按标准饲养条件下单笼饲养,饲养室室温控制在28℃左右。
1.2 方法
动物模型建立 3%的戊巴比妥(桂林医学院药理实验室配制),用量0.2 mL/100g体重腹腔注射麻醉,实验组SD大鼠取俯卧位,固定四肢,腰背部剃毛备皮约4 cm×8 cm,消毒铺单,沿腰背部棘突做后正中切口,切开皮肤后,沿骨膜下剥离。咬骨钳去除L1-L6的棘突、关节突,棘上棘间韧带,切断双侧竖棘肌,依层缝合皮下筋膜、皮肤。放入单独笼中饲养。术后连续3 d,每只SD大鼠给予青霉素5万U肌注。养至手术后8周。
注射强力霉素 椎间盘退变后的SD大鼠40只随机分成2组,每组20只,一组为实验组,用强力霉素(Sigma公司产品)12.5 mg每日2次皮下注射,至2周处死,手术取椎间盘组织。另一组为空白对照组,皮下注射等量生理盐水2周,同样手术取椎间盘组织。
应用免疫组织化学SP法检测腰椎间盘组织MMP-3的表达 放入福尔马林的组织样本固定48小时后取出,给予组织石蜡包埋后3-4μL连续切片,切片在60℃烤箱中烤片过夜,切片常规二甲苯脱蜡,梯度酒精脱水,3%H2O237℃孵育10 min阻断灭活内源性过氧化物酶,置0.01M枸橼酸缓冲液(PH6.0)中用煮沸修复抗原,自然冷却至室温,正常羊血清工作液封闭,滴加1:50稀释一抗(货号sc-6839,美国SANTA CRUZ公司产品)4℃冰箱孵育过夜,用PBS缓冲液代替一抗作阴性对照;滴加生物素标记二抗显色。苏木精复染,二甲苯透明,中性树脂封片,光镜下观察,每个切片随机选取10个高倍视野,用 Image-Pro Plus6.3系统进行图像分析。测量平均光密度值。
Western-bloting(蛋白质印迹技术) 提取退变SD大鼠椎间盘的总蛋白、检测提取蛋白总浓度、加等量总蛋白与各加样孔中SDS-PAGE电泳,蛋白印迹转至PVDF膜上,置抗体封闭液(5%脱脂奶粉-TBST)1小时后加入1:200的一抗(MMP-3,货号,货号sc-6839,美国Santa cruz公司)4℃过夜,第2天30℃摇床1小时,TBST洗膜后置1:10000的辣根酶标记兔抗山羊lgG(H+L)(北京中杉金桥生物技术有限公司),30℃摇床2小时,TBST洗膜后,于5mlUltraECL底物化学发光检测试剂中1分钟,滤纸吸干后用保鲜膜包裹,暗室内进行x线压片盒曝光10秒,显影、定影各5分钟,取出PVDF膜,加入抗体洗脱液洗脱抗体后,按上述步骤加入1:200β-actin(北京中杉金桥生物技术有限公司)和1:10000的辣根酶标记山羊抗兔lgG(H+L)(北京中杉金桥生物技术有限公司),再给于X线显像,最后用培清JS-780全自动凝胶分析系统摄像,凝胶成像分析软件测量各样本MMP-3和其相对应的β-actin的比值。
1.3 统计学分析
应用SPSS 14.0统计软件进行两样本均数比较的t检验。
2 结果
2.1 免疫组织化学检测
阳性染色主要位于椎间盘髓核内组织中的脊索细胞和类软骨细胞的胞浆中 (见图1~2),阴性对照组无阳性表达(见图3)。实验组大鼠的椎间盘组织MMP-3表达为弱阳性。
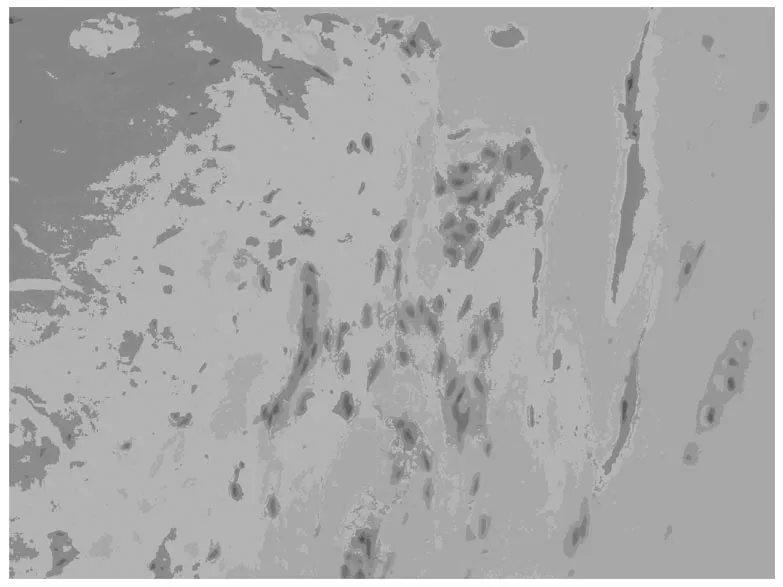
(图1)实验组×100

(图2)实验组 ×100
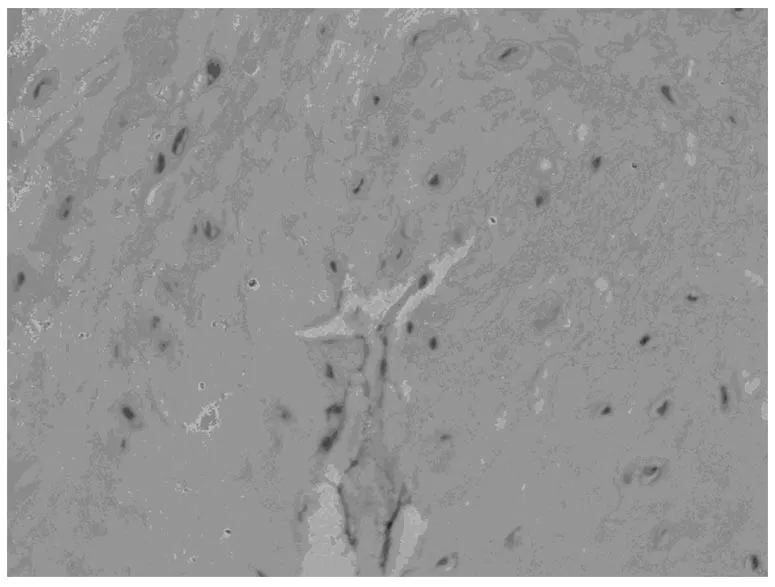
(图3)阴性对照×100
2.2 Western-bloting结果
图像分析显示MMP-3的相对分子量是5.5×104,β-actin相对分子量为4.2×104。比较结果见表1,(图像见图4~5)。
表1 平均光密度值和MMP-3平均相对含量的比较(
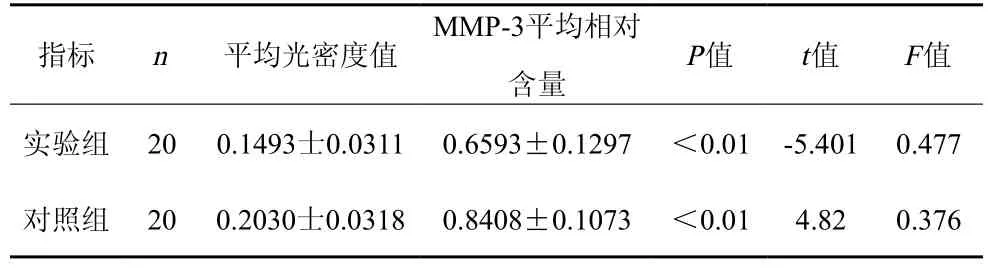
表1 平均光密度值和MMP-3平均相对含量的比较(
指标 n 平均光密度值 MMP-3平均相对含量 P值 t值 F值实验组 20 0.1493士0.0311 0.6593±0.1297 <0.01 -5.401 0.477对照组 20 0.2030士0.0318 0.8408±0.1073 <0.01 4.82 0.376
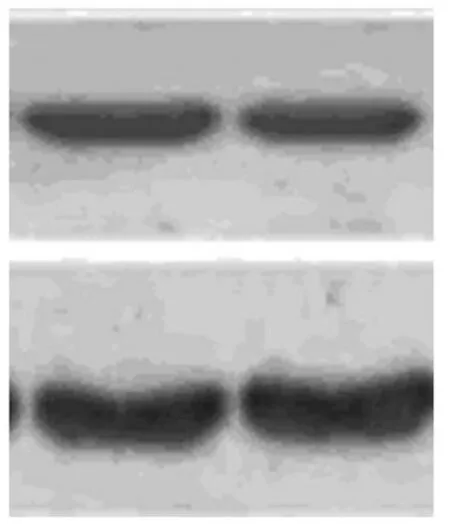
(图4) 实验组上方为MMP-3 下方为β-actin
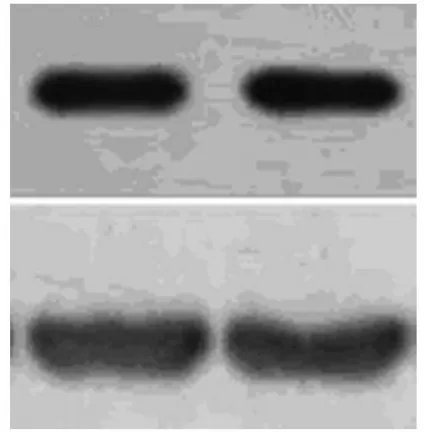
(图5) 对照组上方为MMP-3 下方为β-actin
3 讨论
MMPs是成纤维细胞,上皮细胞,炎症细胞,内皮细胞分泌,是基质降解酶类中最重要的一种,是一个Ca2+,Zn2+参与的基质的代谢过程并且参与多种正常的生理、病理过程。目前已发现了28个MMPs成员,其细胞来源、作用底物、诱导激活及抑制的调节机制却各异。MMPs是迄今为止发现的唯一能分解纤维类胶原的酶[2]。MMPs特别是MMP-3的增加被认为是加快细胞外基质降解的重要原因[3]。Kanemoto等[4]收集80例手术患者的100个椎间盘和死亡时间12h内的7具尸体的10个椎间盘,用抗MMP-3单克隆抗体和抗TIMP-1单克隆抗体进行免疫组化标记,结果多数标本MMP-3表达阳性,TIMP-1表达阴性。MMP-3表达阳性的细胞比例与MRI检查中的椎间盘退变程度有显著相关性,且突出型腰椎间盘中MMP-3表达阳性的细胞比例显著高于未突出型。Roberts等[5]发现突出的椎间盘标本中存在大量的MMPs,研究发现,在退变突出椎间盘中,MMP-2、MMP-9的表达与椎间盘的退变程度呈正相关,而MMP-3的含量和阳性表达率明显高于正常对照椎间盘。TIMPs家族是常常由分泌金属蛋白酶的同一种细胞合成的多基因家族的编码蛋白,可与MMPs的酶原和其活化形式结合,TIMPs可通过酶原活化阶段和活化后的MMPs来发挥调节,减轻细胞外基质降解的作用[6]。TIMPs可抑制所有MMPs的活性,但是TIMPs对MMPs各亚型的选择性较差。研究表明[7],TIMP-1和TIMP-2可与MMPs按1∶1的比例以非共价键形成有高度亲和力的复合物,从而抑制MMPs的活性。减轻细胞外基质降解的作用。分解代谢酶MMPs与基质金属蛋白酶组织抑制因子之间的平衡有利于调节髓核细胞的合成功能,防止椎间盘退变的发生和进展[8]。这些研究为TIMP治疗椎间盘退变可能打下了基础。
椎间盘退变的传统保守治疗中非甾体消炎药物只有缓解症状作用,无抑制椎间盘退变的作用,且临床副作用明显,实践表明其治疗效果不佳,所以TIMP治疗椎间盘退变成为了今年研究热点。大部分合成的MMP抑制剂,都是一种假肽类衍生物,但这类药物口服效果及局部耐受性均差。从而阻碍了它的发展。Doxycycline可代表一类化学修饰的四环素类金属蛋白酶抑制剂。在体内外研究中表明均有抑制金属蛋白酶表达的作用。但国内尚未见关于其抑制椎间盘退变的报道,实验研究表明强力霉素12.5 mg,每日2次,持续2周皮下注射椎间盘退变SD大鼠,能有效的抑制椎间盘退变。虽然强力霉素皮下注射能导致实验大鼠局部皮肤溃疡形成,难免有不尽人意的地方,但此药物为椎间盘退变的治疗开辟的新的思路。
[1] Razaq S,WilkinsRJ,Urban JP.The effect of extracellular pH on matrix turnover by cells of the bovine nucleus pulposus[J].Eur Spine J,2003,12(4):341-349.
[2] 吕浩然,丁悦,黄东生,等.基质金属蛋白酶及其抑制剂与椎问盘退变的关系[J].广东医学,2005,26(9):1 295-1 297.
[3] Gardner J,Ghorpade A.Tissue inhibitor of metalloproteinase (TIMP)-1:the TIMPed balance of matrix metalloproteinases in the central nervous system[J].J Neurosci Res,2003,74(6):801-806.
[4] Kanemoto M,Hukuda S,Komiya Y,et al.Immunohistochemical study of matrix metalloproteinase-3 and tissue inhibitor of metalloproteinase-1 human intervertebral discs[J].Spine,1996,21(1):1-8.
[5] Roberts S,Cater9on B,Menage J,et al.Matrix metalloproteinases and aggrecanase:their role in disorders of the human intervertebral disc[J].Spine,2000,25(23):3 005-3 013.
[6] Mori M,B ARNARD gf,Mimori K,et al.Overexpresion of matrixmetal loproteinase-7 mRNA in human colon carcinomas. Cancer,2005,75:1 516-1 519.
[7] Ishiguro N,Ito T,Oguchi T,et al.Relationships of matrix metalloproteinases and their inhibitors to cartilage proteoglycan and collagen turnover and infammation as revealed by analyses of synovialfuids from patients with rheumatoid arthritis.Arthritis Rheum,2001,44:2 503-2 511.
[8] Wallach CJ,Sobajima S,Watanabe Y,et al.Gene transfer of thecatabolic inhibitor TIMP-1 increases measured proteoglycans in cells from degenerated human intervertebral discs.Spine,2003,28:2 331-2 337.
