丙戊酸联合环孢素A治疗骨髓增生异常综合征的临床观察
2010-03-08吕致斌
吕致斌
骨髓增生异常综合征(MDS)是一组以血细胞质、量异常和高风险发展为急性白血病为特征的恶性克隆性造血干细胞疾病。本病具有高度的异质性,其发病与多种机制有关。近年研究发现,免疫因素等介导的凋亡过度在MDS的发生和发展中起重要作用,使用免疫抑制剂如环孢素A(CsA)等治疗低危MDS可取得一定的血液学反应[1-2];组蛋白去乙酰化酶抑制剂(HDACI)可通过诱导细胞周期停滞、细胞凋亡抑制多种肿瘤细胞的生长增殖[3-5],它的应用标志着一种全新的肿瘤治疗途径。丙戊酸(valproic acid,VPA)属于短链脂肪酸家族,具有组蛋白去乙酰化酶抑制活性,可以抑制肿瘤细胞生长,具有诱导分化及凋亡作用[6-7]。笔者采用丙戊酸联合环孢素A治疗低危MDS,对其疗效与不良反应进行了初步探讨,现报道如下。
1 资料与方法
1.1 临床资料 选取我院2005年1月~2009年6月住院及门诊诊断为低危MDS患者共28例,随机分为A、B两组。即丙戊酸联合环孢素A治疗组和单用环孢素A治疗组。全部符合WHO分型诊断标准,纳入病例均为:(1)骨髓原始粒细胞比例<10%。(2)2个月之内未用促红细胞生成素(EPO)或粒细胞集落刺激因子(G—CSF)以及强烈化疗。(3)体力状态符合东部肿瘤协作组(ECOG)评估标准0~2级。(4)肾功能正常,无周围神经病变及血栓病史。(5)绝经前的女性要求妊娠试验阴性,并采取良好的避孕措施。A组14例,男8例,女6例,年龄32~68岁,中位年龄51岁,RCMD6例,RCMD-RS5例,RAEBI2例,5q-1例;B组14例,男8例,女6例,年龄34~69岁,中位年龄52岁,RCMD7例,RCMD-RS4例,RAEB-I2例,5q-1例。两组患者骨髓增生程度均为活跃以上。治疗前两组间年龄、性别及临床情况无差异,两组患者法英美(FAB)及WHO诊断分型,染色体核型分析,IPSS积分的构成亦无差异(P>0.05)。
1.2 治疗方案 纳入研究的28例患者均接受康力龙(2mg,tid,po)基础治疗。A组:在基础治疗上加用丙戊酸和环孢素A治疗,丙戊酸钠(0.2g,tid,po)。坚持服用3~6个月;CsA起始剂量3mg/(kg·d),口服。B组:在基础治疗上只加用CsA治疗,剂量同治疗组。两组患者在治疗期间有感染者,给予抗生素治疗,血红蛋白小于60g/L,予输注浓缩红细胞,有出血倾向或血小板小于20×109/L,给予输注单采血小板10U等处理措施的基础上。
1.3 观察指标及疗效判定标准 所有患者治疗前完成下列检查以进行基线评估和计算MDS国际预后积分系统(IPSS)积分:血细胞计数及分类,骨髓穿刺涂片及分类计数,骨髓涂片,骨髓细胞免疫表型分析,骨髓活组织检查,染色体核型分析,心、肝、肾功能检查。治疗后患者在前8周每周至少检查1次血细胞计数及分类,并监测肝、肾等脏器功能。
疗效评定参考MDS国际工作组标准,将疗效分为完全缓解(CR)、部分缓解(PR)、血液学改善(HI)和无效(NR),其中CR、PR、HI均被视为有效。CR条件为Hb>110g/L,中性粒细胞绝对计数(ANC)≥1.5×109/L和血小板≥100×109/L持续至少8周,且无病态造血。PR条件为骨髓仍有病态造血,其余条件符合CR。HI条件为:红系,治疗前Hb<110g/L,未输血情况下Hb至少上升20g/L或红细胞输注减少100%为显效(MaR),Hb上升10~20g/L或红细胞输注减少≥50%为微效(MR),未达到MR为无效(NR);对于血小板,治疗前<100×109/L者,治疗后绝对值增加≥30×109/L为MaR,增加>10×109/L而<30×109/L为MR;对于粒细胞,治疗前ANC<1.5×109/L者,如ANC增加≥100%或净增≥0.5×109/L为MaR,净增<0.5×109/L为MR。1系达MR即为HI。完成治疗8周进行评价,若未达到血液学进步则延续到12周进行评价,各系有效率为各系显效与有效之和。不良反应分级根据美国国立肿瘤研究所常见毒性标准进行评判。
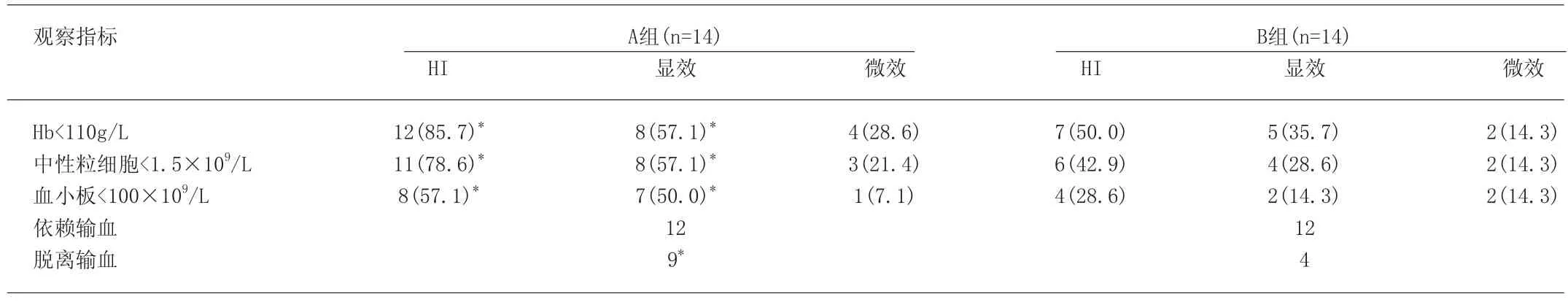
表1 两组患者临床疗效比较[例(%)]
1.4 统计学方法 用SPSS10.0统计软件包进行分析。率的比较采用x2检验,计量数据用中位数和范围表示,组间比较采用Mann-Whitney U检验进行统计分析。
2 结果
2.1 临床疗效 28例患者治疗前Hb均<110g/L,治疗后A组HI-E、HI-N、HI-P均明显高于B组,差异有显著性(P<0.05)(表1)。A、B组均无CR病例,PR病例A组12例(85.7%),B组6例(42.9%),有显著性差异(P<0.01),2例5q-患者均获得PR。在依赖的输血患者中,脱离输血者A组明显高于B组,差异有显著性(P<0.05)。见表1。
2.2 不良反应 7例患者在治疗中出现肝损害,A组4例(28.6%),B组3例(21.4%),差异无显著性(P>0.05),患者经保护肝治疗后均好转,无需停药。3例出现肾损害,A组2例(14.3%),B组1例(7.1%),差异无显著性(P>0.05)。停药或治疗后均好转。A组患者4例还出现与丙戊酸相关的不良反应,如嗜睡、恶心、腹胀,坚持服用1周后均渐耐受。
3 讨论
现有的研究表明,骨髓微环境中免疫异常介导的免疫损伤导致造血细胞过度凋亡在低危MDS发病中起主要作用。MDS发病早期可能是由于不同发病途径触发了共同的病理生理改变,即BM骨髓微环境中免疫异常介导的免疫损伤。这种由T、B和基质细胞及多种细胞因子参与的免疫损伤导致造血细胞过度凋亡,抑制这种免疫损伤可使MDS病情改善,提倡对低危MDS患者及早进行治疗干预,是提高免疫抑制治疗效果、延缓病情进展、延长治疗有效患者生存期的关键[8]。CsA是目前临床常应用的免疫抑制剂,它可通过阻止T细胞激活及TNF、IFN-γ等造血负调控因子介导的细胞凋亡发挥免疫抑制作用,体外实验显示CsA对MDS患者的CFU-GM、CFU-E有明显促增殖效应。1998年Jonasova等首先报道使用CsA治疗16例RA患者获血液学改善,随后日本、美国有研究报道应用CsA治疗MDS,血液学改善在60%~80%左右[2,9-10],并能提高患者生存率。
近几年研究发现,恶性肿瘤的发病机制除了原癌基因的激活及抑癌基因的失活外,尚存在着DNA甲基化及组蛋白去乙酰化等非遗传性改变,由此产生的基因沉默在恶性肿瘤的发生、发展中具有至关重要的作用[11]。组蛋白去乙酰化酶抑制剂(HDACI)可通过诱导细胞周期停滞、细胞凋亡抑制多种肿瘤细胞的生长增殖。VPA具有组蛋白去乙酰化酶抑制活性,通过G0/G1期阻滞,诱导MUTZ-1细胞凋亡,从而抑制MUTZ-1细胞增殖。对肿瘤细胞有选择性细胞毒性,而对正常造血细胞无严重毒性,且与多种化疗药物有协同作用[7,12]。
基于MDS具有高度的异质性,其发病与多种机制有关,本研究采用丙戊酸联合环孢素A治疗低危MDS,治疗后HI-E、HI-N、HI-P、PR病例、在依赖的输血患者中脱离输血者均明显高于单用环孢素A治疗组,差异有显著性(P<0.05)。患者血液学指标得以改善,可以摆脱对血液制品的依赖,且患者无严重毒副反应,对治疗的耐受性良好,提示VPA联合CsA方案可作为低危MDS的治疗选择。
[1]Shimamoto T,Tohyama K,Okamoto T,et al.Cyelosporin a therapy for patients with myelod ysplastie syndrome:multicenter pilot studies in Japan[J],Leuk Res,2003,27(9):783-788.
[2]管梅.环孢索A在骨髓增生异常综合征中的应用[J].中国实验血液学杂志,2003,11(6):678-680.
[3]Takai N,Desmond JC,Kumagai T,et a1.Histone deacetylase inhibitors have a profound antigrowth activity in endometrial cancer cells[J].Clin Cancer Res,2004,10(3):1141-1149.
[4]Li XN,Shu Q,Su JM,et a1.Valproic acid induces growth arrest,apoptosis,and senescence in medulloblastomas by increasing histone hyperacetylation and regulating expression of p21 Cipl,CDK4,and CMYC[J].Mol Cancer Ther,2005,4(12):1912-1922.
[5]薛红漫,李文益,郭海霞,等.丙戊酸诱导白血病细胞凋亡机理的实验研究[J].中华儿科杂志,2005,43(12):894-898.
[6]张青宜,闰轶鹏,贺立山,等.丙戊酸治疗骨髓增生异常综合征13例疗效观察[J].医学新知杂志,2008,18(6):339-341.
[7]赵慧慧,陈宝安,高冲,等.丙戊酸钠诱导骨髓增生异常综合征细胞株MUTZ-1凋亡的实验研究[J].中国实验血液学杂志,2007,15(4):743-747.
[8]葛祥花.沙利度胺联合环孢素A治疗骨髓增生异常综合征的临床研究[J].临床血液学杂志,2009,22(5):256-258.
[9]Shimamoto T,Tohyama K,Okamoto T,et a1.Cyelosporin a therapy for patients with myelod ysplastie syndrome:multicenter pilot studies in Japan[J].LeukRes,2003,27(9):783-788.
[10]陈书长.低危MDS的治疗进展[J].癌症进展杂志,2005,3(3):282-286.
[11]Claus R,Lubbert M.Epigenetic targets in hematopoletic malignancies[J].Oncogene,2003,22(42):6489-6496.
[12]Tang R,Faussat AM,Majdak P,et a1.Valproic acid inhibits proliferation and induces apoptosis in acute myeloid leukemia cells expressing P-gP and MRP1[J].Leukemia,2004,18(7):1246-1251.