自发性2型糖尿病大鼠腹主动脉SIRT1的表达及二甲双胍的干预研究
2010-03-08杨菊红赵荣兰梁东春
朱 玉,杨菊红,王 楠,李 冰,王 巍,赵荣兰,梁东春,冯 凭
(1.天津医科大学总医院代谢病科,天津 300052;2.天津内分泌研究所)
目前,在世界范围内糖尿病的发病呈流行趋势,成为严重威胁人类健康的全球性公共健康问题。糖尿病动脉粥样硬化是糖尿病患者的主要伴发病和首要死亡原因,深入研究其发生发展机制并予以积极的治疗成为目前医学界迫切需要解决的问题[1]。组蛋白去乙酰化酶(SIRT)1是近年发现的与衰老、糖尿病、动脉粥样硬化密切相关的核蛋白,最近的研究还发现其在维持血管正常功能中具有重要的作用。本研究以自发性2型糖尿病模型——OLETF大鼠及其同系非糖尿病LETO对照大鼠为研究对象,观察两者腹主动脉SIRT1的表达情况,以探讨SIRT1在糖尿病动脉粥样硬化发生发展中的可能作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 自发性2型糖尿病大鼠模型OLETF鼠和其同系非糖尿病对照鼠LETO鼠由日本大冢制药株式会社德岛研究所引进。大鼠皆为雄性,OLETF 30只,4周龄,至30周时,共有成模OLETF鼠20只。LETO大鼠10只为正常对照组。
大鼠在无特定病原体级(SPF级,specific pathogen-free)条件下单笼饲养,饲以标准饲料。环境温度控制在22~25℃,湿度为(55±5)%,12/12h光照黑暗循环(光照时间7:00-19:00),自由获取食物和饮水。
1.1.2 药品、试剂及仪器 国产分析纯,灭菌分装,室温保存;TRIZOL试剂(美国Invitrogen公司);焦碳酸二乙酯(DEPC)(美国Fermentas公司);逆转录试剂盒(美国 Invitrogen公司);TaqDNA聚合酶、dNTPs、SYBR®Green PCR试剂盒(大连宝生物工程有限公司);DNA凝胶回收试剂盒(北京鼎国生物技术公司);盐酸二甲双胍片(天津太平洋制药有限公司,常温保存,临用前蒸馏水稀释);Authorized Thermal Cycler PCR扩增仪(英国Hybaid公司);DNA Thermal Cycler 480扩增仪(美国Perkin Elmer Cetus公司);PTC-200梯度PCR仪(美国MJ Research公司);DH-2000凝胶图像采集分析系统、SORVALL® LEGEND RT台式冷冻离心机(德国Heraeus公司);紫外透射仪(瑞典LKB公司);Bio Photometer分光光度计(德国Eppendorf公司);Real-timePCR仪Light Cycler(瑞士Roche公司);电泳仪(大连竞迈公司);德国内卡BIOSEN5030快速葡萄糖分析仪;日立-7150全自动生化分析仪。
1.2 实验方法
1.2.1 大鼠42周行口服葡萄糖耐量实验(OGTT)[2]。
1.2.2 动物分组及药物处理 实验期间取血意外死亡动物5只,其中OLETF 3只,LETO 2只。OLETF鼠17只,随机分为模型组、二甲双胍组,LETO鼠8只为空白对照组。治疗组大鼠,每日以二甲双胍溶液(临用前搅拌至完全溶解,以蒸馏水稀释)3mg/kg体重灌胃,其余大鼠均以同体积的蒸馏水灌胃,每日1次,共12周。
1.2.3 样本取材 各组禁食14h,2%戊巴比妥钠腹腔注射麻醉(40mg/kg),处死大鼠,迅速取出腹主动脉,小心去除外膜结缔组织,置于冻存管中,于液氮罐中速冻2h,-80℃低温冰箱保存。
1.2.4 基因的REAL-TIME PCR产物定量测定 取-80℃冰箱冰冻保存标本约50~100mg,浸泡于1ml TRizol中,匀浆30s后,移入1.5ml Eppendorf管中,-20℃静置5min;按每1ml TRizol加入氯仿0.2ml,盖紧管盖,翻转充分混匀,-20℃静置15min;12000r/min,4℃离心15min;小心吸取上层水相于新的1.5ml Eppendorf管中,加入等体积异丙醇,充分混匀冰上30min;12000r/min,4℃离心10min;吸弃上清,加入冰预冷的75%乙醇(DEPC处理过的水配置)1ml,轻轻吹打彻底漂洗,7500r/min,4℃离心5min;吸弃上清,沉淀于超净工作台内室温干燥。30μl DEPC处理过的双蒸水溶解RNA,55~60℃水浴中助溶(<10min),鉴定总RNA浓度、纯度和完整性。2μg总RNA于20μl反应体系逆转合成cDNA第一链,然后以此为模板进行实时荧光定量PCR扩增。上游引物5′-TTTCAGAACCACCAAAGCG-3′;下游引物5′-TCCCACAGGAAACA GAAACC-3′。扩增条件为:95℃预变性30s;95℃5s、58℃20s、72℃6s,进行50个循环。温度变化速度为20℃/s,在每个循环的延伸末检测荧光信号。随后是一个缓慢升温的程序,循环参数:95℃0s,65℃15s,95℃0s,温度变化速度为0.1℃/s。将PCR产物进行2%琼脂糖凝胶电泳,以核酸分子量标志物DL-2000为参照,估算扩增产物大小,同时进行序列测定,由北京奥科生物技术有限责任公司完成。
1.3 统计学处理 采用SPSS16.0统计软件进行数据处理,所有数据均用±s表示,多组比较采用单因素方差分析,两两比较用Student-Newman-Keuls检验。P<0.05表示差异有统计学意义。
2 结果
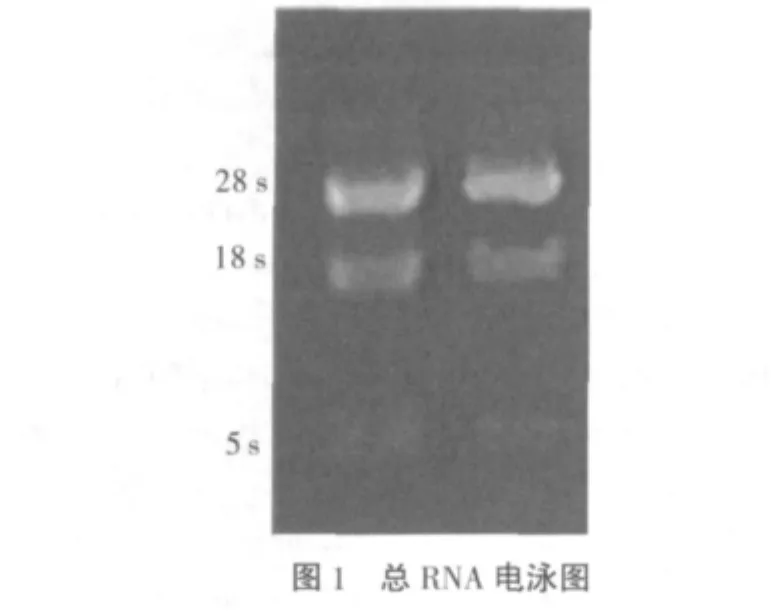
2.1 大鼠腹主动脉中总RNA的提取 提取组织总RNA在分光光度计上检测,其OD260/OD280均介于1.7~2.0之间,OD260/OD 230介于1.5~1.9之间,说明总RNA纯度较好,基本去除了DNA、蛋白质和糖类等其它大分子物质的污染。总RNA在1%甲醛变性琼脂糖凝胶电泳,均可以看到清晰的18s与28s两个条带的光密度比值约为2,说明提取的总RNA的完整性较好,基本无降解(图1)。
2.2 大鼠腹主动脉SIRT1mRNA REAL-TIME PCR实验结果
2.2.1 1.5%琼脂糖凝胶电泳结果 SIRT1、GAPDH 2.0%琼脂糖凝胶电泳鉴定,可见经PCR扩增的DNA分子量大小为126bp及130bp左右的目的条带(图2)。

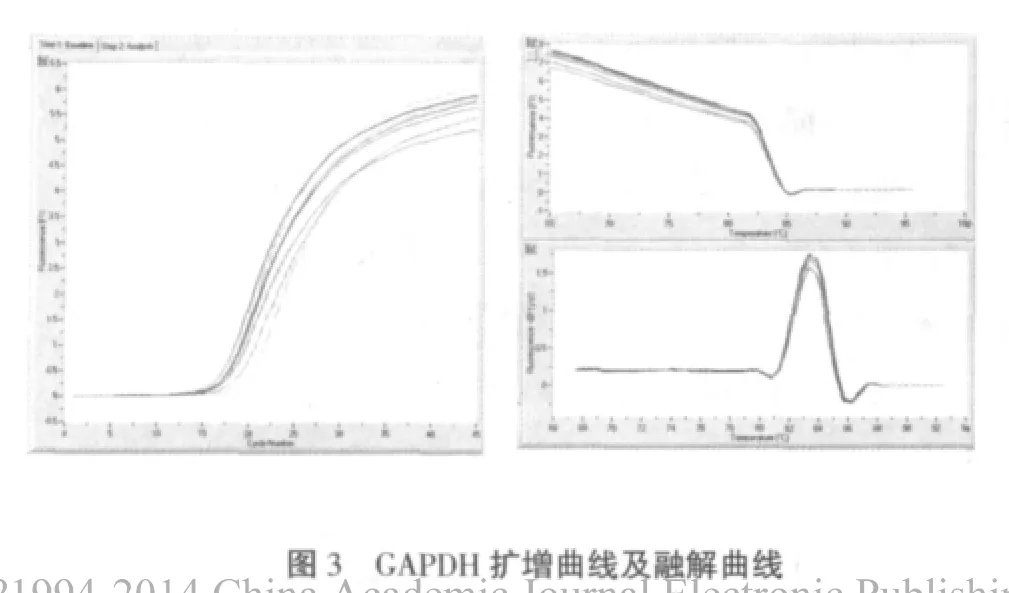
2.2.2 SIRT1、GAPDH扩增曲线及融解曲线 Realtime PCR产物经95℃0s,65℃15s,95℃0s(温度转换速率是0.1℃/s)进行融解曲线分析。不同浓度标准点和大鼠腹主动脉SIRT1扩增产物的融解温度为86℃,GAPDH扩增产物的融解温度为83℃。没有明显的引物二聚体和非特异峰出现,说明扩增产物具有特异性(图3、4)。

2.2.3 不同组大鼠主动脉SIRT1mRNA的表达 模型组SIRT1mRNA表达较对照组明显降低(P<0.05),使用二甲双胍治疗12周后SIRT1mRNA的表达较模型组明显升高(P<0.05),见表1。

表1 大鼠主动脉SIRT1mRNA的表达
3 讨论
SIRT1是一种NAD+依赖的组蛋白去乙酰基蛋白酶,参与应激状态如空腹、饥饿时机体的适应性代谢调节作用[3]。近期,Milne等[4]发现SIRT1激动剂可改善肥胖糖尿病大鼠的胰岛素敏感性,降低血糖,认为SIRT1将是2型糖尿病一条新的有希望的治疗靶点。进一步的研究发现,SIRT1在血管内皮的正常功能中具有重要作用[5-6]。而且在后续的研究中人们发现,血管内皮特异性高表达SIRT1可以阻止apoE敲除小鼠动脉粥样硬化的发生,并发现该功能与SIRT1促进内皮细胞的存活及功能的改善有关[7]。
本研究选取与人2型糖尿病发病过程相似的自发性2型糖尿病OLETF大鼠为模型进行了研究,发现相对于正常同系LETO大鼠,糖尿病大鼠腹主动脉SIRT1的表达明显下降(P<0.05),提示SIRT1的表达下降可能与糖尿病大血管病变相关。SIRT1下降如何参与了糖尿病大血管病变机制不明。意大利学者Cardellini等[8]最近发表的研究对60名2型糖尿病患者的颈动脉斑块进行分析,发现其TIMP-3的水平明显下降,且与SIRT1的表达下降明显相关。由于TIMP-3是抑制细胞外基质合成的蛋白酶,因此SIRT1的表达下降可能使TIMP-3的表达下降而参与了糖尿病大血管病变的发生。还有研究发现,高糖环境下内皮细胞SIRT1的表达降低可能使其对p53表达的抑制作用降低,因而使细胞寿命缩短,从而促进了糖尿病血管病变的发生[9]。
我们的研究同时发现二甲双胍干预组腹主动脉SIRT1的表达较模型组有明显增加(P<0.05)。二甲双胍改善SIRT1表达的机制不明,可能是大鼠血糖降低的间接作用。当然也可能是二甲双胍降糖以外的直接作用。众所周知,二甲双胍是通过激活AMPK而改善糖尿病患者的血糖的。AMPK是机体能量状态的感受器,可以感知细胞ATP/AMP水平的变化,从而使细胞由合成代谢向分解代谢间转换,以维持细胞的能量平衡。最新在《Nature》中发表的研究发现,AMPK还可同时激活另一个能量感受器——SIRT1,后者能进一步去乙酰化FOXO1、FOXO3a以及PPAR-γ等转录因子,进一步调节机体的能量代谢[10]。
总之,本研究提示SIRT1表达降低可能参与了2型糖尿病动脉粥样硬化的发生、发展,SIRT1在糖尿病动脉粥样硬化中具有潜在治疗价值。
[1] Muniyappa R,Montagnani M,Koh KK,et al.Cardiovascular actions of insulin[J].Endocr Rev,2007,28(5):463
[2] Mori S,Kawano K,Hirashima T,et al.Relationships between diet control and the development of spontaneous type 2diabetes and diabetic nephropathy in OLETF rats[J].Diabetic Res Clin Prac,1996, 33(3):145
[3] Cohen HY,Miller C,Bitterman KJ,et al.Calorie restriction promotes mammalian cell survival by inducing the SIRT1deacetylase [J].Science,2004,16(305):390
[4] Milne JC,Lambert PD,Schenk S,et al.Small molecule activators of SIRT1as therapeutics for the treatment of type 2diabetes[J].Nature,2007,450(7170):712
[5] Mattagajasingh I,Kim CS,Naqvi A,et al.SIRT1promotes endothelium-dependent vascular relaxation by activating endothelial nitric oxide synthase[J].Proc Natl Acad Sci USA,2007,104(37):14855
[6] Ota H,Akishita M,Eto M,et al.Sirt1modulates premature senescence-like phenotype in human endothelial cells[J].J Mol Cell Cardiol,2007,43(5):571
[7] Zhang QJ,Wang Z,Chen HZ,et al.Endothelium-specific overexpression of class III deacetylase SIRT1decreases atherosclerosis in apolipoprotein E-deficient mice[J].Cardiovasc Res,2008,80(2):191
[8] Cardellini M,Menghini R,Martelli E,et al.TIMP3is reduced in atherosclerotic plaques from subjects with type 2diabetes and increased by SirT1[J].Diabetes,2009,58(10):2396
[9] Orimo M,Minamino T,Miyauchi H,et al.Protective role of SIRT1in diabetic vascular dysfunction[J].Arterioscler Thromb Vasc Biol,2009,29(6):889
[10]Cantó C,Gerhart-Hines Z,Feige JN,et al.AMPK regulates energy expenditure by modulating NAD+metabolism and SIRT1activity [J].Nature,2009,458(7241):1056
