唐山地区致鸡肝炎大肠埃希菌分离鉴定及药物筛选试验*
2010-03-07石玉祥张志勇支龙彬赵淑会钟翠红
石玉祥,张志勇,支龙彬,李 存,赵淑会,钟翠红
(1.河北工程大学,河北邯郸056038;2.河北省丰润区畜牧水产局,河北唐山064004;3.河北定州市畜牧水产局,河北定州037000)
国内外的研究表明,鸡源性大肠埃希菌的耐药性复杂,各地的耐药性差异大,各地报道的敏感药物都有所不同;各地不同时间分离的菌株的耐药也有较大差异,且耐药性变化快,鸡源性肠杆菌的防治效果不仅对养禽业具有重要意义,而且对人类致病性细菌的研究也有重要意义[1-2]。本试验针唐山地区鸡源性肠杆菌耐药性,利用人工感染大肠埃希菌的鸡进行药物筛选试验,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 兔,购于邯郸市种兔场;小鼠,购于河北医科大学。
1.1.2 培养基配制 高盐甘露醇培养基按《禽传染病试验诊断技术》配制[3];普通肉汤、斜面培养基、血液琼脂平板、营养琼脂、麦康凯、伊红美蓝、三糖铁培养基均按其使用说明进行配制。
1.1.3 药敏片 阿莫西林、阿奇霉素、黄连素、头孢拉啶、利福平药敏片按《禽传染病试验诊断技术》制备[3]。
1.1.4 大肠埃希菌标准抗O血清 购于中国兽医药品监察所;肠杆菌科细菌生化常规微量发酵管:购于浙江省军区后勤部卫生防疫检验所。
2 方法
2.1 致鸡肝炎大肠埃希菌分离鉴定
2.1.1 病料采集 从河北某地区规模化养鸡场,无菌采取疑是大肠埃希菌病病鸡肝脏,置冰箱中冻藏备用。
2.1.2 细菌培养 首先用肝脏触片检查细菌形态,然后从肝脏钓取细菌,接种到营养琼脂平板培养基,置于37℃恒温培养箱中,培养24 h,观察其培养特性;同时挑取所培养圆形凸起、光滑、湿润、边缘整齐、半透明、灰白色菌落的细菌进行涂片,经革兰染色法染色,镜检,做形态学观察。
2.1.3 细菌分离、纯化培养 将营养琼脂所培养的上述细菌接种于高盐甘露醇、伊红美蓝、麦康凯培养基中,培养24 h;再挑取选择培养基上特征性的细菌菌落进行镜检,然后分别接种于三糖铁和营养琼脂斜面培养基中,培养24h;再挑取培养物中的菌落进行镜检,将不纯的细菌培养物再次进行纯培养,直至得到纯培养物。
2.1.4 生化试验 将大肠埃希菌培养物分别接种至含有葡萄糖、蔗糖、乳糖、麦芽糖、甘露醇、靛基质、柠檬酸盐、尿素酶生化常规微量发酵管中及糖蛋白胨水溶液后,置于37℃恒温培养箱中,培养2 d~3 d,观察各个发酵管中有何变化。
2.2 大肠埃希菌的致病性测定
按兰罗勋介绍的方法[4]检大肠埃希菌测是否有致病性。
2.3 药敏试验
按常规纸片法[5]对致鸡肝炎大肠埃希菌和鸡舍空气致病性大肠埃希菌进行药敏试验,置37℃温箱中培养24 h后,观察试验结果。结果判定标准:根据抑菌圈直径大小作为判定敏感性的标准:15 mm以上判为高度敏感;10 mm~14 mm判为中度敏感;10 mm以下判为低度敏感。然后与同地区鸡舍空气分离出的大肠埃希菌耐药程度进行比较。
2.4 联合用药试验
2.4.1 体外抑菌试验 按傅先强介绍制备药敏条的方法制作药敏条和进行药敏试验及结果判定[6]。
2.4.2 联合用药对肉雏鸡大肠埃希菌病的防治随机选择1日龄健康肉用仔鸡400只,按常规方法饲养管理,常规疫苗免疫接种。随机分为8组,每组50只。其中预防组1个,治疗组3个,对照组4个。
2.4.2.1 预防试验 预防组按常规饲养7后,配制致病性大肠埃希菌菌液,100 mL水加致病性菌液5 mL(含菌量为108/mL)让雏鸡饮用3 d[7]。3 d后,雏鸡按15 mg/L浓度饮新霉素和头孢拉定(4∶1)组成复方制剂,连用3 d,观察21 d,统计死亡数和保护率。对照组按常规方法饲养,并用市场销售的丁胺卡那霉素20 mg/L,连用3 d,观察21 d,统计死亡数和保护率。
2.4.2.2 治疗试验 治疗组为常规饲养至21日龄的雏鸡,每只鸡肌肉注射大肠埃希菌菌液1 mL(含菌量为108/mL)。于攻毒后同时(oh)、24 h、48 h,鸡按30 mg/L浓度饮上述复方制剂,分上、下午2次给药,连续用3 d,观察10 d,统计死亡数和保护率。对照组鸡按40 mg/L浓度饮水丁胺卡那霉素,每天上、下午各一次,连用3 d为一个疗程,观察10 d,统计死亡数和保护率。
判定标准:①痊愈:受试鸡用药3 d后,精神食欲好转,粪便恢复正常,剖检无明显的大肠埃希菌病变者为痊愈。②有效:受试鸡用药1个疗程后,精神食欲好转,粪便有明显转变,且在试验期未死亡者为有效。③无效:受试鸡用药一个疗程后,症状无明显改善,甚至加重或死亡,死亡剖检有明显大肠埃希菌病变特征者为无效[1,8-9]。
3 结果与分析
3.1 肝脏触片镜检
将肝组织触片经革兰染色,镜检可见两端钝圆、粗短的阴性中等大小杆菌。
3.2 分离培养与镜检结果
按无菌要求将病死鸡的病料分别接种于普通琼脂平板、麦康凯平板和伊红美蓝平板上,37℃培养24 h后,观察其结果。在普通琼脂平板上长出中等大小、圆形、隆起、光滑、湿润、半透明带灰色的菌落;在麦康凯平板上长出边缘整齐、稍凸起、表面光滑湿润,直径1.5 mm~2 mm的粉红色菌落;在伊红美蓝平板上长出黑红色带有金属光泽的菌落。将分离的菌落涂片、革兰染色后,镜检可见细菌形态与用肝组织直接涂片的相同,均可看见革兰阴性中等杆菌,以上结果符合大肠埃希菌的特征。
3.3 生化试验结果
本株细菌分离物能发酵葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇;能使葡萄糖、乳糖、麦芽糖产酸产气;靛基质和甲基红产酸;硫化氢试验呈阴性,不能利用枸橼酸盐,不分解尿素。细菌分离物在三糖铁培养基上斜面生化试验结果符合大肠埃希菌的特征。
3.4 动物回归实验结果
6 h~15 h内发现试验组12只小鼠精神萎靡,24小时后试验组12只小鼠全部死亡,对照组正常.对死亡小鼠解剖观察发现心脏出血、淤血,肝、脾出血坏死,肠壁变薄,有出血点。取其病料抹片染色镜检及分离培养,结果从病料中均分离到与感染菌生物学特性相同的细菌。说明分离到的6株大肠埃希菌均为致病性大肠埃希菌,
3.5 药敏试验结果
药敏试验结果见表2和表3。个别菌株表现出相似的药物敏感性,对新霉素、丁胺卡那霉素和阿奇霉素高度敏感;对庆大霉素、氟哌酸、头孢拉定、利福平、阿莫西林中敏或低敏,对羧苄青霉素、黄连素、环丙沙星、先锋V具有耐药性。
3.6 联合用药试验结果
联合用药试验结果见表4。结果显示菌株对两两联合的效果比单个用药时敏感的多。效果最好的组合是头孢拉定与新霉素,头孢拉定与诺氟沙星和阿莫西林与新霉素组合依次次之,菌株对诺氟沙星与黄连素的组合有耐药性,则在临床上应采用头孢拉定与新霉素这两种抗菌药物联合。
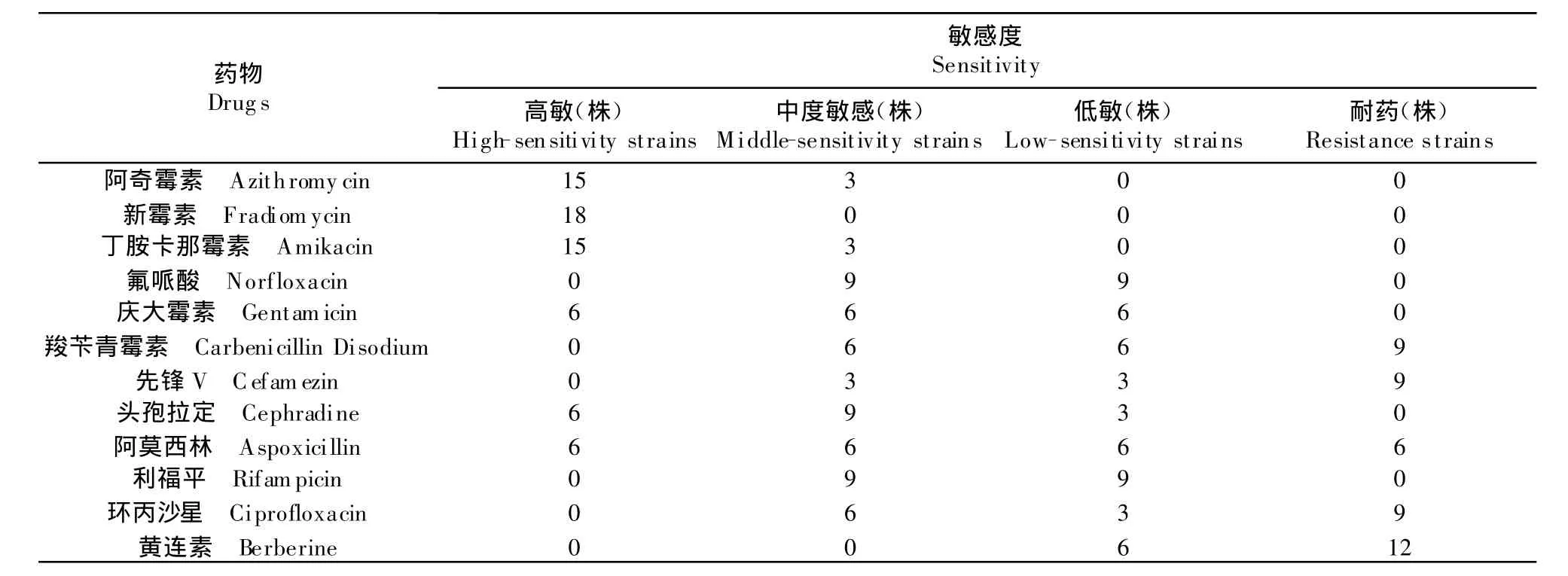
表2 药敏试验结果Table 2 The results of drug sensitive test

表3 多重耐药菌株占分离菌株比例Table 3 The rate of multi-resistant strains on isolated strains
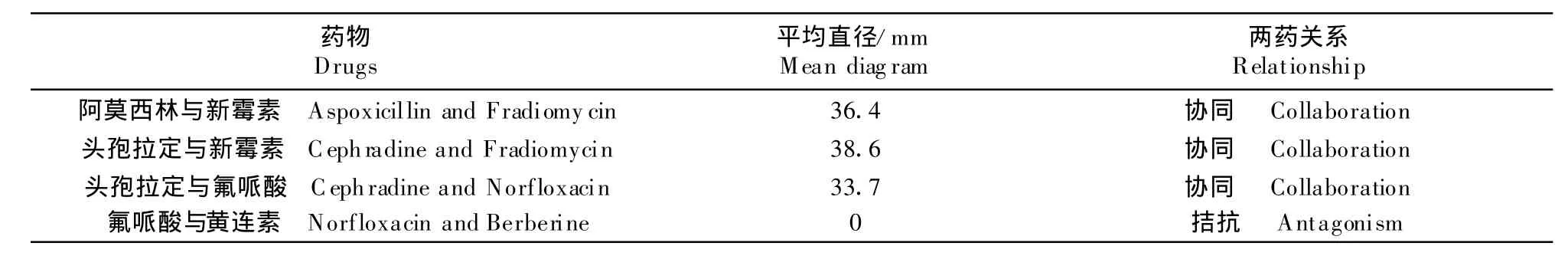
表4 药物联合试验T able 4 The tests of Joint administration
3.7 临床防治效果观察
3.7.1 临床预防试验结果 肉仔鸡预防试验结果见表5。由表5可知,联合用药预防肉用仔鸡大肠埃希菌病,其发病率与病死率均较低(观察10 d),死亡3只(死亡剖检有明显大肠埃希菌病变的2只),死亡率为6%。对照组死亡10只(剖检有明显大肠埃希菌病变的8只),死亡率20%。二组之间的保护率具有显著性差异(P<0.05)。

表5 预防试验结果Table 5 he results of prophylactic trial
3.7.2 临床治疗试验结果 由表6可知,肉用仔鸡在感染大肠埃希菌的不同时期,用药治疗,其结果有很大差异,所以对肉鸡大肠埃希菌病的治疗,应早发现早控制。肉仔鸡在攻毒48 h后,用新霉素和头孢拉丁治疗的效果明显,与对照组相比,二者的保护率具有显著性差异(P<0.05)。

表6 临床治疗试验结果Table 6 The results of clinical trial
4 讨论
由于大肠埃希菌血清型极多,疫苗免疫效果并不理想,药物防治仍是主要手段[10]。近几年,由于长期、广泛、过量、多品种地使用抗菌药物和添加剂,加上大肠埃希菌自身又极易产生耐药性,导致耐药菌株越来越多,多重耐药现象也日趋严重。本试验从唐山地区分离出18株大肠埃希菌,其中12株有多重耐药性。所分离的18株大肠埃希菌菌株对多数氨基糖苷类药物高度敏感,其中硫酸新霉素敏感率最高为100%;对氟哌酸、头孢拉定、利福平、阿莫西林中敏或是低敏,敏感率在83.3%~50.0%;对羧苄青霉素、黄连素、环丙沙星、先锋V具有严重抗药性,敏感率均为50.0%~33.3%。由此看来,所分离的大肠埃希菌对青霉素类药物耐药性较强。
联合用药防治动物疾病时,不仅减少单种兽药的剂量,还克服单种兽药抗菌活性较低的缺点,这对大肠埃希菌病的防治和控制药物残留而提高动物产品质量及避免细菌耐药性的产生均有重要意义。本试验的联合用药试验和临床防治结果表明药物联合应用比单一应用效果更加明显。新霉素和头孢他定拉对大肠埃希菌的抑制作用特别明显。
[1] 陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2007:111-118.
[2] 石玉祥,王绥华,钟翠红,等.鸡舍空气致病菌分离鉴定及其对消毒剂的敏感性观察[J].中国畜牧兽医,2009,30(6):277-282.
[3] 马兴树.禽传染病实验室诊断技术[M].北京:化学工业出版社,2006:290-330.
[4] 兰罗勋,陈红.鸡大肠杆菌病病原的分离及药敏试验[J].湖北畜牧兽医,2007,(2):21-22.
[5] 姚火春.兽医微生物实验指导[M].3版.北京:中国农业出版社,2007(2):21-63.
[6] 傅先强.养禽场禽病检验手册[M].北京:中国农业出版社,1992:43-46.
[7] 戴自英,主编.临床抗菌药物学[M].2版.北京:人民卫生出版社,1995:18-22.
[8] 陆承平.兽医微生物学[M].2版.北京:中国农业出版社,2001:213-218.
[9] 陈杖榴.兽医药理学[M].2版.北京:中国农业出版社,2002:195-248.
[10] 郝智慧,肖希龙,邱 梅,等.不同区域鸡大肠杆菌对抗菌药的耐药性比较[J].中国兽医科学,2009,39(01):84-88.
