缓释胸腺五肽微球的制备及质量评价研究
2010-02-23宋宏新张凤龙赵金礼
裴 斐, 宋宏新, 张凤龙, 赵金礼
(1.陕西科技大学生命科学与工程学院, 陕西 西安 710021; 2.陕西九州生物科技股份有限公司, 陕西 西安 710075)
0 引言
胸腺五肽(thymopentin,TP-5)是胸腺生成素Ⅱ的第32~36位的多肽片断(Arg-Lys-Asp-Val-Tyr),为胸腺生成素Ⅱ的免疫活性中心,能提高T细胞的免疫能力,并可双向调节机体失衡的免疫功能,具有独特的生物学作用,主要用于各种原发性或继发性免疫缺陷(损)、自身免疫病以及抗肿瘤和抗感染性疾病的免疫治疗,临床上常用的剂型为注射用冻干粉针剂.但是,作为肽类药物,胸腺五肽在人血浆中很快由蛋白酶和氨肽酶降解为氨基酸,半衰期约为30 s[1].本研究选用生物相容性好且体内可降解的药用聚乳酸-羟基乙酸共聚物(PLGA)为囊材,胸腺五肽为模型药物制备了胸腺五肽PLGA微球,并对微球的粒径分布、药物载药量、包封率及体外释药特性进行了研究,为开发胸腺五肽微球长效注射剂奠定了初步基础.
1 材料
1.1 仪器
超声波细胞粉碎机(宁波科生仪器厂,KS-150);冷冻干燥机(北京博医康实验仪器有限公司,DZF-6020型);精密电子天平(瑞士梅特勒,AC135);磁力搅拌器(上海浦东物理光学仪器厂,85-1);光学显微镜(南京江南光电股份有限公司,XS-212);液相色谱系统(包括1525梯度泵、2996PDA紫外检测器、EMPOWER色谱工作站,美国Waters公司).
1.2 试药
胸腺五肽(陕安九州生物科技股份有限公司合成,批号:20091126,纯度>99%),聚乳酸-羟基乙酸共聚物(山东省医疗器械研究所,Mr=15 000,LA∶GA=50∶50),聚乙烯醇(天津市科密欧化学试剂有限公司),所用其他试剂均为市售色谱纯或分析纯产品.
2 方法
2.1 胸腺五肽微球的制备
采用复乳-溶剂挥发法制备胸腺五肽微球[3].将40 mg胸腺五肽溶解于400 μL明胶水溶液作为内水相,PLGA溶解于3 mL二氯甲烷作为油相,两者在90 W功率下超声乳化10 s得W1/O初乳,在磁力搅拌机搅拌条件下将初乳倒入50 mL含0.5%甲基纤维素(MC)的一定浓度的聚乙烯醇(PVA)水溶液中,经高速搅拌2 min得到W1/O/W2复乳,两者在室温条件下(25 ℃)继续缓慢搅拌3 h,挥发二氯甲烷并固化微球,离心、水洗后用10 mL 5%的甘露醇溶液将微球分散,冷冻干燥48 h得到胸腺五肽微球.

表1 正交试验因素水平表
影响复乳-溶剂挥发法制备微球质量的因素很多,在预实验基础上确定出对胸腺五肽微球的制备和性质影响较显著的3个因素,即明胶浓度(A),PLGA浓度(B),PVA浓度(C),单因素确定每一因素的3个水平(浓度),按L9(34)正交表设计实验,正交试验因素水平表见表1.考察每组实验的包封率(Encapsulation efficiency)和载药量(Drug loading),以包封率为重点优选最佳工艺条件,并按正交试验结果得出的最优制备工艺条件重复试验3次,考察微球制备工艺的重现性.
2.2 微球的形态观察、粒子直径大小及分布测定
取制好的微球用水混悬后,置于载玻片上,用显微镜观察粒子的形态,并用显微镜测微尺测定粒子直径大小及分布.
3 微球载药量、包封率的测定
3.1 胸腺五肽色谱测定
色谱条件:色谱柱:Kromasil C18,5 μm,250×4.60 mm,柱温:25 ℃,检测波长:215 nm,流动相:15%乙腈(含0.1%三氟乙酸),流速:1.0 mL/min,进样量:20 μL.
配制胸腺五肽质量浓度为50 mg/L、100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L的标准溶液,采用HPLC法测定,计算得胸腺五肽质量浓度(C)和峰面积(A)的线性回归方程:A=1 437.2C-6 159.6(R=0.999 8,n=6).
3.2 微球载药量、包封率的测定
10 mg微球加入200 μL二氯甲烷溶解,再加入800 μL 蒸馏水,充分振荡后以10 000 r/min离心10 min,取上层清液作为样品溶液,膜过滤后按照3.1条件采用HPLC测定胸腺五肽含量,将测量结果代入微球载药量、包封率的公式进行计算:

3.3 胸腺五肽微球的体外释放试验
体外释放采用动态透析法[4].将冻干胸腺五肽微球100 mg用0.05 mol/L的PBS缓冲液(pH=7.4)5 mL溶散,转移到经蒸馏水浸泡过夜的透析袋(MwCO=3 500)中,将透析袋两头扎紧,置于盛有45 mL上述PBS缓冲液的烧杯中于37 ℃恒温摇床培养(速度50 r/min),定时从透出液中取样0.5 mL,同时补充等量的释放介质.透出液中的胸腺五肽含量按照3.1条件测定,根据已知微球载药量及胸腺五肽的释放量计算各时间点的累积释药百分率,绘制微球的体外累积释药曲线.

表2 正交试验结果
4 结果与讨论
4.1 处方优化实验方案及结果
制备胸腺五肽微球的正交试验结果见表2.结果显示PVA浓度(因素C)对微球的包封率影响最大,其次为明胶浓度(因素A),PLGA浓度(因素B)影响最小,最佳微球制备工艺为A2B1C1(即明胶浓度10%,PLGA浓度15%,PVA浓度1%),其包封率为52.0%,载药量为1.53%.

表3 三批胸腺五肽微球的平均粒径、载药量与包封率测定结果
4.2 胸腺五肽微球制备工艺的重现性
按照优化后的处方和工艺条件制备3批胸腺五肽微球,平均粒径、载药量和包封率的测定结果见表3,其显微镜下的照片见图1.微球平均粒径为(28.47±0.56) μm,微球表面光滑圆整,球体均匀度较好.
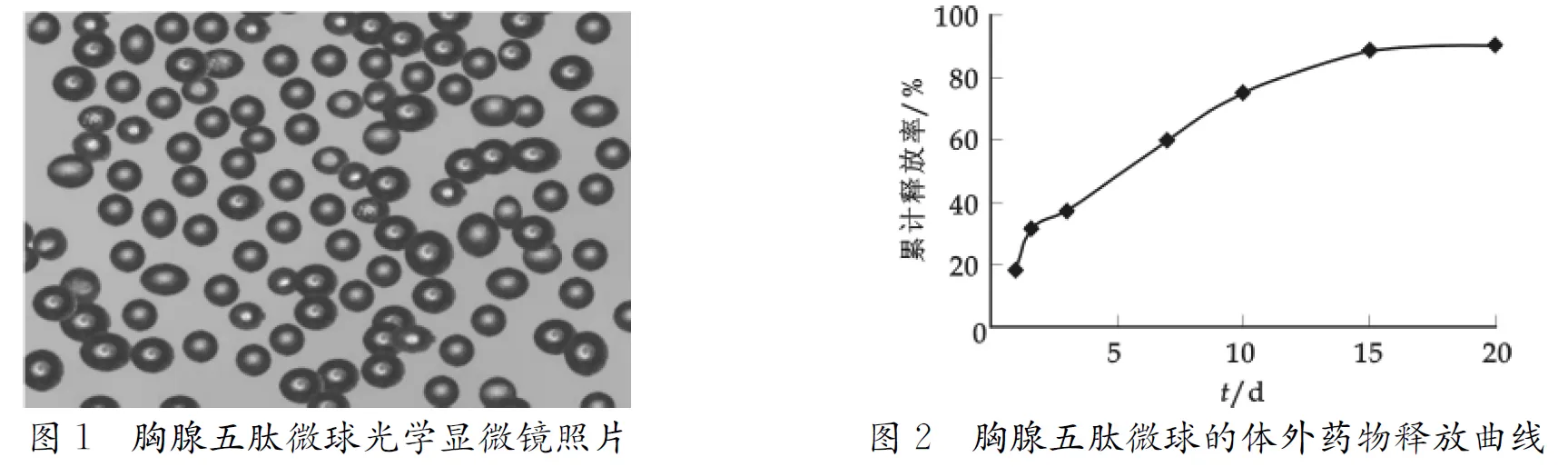
4.3 胸腺五肽微球的体外释药性能
由优化工艺制备的微球的体外药物释放曲线见图2.由图2可看出制备的胸腺五肽微球具有明显的缓释作用,首日突释小于20%,其后药物释放速度比较稳定,20 d的累计释放在90%以上.
由于胸腺五肽的水溶性很强,若以溶剂挥发法制备微球,直接将胸腺五肽与PLGA混悬于有机溶媒,则药物易从内水相渗透到外水相中,导致微球的载药量与包封率不高.本实验采用复乳-溶剂挥发法制备微球,此法在制备工艺过程中对蛋白质、多肽可起到较好的保护作用.实验过程中出现的难点问题是PLGA微球在固化过程中随着二氯甲烷的挥发有机相微滴间因空间排斥力减小而产生聚集.实验分别在外水相中添加十二烷基硫酸钠、甲基纤维素及羟甲基纤维素等多种表面活性剂,结果表明在外水相中添加甲基纤维素可以避免微球聚集,所制备的微球外观形态良好、粒度分布较窄、大小均匀,很好地解决了这一问题.下一步应该深入研究胸腺五肽微球在体内释药的规律和释药动力学,并进一步对微球在体内与体外释药的相关性进行考察和比较药效学研究,以便使其应用于临床.
参考文献
[1] Gonser S,Weber E,Folkers G.Peptides and polypeptides as modulators of the immune response:thym-opentin-an example with unknown mode of action[J].Pharm Acta Helv,1999,73(3):265-273.
[2] 徐希明,张钧寿.微球给药系统的工艺优化研究[J]. 中国现代应用药学杂志,1999, 16(3):1-4.
[3] [英]J.西尼尔,M.拉多米斯基主编,郑俊民等译.可注射缓释制剂[M].北京:化学工业出版社,2005.
[4] 陈建海,罗奇志,李宝红.丝裂霉素-聚氰基丙烯酸丁酯纳米粒制备及体外释药特性[J].中国药学杂志,2005,40(17):1 315-1 317.
