blaTEM-116型超广谱β-内酰胺酶的表达、纯化及其应用
2010-02-09王震郑颖范泉水陈秀枢吕建新
王震,郑颖,范泉水,陈秀枢,吕建新
1 温州医学院检验与生命科学学院 微生态学研究所,温州 325035
2 成都军区军事医学研究所,昆明 650032
超广谱 β-内酰胺酶 (Extended-spectrum βlactamase,ESBL) 是细菌在超广谱β-内酰胺抗生素选择压力下产生的一类耐药酶,能够降解大部分青霉素类、3代以下头孢菌素类的 β-内酰胺抗生素,主要机制是水解该类抗生素母环的酰胺键而导致细菌的耐药性。TEM型ESBL是一种主要的亚群,携带blaTEM,由blaTEM-1或blaTEM-2发生一个或数个位点的突变而形成具有不同底物谱的TEM型ESBL。与TEM-1酶相比,TEM-116 ESBL存在着2个氨基酸位点的突变(Val 84→Ile,Ala 184→Val),使其底物轮廓具备超广谱酶的特征,具有分解绝大部分 β-内酰胺类抗生素的能力[1-2]。自2002年Vignoli等[1]报道自临床样本分离出携带blaTEM-116的Escherichia coli以来,世界各地不断发现产TEM-116 型ESBL的流行株[3]。
β-内酰胺类药物是应用广泛的抗生素,涉及医疗业、制药业、农业及养殖业等领域。因此,在某些特定外环境中存在着大量未经降解的该类抗生素,如制药厂排出的工业发酵废水、病人排泄物和医源性污水、食品制造业的奶制品与肉制品等都可能涉及抗生素污染问题,从而导致耐药菌株的形成与流行。因此,抗生素对环境、食品、医疗场所的污染与耐药菌的传播,以及医院内感染等问题已经引起广泛的关注[4-8]。
本研究采用“逆向思维”的科学方法,把TEM-116 ESBL这种具有超广谱特征的耐药酶开发成具有潜在应用价值的工具酶,用于清除医源性排泄物、药厂工业性发酵废液中的β-内酰胺抗生素,在其经过严格的安全性评价并经监管部门批准的前提下,结合酶固定化技术有望用于清除液态食品中的 β-内酰胺抗生素,并尝试性地将其用于降解体内青霉素G。通过构建高效表达的TEM-116 ESBL原核工程菌,对其发酵、表达及纯化条件进行优化,并对TEM-116 ESBL的酶动力学特性和应用于特定样本的可行性进行较为系统的研究,初步证明其具备工具酶的稳定特征,为进一步推广应用奠定了基础。
1 材料与方法
1.1 菌株和质粒
含pUCm-TEM-116质粒的E. coli DH5α菌株、金黄色葡萄球菌ATCC 25923标准株由温州医学院细胞与分子医学研究所提供;blaTEM-116(AY425988)来自温州医学院附属第一医院微生物科保存的产ESBL的 E. coli临床株;原核表达载体pET-28a及宿主菌E. coli BL21(DE3) 购自美国Novagen 公司。
1.2 酶及主要试剂
限制性内切酶NcoⅠ、XhoⅠ、Taq酶、T4 DNA连接酶、质粒提取试剂盒、胶回收试剂盒购自大连宝生物工程有限公司;Sephacryl S100 (XK 50/100)、Ni2+-NTA琼脂糖 (XK 16/20)、Sephadex G25 (XK 50/100)、DE-52 (XK 26/40) 购自GE Healthcare;戴尔沃 (Delvotest SP) β-内酰胺类抗生素检测试剂盒购自Gist-Brocades;青霉素G (Penicillin G,PG)、氨苄青霉素 (Ampicillin,Amp)、阿莫西林 (Amoxicillin,AMXC)、哌拉西林 (Piperacillin,PIPC)、头孢氨苄(Cephalexin,CEL )、头孢唑林 (Cefazolin,CEZ)、头孢哌酮(Cefoperazone,CPZ)、头孢噻肟 (Cefotaxime,CTX) 等抗生素均购自中国药品生物制品检定所;天然TEM-ESBL酶为自行表达与纯化;青霉素发酵基础培养液按文献[9]方法配制。
1.3 重组质粒的构建和鉴定
将 pUCm-TEM-116和 pET28a质粒分别进行NcoⅠ、XhoⅠ双酶切,将酶切产物回收纯化,用T4 DNA 连接酶于 16℃连接 3 h,然后转化 E. coli BL21(DE3),将转化菌涂布于含30 µg/mL卡那霉素的 LB平板上,37℃培养过夜,挑取单菌落扩大培养,提取质粒NcoⅠ、XhoⅠ双酶切、电泳鉴定,提取的质粒送大连宝生物公司测序。
1.4 blaTEM-116的表达、复性、纯化及理化性质检测
1.4.1 blaTEM-116的表达、复性和纯化
重组菌接种于70 mL LB培养基 (含30 µg/mL卡那霉素) 中,于37℃、150 r/min振荡培养11 h。次日,70 mL种子接种于含7 L的LB培养基 (含30 µg/mL卡那霉素)的发酵罐,发酵罐设置参数为:37℃;溶氧率45%;pH 7.0。当菌体生长至OD600为1.7~1.8时,加入诱导剂IPTG至终浓度为1 mmol/L,待菌体浓度不再升高1 h后,开始撤罐,离心收集菌体。
细菌悬浮于PBS (20 mmol/L,pH 7.4),超声裂解,于4℃、15 000 r/min离心15 min,取沉淀用包涵体洗涤液 (10 mmol/L EDTA,0.5% Triton X 100,pH 8.0)重悬,室温放置5 min,15 000 r/min离心15 min,弃上清,沉淀溶于100 mL包涵体裂解液 (8 mol/L urea,10 mmol/L DTT,pH 7.4),以打开目的蛋白中错配二硫键。室温放置30 min后,用ÄKTA explore蛋白纯化仪纯化,先进行 Ni2+-NTA琼脂糖亲和层析柱(XK16/20)纯化,Binding buffer (5 mmol/L imidazole,0.5 mol/L NaCl,1 mmol/L PMSF,20 mmol/L Tris-HC1,pH 8.0) 为上样缓冲液,每次取10 mL裂解液,以1 mL/min流速缓慢经过Binding buffer平衡后的亲和层析柱,以便目的蛋白充分复性、结合。用 Wash buffer (0.5 mol/L NaCl,60 mmol/L imidazole,20 mmol/L Tris-HCl,pH 7.9) 洗去杂蛋白,再用10 mL Elute buffer (1 mol/L imidazole,0.5 mol/L NaCl,20 mmol/L Tris-HCl,pH 7.9) 洗脱复性目的蛋白,该洗脱液再进行分子筛层析纯化,洗脱液上样于经 10 mmol/L NaH2PO4-Cit缓冲液(pH 6.6) 预平衡的Sephacryl S-100 (XK50/100) 柱,继续用该缓冲液以5 mL/min的速度洗脱,最后目的蛋白收集液以Sephadex G25 (XK50/100) 柱脱盐,收集液冻干、复溶后,进行酶的活性检测、SDS-PAGE电泳及其bandscan V5.0蛋白扫描分析软件分析纯度。
产酶天然菌发酵液加Amp至终浓度30 µg/mL,不加诱导剂,其他发酵条件同重组菌。细菌离心后所得裂解液上清共 100 mL,加硫酸铵至 45%饱和度,静置15 min,15 000 r/min 离心15 min,取上清加硫酸铵至75%饱和度,离心15 min,沉淀重新溶于 100 mL的 10 mmol/L NaCl、10 mmol/L NaH2PO4-Cit (pH 7.0) 混合溶液中,沉淀溶解液上样于经同一缓冲液液平衡的阴离子交换柱 DE-52 (XK26/40),以梯度10~300 mmol/L NaCl的10 mmol/L NaH2PO4-Cit (pH 7.0) 混合液进行梯度洗脱,取收集峰中段活性最高的小部分溶液,对其随后进行的Sephacryl S-100、Sephadex G25层析、脱盐及其冻干同上。
1.4.2 TEM-116 ESBL理化性质检测
TEM-116 ESBL 委托上海基康公司进行N末端氨基酸测序。
Bradford法测定蛋白含量[10],紫外吸收法测定酶对底物的水解率[11]。以PG为底物,0.1 mol/L pH 7.0的PBS为缓冲液,OD233时测定PG吸光度变化,计算酶活性。一个国际单位 (IU) 酶活性定义为pH 7.0、37℃条件下,每分钟水解1 mmol底物的酶量。
1.5 TEM-116 ESBL动力学特性检测
重组、天然TEM-116 ESBL和抗生素均以PBS (0.01 mol/L、pH 7.0)溶解,在200~400 nm 紫外区间进行扫描,确定测定波长。根据Lee-Wilson 的改良双倒数方程标准,测定动力学参数,求Km与Vmax,根据反应体系中加入酶量计算Kcat及其他衍生参数[3]。
1.6 TEM-116 ESBL降解环境中β-内酰胺类药物的应用
1.6.1 模拟药厂发酵废液与病人尿液中β-内酰胺类药物的清除
向青霉素发酵基础培养液加入PG,使其浓度分别为1000 mg/L和7000 mg/L,模拟制药厂青霉素发酵液 (pH 6.0);向尿液中加入等量的 Amp、PG和CEZ混合液,使其终浓度分别为8 mg/L和200 mg/L,模拟含抗生素的病人尿液 (pH 5.5)。向上述样本中加入不同量的TEM-116 ESBL,25℃下分别降解12 h和2 h。取降解后的样本0.1 mL,经Delvotest SP法[12]确认是否有抗生素残留。
1.6.2 液态牛奶中PG的清除
不含抗生素的新鲜液态牛奶中加入 PG至终浓度为80 U/L,考虑到实际应用的简便性,设计3个温度条件为4℃、25℃和37℃,分别加入0.5、1.0、1.5、2.0、2.5、3.0 IU的TEM-116 ESBL,作用0.5 h后,经Delvotest SP法确认是否有抗生素残留。
1.6.3 小鼠体内青霉素G的清除
将30只昆明鼠随机分成6组,每组5只,经预实验确定,给以药物和酶的剂量如下:第1组:空白对照组;第2组:PG 200 µg (8.0~9.1×103µg /(kg·bw));第 3组:PG 200 µg +200 IU TEM-116 ESBL (8.0×103~9.1×103IU/(kg·bw));第4组:PG 200 µg+ 300 IU TEM-116 ESBL (1.2×104~1.4×104IU/(kg·bw));第5组:PG 2000 µg (8.0×104~9.1×104µg /(kg·bw))+ 400 IU TEM-116 ESBL (1.6×104~1.8×104IU/(kg·bw));第 6组:PG 2000 µg +500 IU TEM-116 ESBL (2.0×104~ 2.3×104IU/(kg·bw))。
实验鼠尾静脉注射0.2 mL不同浓度的PG,0.5 h后,再注射不同浓度的TEM-116 ESBL溶液,10 h后,颈椎脱臼法处死小鼠,取四肢的肌肉,无菌双蒸水洗净,吹干,取约2 g剪碎的组织放入4 mL EP管内,加1 mL无菌双蒸水,匀浆1 min,14 000 r/min离心5 min,取0.1 mL上清液经Delvotest SP法检测是否有PG残留,每组2只进行观察。
2 结果
2.1 pET28-TEM-116重组质粒的构建
重组质粒的构建如图1所示,该方法保证了重组表达的TEM-116 ESBL在pET 28a质粒的T7启动子控制下,形成 6×His的融合蛋白。工程菌中提取的重组质粒经Nco I和Xho I双酶切后得到863 bp和5235 bp两条片段 (图2)。酶切图谱与预期结果完全一致,重组质粒经测序,确证blaTEM-116已成功克隆至pET28表达载体上。
2.2 blaTEM-116的高效表达、复性、纯化及理化性质检测
2.2.1 blaTEM-116的高效表达、复性和纯化
湿重为45 g的细菌所制备的TEM-116 ESBL包涵体先后经亲和及分子筛层析的纯化与复性。在亲和层析后,洗脱液蛋白紫外吸收峰 (图 3A) 可见 2个峰,峰1分子量较大,推测为前体TEM-116 ESBL峰 (32 kDa),峰2分子量较小,推测为成熟TEM-116 ESBL峰 (30 kDa)。其洗脱液经Sephacryl S100分子筛纯化后,分别收集峰1和峰2蛋白,再经Sephadex G25脱盐后,获得69.2 mg、比活性为476 IU/mg的成熟TEM-116 ESBL,即目的蛋白(洗脱峰见图3B)。另一纯化的前体 TEM-116 ESBL经测定比活性为39 IU/mg。
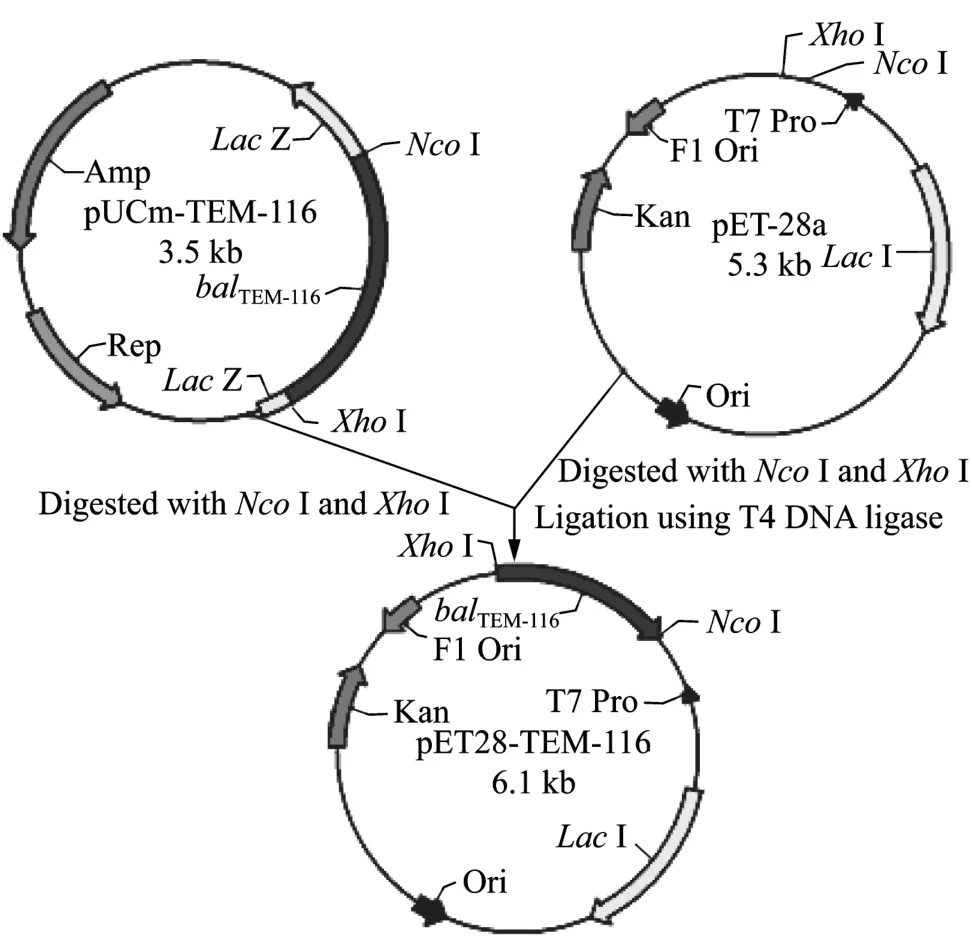
图1 重组质粒pET28-TEM-116的构建Fig. 1 Construction of the recombinant plasmid of pET28-TEM-116.
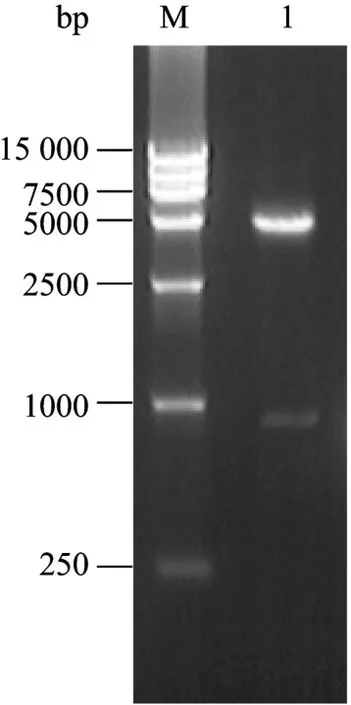
图2 重组质粒pET28-TEM-116的双酶切鉴定Fig. 2 Identification of recombinant pET28-TEM-116 digested with Nco I and Xho I. M: DL 15000 marker; 1: pET28-TEM-116 digested with Nco I and Xho I.
经SDS-PAGE电泳,亲和层析纯化前后的样品(图4,泳道2和3) 同时存在30 kDa和32 kDa两个蛋白条带,表明它们都含有 His标签;分子筛层析分离的蛋白条带 (图4,泳道1和4) 证明其分子量分别为30 kDa 和32 kDa;上述结果与预期一致。经蛋白扫描分析软件分析图4之泳道1和4,蛋白条带纯度均达到90%以上。
2.2.2 TEM-116 ESBL的 N末端测序
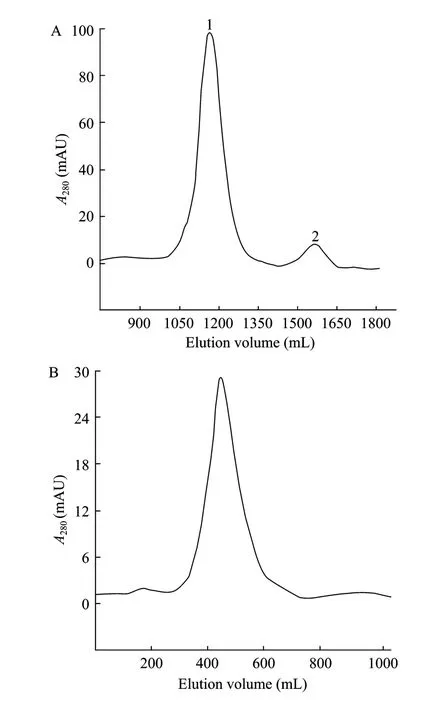
图3 重组TEM-116 ESBL的洗脱曲线 (280 nm)Fig. 3 Protein trace (continuous line, 280 nm) during elution of the recombinant TEM-116 ESBL. (A) Protein trace (continuous line, 280 nm) during elution of the recombinant TEM-116 ESBL from the Ni2+-NTA affinity chromatograph column (AU=absorbance units). 1: the precursor TEM-116 ESBL(32 kDa, 39 IU/mg); 2: the mature TEM-116 ESBL (30 kDa, 476 IU/mg). (B) Protein trace (continuous line, 280 nm;) of desalting the mature TEM-116 ESBL from the Sephadex G 25 column during elution.
图3A中峰2与图3B相应所纯化的TEM-116 ESBL经测序,其N端前9个氨基酸分别为HPETLVKVK,与推导的及GenBank所公布的成熟TEM-116 ESBL (Accession No. AY425988) N端氨基酸完全一致。表明高活性的30 kDa酶蛋白为成熟TEM-116 ESBL。本研究中动力学特性及其应用实验均采用该重组蛋白。
2.3 TEM-116 ESBL的动力学特性
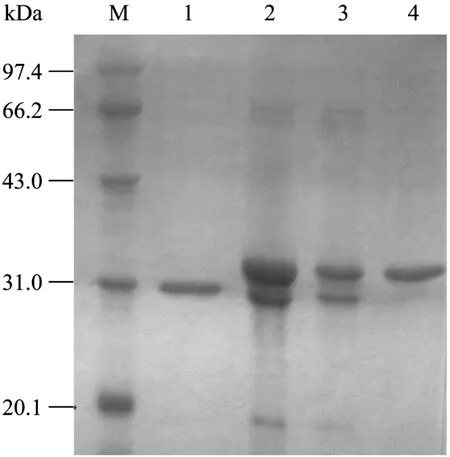
图4 SDS-PAGE检测纯化的TEM-116 ESBLFig. 4 SDS-PAGE analysis of the purified TEM-116 ESBL from inclusion bodies. M: protein marker; 1: purified mature TEM-116 ESBL; 2: inclusion bodies after dialysis; 3: inclusion bodies after affinity chromatography; 4: purified precursor TEM-116 ESBL.
自行分离纯化的天然TEM-116 ESBL的比活性为461 IU/mg,与重组酶的比活性 (476 IU/mg) 相近,用SPSS 11.0统计学软件对两种酶的Km、Kcat、Kcat/Km三项参数进行配对t 检验,结果表明 (表1),天然酶与重组 TEM-116 ESBL的 Km(t=1.334,P= 0.202)、Kcat(t=1.362,P=0.193)、Kcat/Km(t=1.479, P= 0.160),无显著性差异。TEM-116 酶对 CPZ亲和力最高,表明 CPZ是该酶的最优底物,其次是CEL。用催化常数评价,该酶对AMXC、Amp和PG的催化远高于其他头孢类药物,表明在底物饱和的情况下,对青霉素类具有较快的转化率;而头孢菌素中,则对CEZ具有较高的催化效率,但仍远小于Amp。就综合效率参数Kcat/Km而言,青霉素类药物是最容易被TEM-116 ESBL所降解的抗生素。这些均说明:重组和天然TEM-116 ESBL之间在酶催化动力学方面无显著差异;且该酶具有超广谱酶的底物谱、对底物的亲和力 (Km) 较强;同时,其催化效率 (Kcat) 也表明它具备较好的工具酶特征。
2.4 TEM-116 ESBL降解环境中β-内酰胺类药物的应用
2.4.1 模拟药厂发酵液与尿液中β-内酰胺类药物的清除
实验结果显示 (表2):25℃下作用12 h后,5.0 IU TEM- 116 ESBL可清除1 L模拟发酵液 (pH 6.0) 中的1000 mg PG,10.0 IU 该酶可清除1 L发酵液中的7000 mg PG;而25℃下作用2 h,5.0 IU 该酶可清除1 L模拟病人尿液 (pH 5.5) 中Amp、PG和CEZ各为8 mg 的混合抗生素,320.0 IU TEM-116 ESBL可清除1 L尿液中的Amp、PG、CEZ各为200 mg混合抗生素。表明该酶在不同应用介质中具有稳定的活性,能够高效地降解模拟发酵液、病人尿液中β-内酰胺类药物。
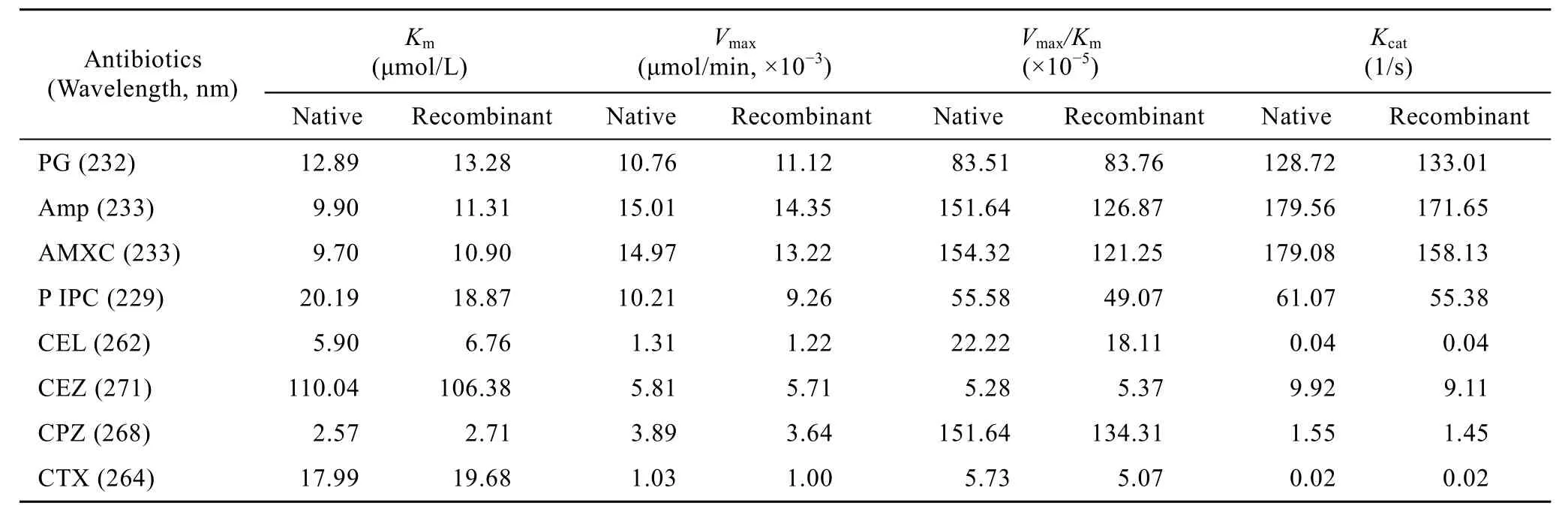
表1 天然与重组TEM-116 ESBL的动力学参数Table 1 Kinetic parameters of native and recombinant TEM-116 ESBL
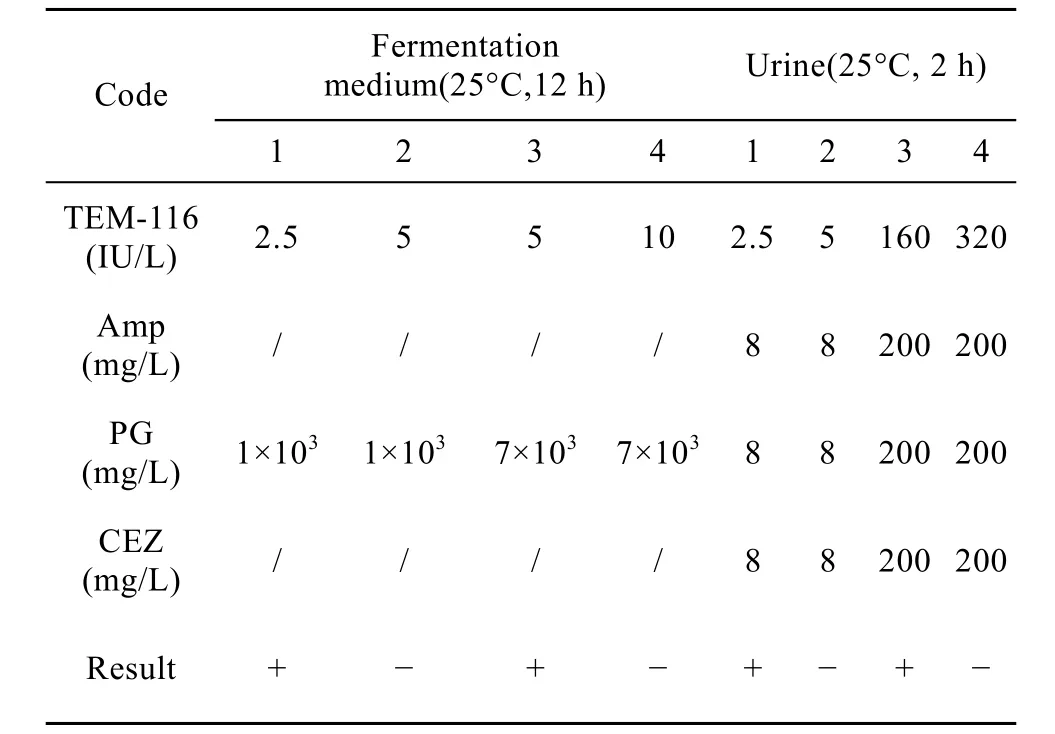
表2 TEM-116 ESBL清除发酵液 (pH 6.0) 及尿液(pH 5.5) 中的β-内酰胺抗生素Table 2 Elimination of β-lactam antibiotics in fermental liquid medium(pH 6.0)and urine(pH 5.5) by TEM-116 ESBL

表3 TEM-116 ESBL清除牛奶中的PG (80 U/L PG,0.5 h)Table 3 Elimination of PG in milk by TEM-116 ESBL (80 U/L PG, 0.5 h)
2.4.2 牛奶中PG的清除
牛奶中添加PG至终浓度为80 U/L,分别在4℃、25℃和37℃下作用0.5 h,实验结果表明 (表3):1.0、1.5和2.5 IU TEM-116酶分别在4℃、25℃和37℃温度条件下,经0.5 h清除牛奶中80 U/L的 PG。
2.4.3 小鼠体内PG的清除
由表4可见,1.2×104~1.4×104IU/(kg·bw) 酶能够完全清除 8.0×103~9.1×103µg/(kg·bw) 的 PG;2.0×104~2.3×104IU/(kg·bw) 酶可完全清除 8.0×104~ 9.1×104µg/(kg·bw) 的PG。各组留观20 d的小鼠未见异常死亡。该结果表明TEM-116 ESBL作为一种小分子蛋白 (30 kDa),能够通过血管屏障,并在体内仍保留一定的活性。
3 讨论
本研究利用原核表达系统,将TEM-116 ESBL进行包涵体表达,并建立了实验室中试规模的表达与纯化的技术路线,湿重45 g细菌的包涵体,经系列步骤纯化,共获取69.2 mg (476 IU/mg,计32 939 IU)TEM-116 ESBL。相比较复杂的包涵体复性,通过与纯化同步的柱上复性则得以简化。此外,实验也证实了TEM-116 ESBL所含的信号肽能被细菌水解酶所切割,从而形成前体和成熟TEM-116 ESBL两种酶蛋白。实验中获取的前体 TEM-116 ESBL (32 kDa,39 IU/mg)活性较低,可能的原因是前体和成熟酶蛋白半胱氨酸数目差异而导致的复性率不同,如成熟酶蛋白有2个半胱氨酸,复性时只能形成1个二硫键;而前体酶蛋白有3个半胱氨酸,复性需形成3个正确配对的二硫键,导致酶的复性率较低。因此,若进一步的研究中实现将更多的前体酶蛋白转换为成熟酶蛋白,该酶的复性率很可能显著提高。
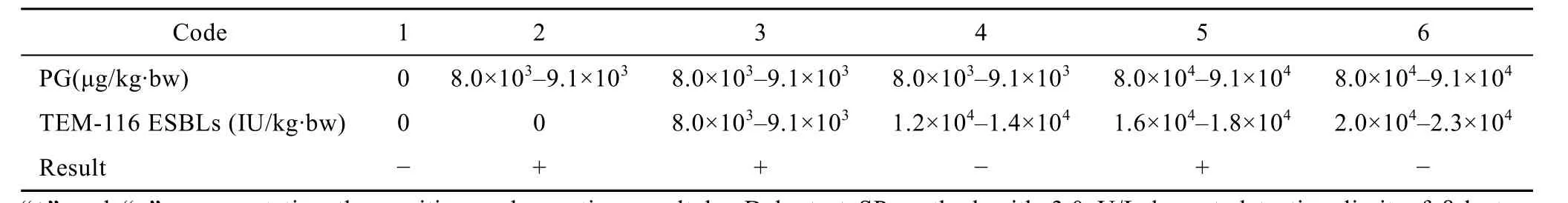
表4 TEM-116 ESBL清除小鼠体内的PGTable 4 Elimination of eliminating PG in vivo mouse by TEM-116 ESBL
抗生素的发明和应用是人类战胜感染性疾病的最有力武器,但是,在医疗、预防、工农业等领域的广泛使用乃至滥用也给人类带来了严重的生物安全问题,如人体和环境中的病原微生物耐药性形成与互相传播呈高发趋势[3-7],最近,Pellegrini等报道在城市污水和医疗环境中的假单胞菌属中分离出一种新型的具有超广谱特征的金属型内酰胺酶变种——IMP 22酶[13]。另外,在欧洲地区的调查也发现肠杆菌属细菌具有很高的 ESBL产生率[14],而这些菌属都是临床最常见的致病菌。因此,探寻有效遏制环境相关微生物耐药性传播的手段是非常必要的。本研究初步证明TEM-116 ESBL对模拟的青霉素药厂生产性废液 (pH 6.0) 和模拟的 β-内酰胺类抗生素治疗病人尿液 (pH 5.5) 中所含的青霉素类和头孢菌素类药物都具有较高的降解效率,其中,5.0 IU和10.0 IU的酶在25℃条件下作用12 h,能够分别降解发酵废液中所含的1000 mg/L与7000 mg/L的PG;Amp、PG和CEZ各为8 mg/L和200 mg/L的病人尿液样本中的混合抗生素,仅分别需要5.0 IU和320.0 IU TEM-116 ESBL即可完全清除。酶的动力学实验结果同样表明该酶对绝大部分 β-内酰胺药物具有较高和较稳定的催化效率,且重组酶和天然酶在酶动力学的Km、Kcat、Kcat/Km等参数方面相近。这些结果提示,可以将TEM-116 ESBL开发成环境保护制剂应用于消除高 β-内酰胺抗生素污染的相关领域,从而达到有效遏制环境相关病原微生物耐药性形成与传播的目的。
由于抗生素在动物饲料、生长促进剂、疾病治疗与预防等方面具有独特的作用,因此,动物源性食品中抗生素的残留和污染也是广泛存在的生物安全与食品安全问题[15-16]。如我国奶牛的乳腺炎等疾病发病率高,PG为代表的β-内酰胺类抗生素由于价廉、有效,为广大奶农作为首选治疗用药,用药期间及其后的一段时间牛奶中产生高浓度的抗生素,此外,部分饲料中也可能被抗生素污染或人为添加,因此,短期内还不能从源头上杜绝抗生素对牛奶的污染。早在1985年,Korycka-Dahl M等就使用粗制的β-内酰胺酶分解残留于牛奶中的 PG,但是,由于酶的来源为天然粗制酶,所以,其生物安全性和酶的活性都不理想[17]。本实验利用重组TEM-116 ESBL成功地降解了奶样中的 PG,但由于目前 TEM-116 ESBL尚处于安全性评价阶段,故不推荐实际应用。而通过运用酶固定化技术,可在不向牛奶中直接投放酶添加剂的基础上清除 β-内酰胺抗生素,该技术的应用有望使该工具酶较早通过食品药监部门的认定,而进入实用阶段。为了进一步证明 TEM-116 ESBL这种小分子酶蛋白是否具备体内分解 PG能力,研究中进行了小鼠体内药物降解实验,结果发现:1.2×104~1.4×104IU/(kg·bw) 酶能完全清除 8.0×103~ 9.1×103µg/(kg·bw) 的PG;2.0×104~2.3×104IU/(kg·bw)酶可完全清除8.0×104~9.1×104µg/(kg·bw) 的PG。每组2只留观鼠经20 d观察,未见异常死亡。该结果表明TEM-116 ESBL作为30 kDa的小分子蛋白,能够通过血管屏障,并在体内呈现其酶的活性。关于把 ESBL作为新型食品添加 (处理) 剂的安全性问题,笔者认为涉及两个方面,其一是酶自身的安全,其二是分解产物的安全。由于该酶是由耐药菌产生,因此,在人体的胃肠道、呼吸道、阴道等微生态区域均天然存在,故亦不应有酶自身或免疫学方面的危害;而关于抗生素分解后次级产物的毒副作用问题,有必要进行系统的毒理学安全性评价,或者通过优化技术手段如固定化酶膜等方法加以克服。
总之,本研究采用“逆向思维”的科学方法,把 ESBL由广泛存在于体内微生态菌丛中的耐药酶转化为具有潜在应用价值的工具酶,并取得了实验支持,为其进一步的推广应用奠定了基础。
REFERENCES
[1] Vignoli R, Varela G, Mota MI, et al. Enteropathogenic Escherichia coli strains carrying genes encoding the PER-2 and TEM -116 extended-spectrum beta-lactamases isolated from children with diarrhea in Uruguay. J Clin Microbiol, 2005, 43(6): 2940–2943.
[2] Hu GZ, Chen HY, Si HB, et al. Phenotypic and molecular characterization of TEM-116 extended-spectrum betalactamase produced by a Shigella flexneri clinical isolate from chickens. FEMS Microbiol Lett, 2008, 279(2): 162–166.
[3] Lin TL, Tang SI, Fang CT, et al. Extended-spectrum beta-lactamase genes of Klebsiella pneumoniae strains in Taiwan: recharacterization of SHV-27, SHV-41, and TEM-116. Microb Drug Resist, 2006, 12(1): 12–15.
[4] Brown KD, Kulis J, Thomson B, et al. Occurrence of antibiotics in hospital, residential, and dairy effluent, municipal wastewater, and the Rio Grande in New Mexico. Sci Total Environ, 2006, 366(2/3): 772–783.
[5] Iversen A, Kuhn I, Rahman M, et al. Evidence for transmission between humans and the environment of a nosocomial strain of Enterococcus faecium. Environ Microbiol, 2004, 6(1): 55–59.
[6] Clancy MJ, Graepler A, Breese PE, et al. Widespread emergence of methicillin resistance in community-acquired Staphylococcus aureus infections in Denver. South Med J, 2005, 98(11): 1061–1062.
[7] Aygun G, Demirkiran O, Utku T, et al. Environmental contamination during a carbapenem-resistant Acinetobacter baumannii outbreak in an intensive care unit. J Hosp Infect, 2002, 52(4): 259–262.
[8] Venglovsky J, Sasakova N, Placha I, et al. Pathogens and antibiotic residues in animal manures and hygienic and ecological risks related to subsequent land application. Bioresour Technol, 2009, 100(22): 5386–5391.
[9] Kennedy M, Krouse D. Strategies for improving fermentation medium performance: a review. J Ind Microbiol Biotechnol, 1999, 23: 456–475.
[10] Read SM, Northcote DH. Minimization of variation in the response to different proteins of the coomassie blue G eye-binding assay for protein. Anal Biochen, 1981, 116(1): 53–64.
[11] Lorian V. Antibiotics in Laboratory Medicine. 4th ed. New York: Lippincott Williams & Wilkins Press, 1996: 503–578.
[12] Suhren G, Beukers R. Delvotest SP for detection of cloxacillin and sulfamethoxazole in milk: IDF interlaboratory study. J AOAC Int, 1998, 81(5): 978–990.
[13] Pellegrini C, Mercuri PS, Celenza G, et al. Identification of bla(IMP-22) in Pseudomonas spp. in urban wastewater and nosocomial environments: biochemical characterization of a new IMP metallo-enzyme variant and its genetic location. J Antimicrob Chemother, 2009, 63(5): 901–908.
[14] Cantón R, Novais A, Valverde A, et al. Prevalence and spread of extended-spectrum beta-lactamase-producing enterobacteriaceae in Europe. Clin Microbiol Infect, 2008, 14(11): 144–153.
[15] Prescott JF. Antimicrobial use in food and companion animals. Anim Health Res Rev, 2008, 9(2): 127–133.
[16] Hammad AM, Ahmed AM, Ishida Y, et al. First characterization and emergence of SHV-60 in raw milk of a healthy cow in Japan. J Vet Med Sci, 2008, 70(11): 1269–1272.
[17] Korycka-Dahl M, Richardson T, Bradley RL, et al. Use of microbial beta-lactamase to destroy penicillin added to milk. J Dairy Sci, 1985, 68(8): 1910–1916.
