龙牙木多糖诱导人肝癌SMMC-7721细胞凋亡机制研究①
2010-02-06王丽君石莉萍北华大学化学与生物学院吉林132013
王丽君 石莉萍 (北华大学化学与生物学院,吉林 132013)
王丽君 石莉萍 (北华大学化学与生物学院,吉林 132013)
目的:探讨龙牙木多糖(AEPS)对体外培养人肝癌SMMC-7721细胞凋亡的影响,并探讨其可能的作用机制。方法:荧光显微镜观察细胞形态学变化,流式细胞术(FCM)检测SMMC-7721细胞的凋亡率;Western blot检测不同浓度AEPS作用36小时凋亡蛋白 survivin、caspase-3及bcl-2的表达情况。结果:与对照组比较,AEPS不同浓度剂量组Hoechst33258/PI荧光染色出现典型的凋亡形态学改变;FCM检测表明SMMC-7721细胞凋亡率各实验组均明显高于对照组(P<0.01),且呈时间剂量依赖性;Western blot显示与对照组相比,各实验组AEPS可显著下调SMMC-7721细胞 survivin和bcl-2的表达(P<0.01),而caspase-3的表达显著增加(P<0.01)。结论:AEPS能明显诱导人肝癌SMMC-7721细胞凋亡,其机制可能与改变凋亡相关基因survivin、caspase-3及bcl-2的表达有关。
龙牙木多糖;凋亡;survivin;caspase-3;bcl-2
1 材料与方法
1.1 主要材料与仪器 AEPS(纯度96.83%)由本实验室制备,SMMC-7721肝癌细胞(中国科学院上海细胞生物学研究所),DMEM培养基(美国Gibco BRL公司),胎牛血清(杭州四季青生物工程有限公司),碘化丙啶(PI)(美国 Caltag公司),β-actin、bcl-2,survivin、caspase-3抗体(Santa Cruz Biotechnologies公司),流式细胞仪(FCM)(美国Beckman coulter公司),Annexin/PI凋亡检测试剂盒(北京宝赛公司),Hoechst33258/PI荧光染色试剂盒(美国Sigma公司),BX51TF荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养 SMMC-7721肝癌细胞株培养在10%胎牛血清的DMEM培养基(含100 U/m l青霉素和100 U/m l链霉素)中,于37℃、5%CO2的细胞培养箱中培养,用0.25%的胰酶消化传代,取对数生长期细胞进行实验。
1.2.2 荧光显微镜观察SMMC-7721肝癌细胞凋亡将1×106细胞接种于6孔细胞培养板中,培养24小时后,分别加入 50、100、200 μg/ml的 AEPS,同时设对照组,48小时后行常规细胞涂片,固定,Hoechst33258/PI染色后封固,荧光显微镜下观察,记录细胞形态变化情况,拍照。
1.2.3 Annexin V-FITC/PI双染法流式细胞仪检测细胞凋亡 选取对数生长期细胞接种于24孔板中,加入AEPS使其终浓度分别为50μg/m l(低剂量组)、100μg/m l(中剂量组)、200 μg/ml(高剂量组),处理细胞12、24、36、48 小时后,用0.25%胰酶+0.02%EDTA消化,计数后取约5×105个细胞,1 000 r/min离心5分钟后弃上清液,用预冷PBS洗涤2次,按试剂盒说明书加入Annexin V-FITC 10μl和PI 5μl,避光室温反应15分钟,在1小时内用流式细胞仪检测凋亡细胞比率。使用CellQuest软件获取细胞信息,Winmdi软件分析细胞凋亡。实验重复3次,另设空白对照组。
1.2.4 Western blot检测 survivin、caspase-3和bcl-2蛋白表达 应用Western blot技术,以β-actin作为内照物,比较各组 survivin、caspase-3和bcl-2蛋白表达水平的改变。作用36小时后分别收集空白对照组、AEPS 50、100、200μg/ml剂量组的细胞,PBS洗3次,加入预冷的细胞裂解液,裂解后离心取上清,用Bradford法测定各种蛋白的浓度。分别取蛋白样品,按体积比4∶1加入上样缓冲液,100℃、5分钟变性,经SDS-PAGE(5%的浓缩胶,18%的分离胶)电泳分离后,将蛋白电转印于硝酸纤维素膜经脱脂奶粉封闭液封闭,将硝酸纤维素膜分别加入稀释后一抗,再用相应辣根过氧化物酶(HPR)标记的二抗稀释液孵育,用 ECL发光法检测不同样品各种蛋白表达状况。图像以Bio-Rad图像分析系统分析,用目的蛋白条带的平均光强度值与β-actin条带的平均光强度值的比值表示该蛋白表达的相对强度。
2 结果
2.1 Hoechst33258/PI双染法观察细胞凋亡形态学改变 AEPS 50、100、200 μg/m l处理SMMC-7721 细胞48小时,Hoechst 33258/PI荧光染色结果见图1。不同浓度AEPS处理SMMC-7721细胞48小时后,出现典型的凋亡形态学改变。染色质分布均匀的蓝色细胞为正常细胞。细胞核染色质凝集、分布不均、产生强烈荧光为凋亡细胞,染成红蓝色为晚期凋亡细胞,染成红色荧光为坏死细胞。50、100、200μg/m l处理过的凋亡率均显著高于对照组,但坏死率也高于对照组。
2.2 FCM检测AEPS对SMMC-7721细胞凋亡率的影响 各组细胞在AEPS作用12小时后即出现凋亡现象(图2),低、中、高剂量组凋亡率分别为(10.14±0.91)%、(12.32±1.50)%和(14.53±1.97)%,与空白对照组细胞(5.31±0.65)%比较,差异有统计学意义(P<0.01);其余时间点各组比较,AEPS处理组凋亡率均高于对照组,差异有统计学意义(P<0.01);另外,随着时间的延长,细胞凋亡的现象越来越明显,同时在同一时间点随着AEPS浓度增加,细胞凋亡率亦增加,呈现明显的剂量/时间正向依赖关系(图3)。
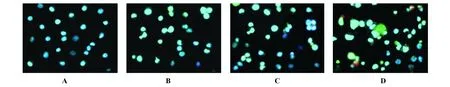
图1 荧光显微镜观察SMMC-7721肝癌细胞凋亡(×400)Fig.1 The apop tosis of SMMC-7721 cells were observed by the fluorescentm icroscope(×400)
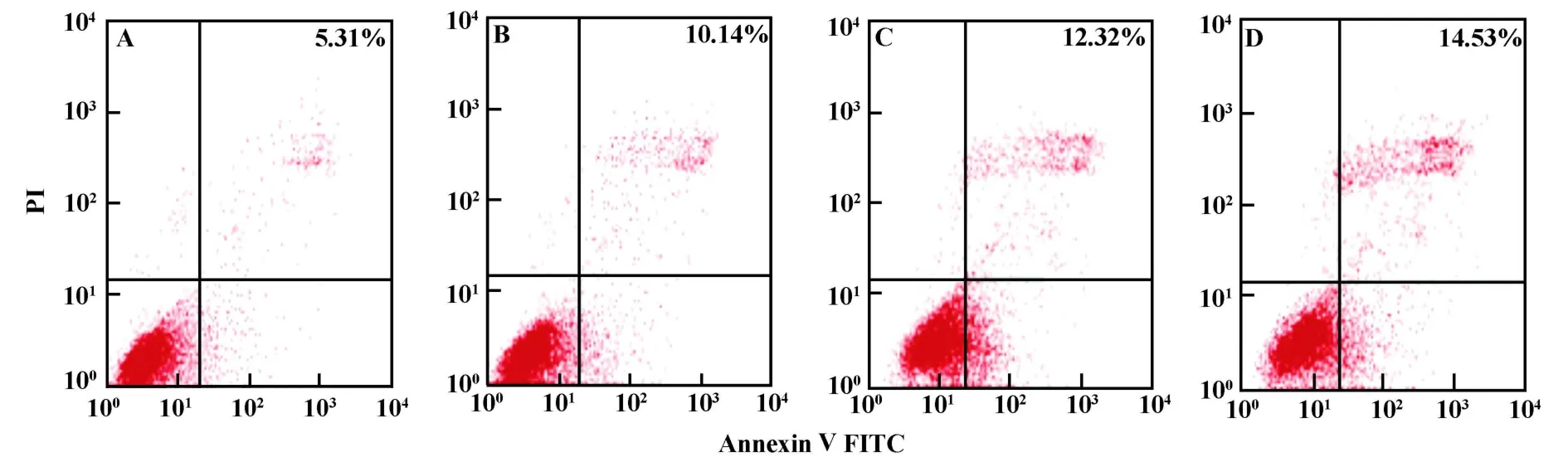
图2 SMMC-7721细胞经不同浓度AEPS处理12小时后凋亡情况Fig.2 Apoptosis rate in SMMC-7721 cells after treatment with various concentrations of AEPS for 12 h

图4 AEPS对 SMMC-7721细胞 survivin、caspase-3及bcl-2蛋白表达的影响Fig.4 The expression levels of survivin,caspase-3 and bcl-2 in SMMC-7721 cells after treatment with various concentrations of AEPS
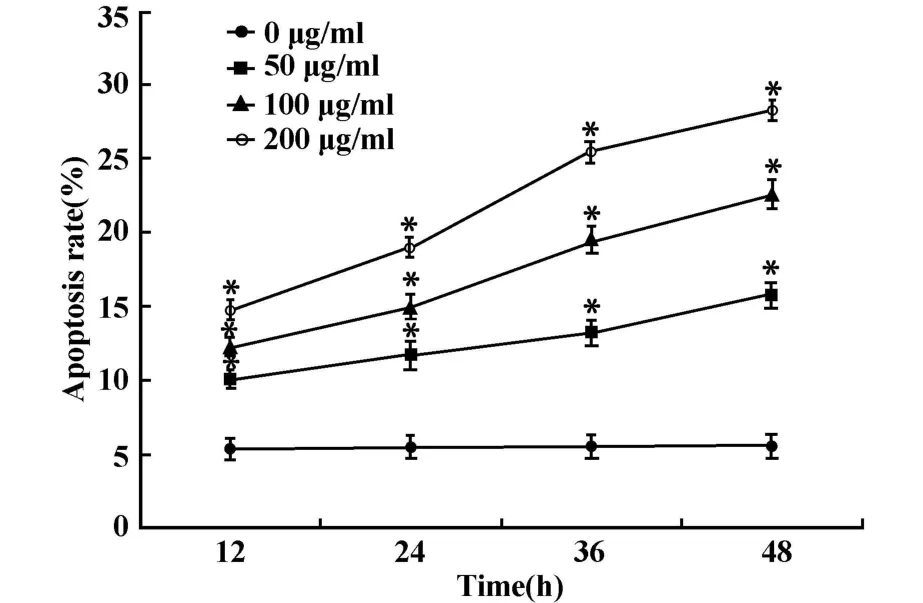
图3 SMMC-7721细胞经不同浓度AEPS处理后凋亡情况Fig.3 Apoptosis rate in SMMC-7721 cells after treatment with various concentrations of AEPS
2.3 AEPS对SMMC-7721细胞survivin、caspase-3及bcl-2蛋白表达的影响 Western blot检测显示经50、100、200μg/ml AEPS处理SMMC-7721细胞36小时,结果见图4A。蛋白条带相对强度图表明(图4B),不同浓度的AEPS作用SMMC-7721细胞后,survivin和bcl-2的蛋白表达均呈现下调的趋势,200μg/m l AEPS作用SMMC-7721细胞几乎完全抑制survivin的表达,而caspase-3的表达却显著升高,其效应均具有浓度梯度依赖性。
3 讨论
肿瘤的发生是一个多基因、多步骤、多阶段的复杂过程,细胞凋亡在肿瘤的发生发展中主要起负调控作用[4]。细胞凋亡受抑是肿瘤的发病机制之一,细胞凋亡的失衡导致肿瘤发生并影响肿瘤的生物学行为[5,6]。首先,本研究检测了AEPS处理SMMC-7721细胞后的凋亡情况,结果显示与对照组比较,AEPS不同浓度剂量组Hoechst33258/PI荧光染色出现典型的凋亡形态学改变;FCM检测表明AEPS处理细胞12小时后,SMMC-7721细胞即出现凋亡现象,且存在剂量、时间效应关系。由此推测诱导细胞凋亡是AEPS抗肿瘤作用机制之一。
survivin是新发现的一种凋亡抑制蛋白家族成员,也是迄今发现的最强的凋亡抑制因子,survivin的过度表达抑制了细胞凋亡,有利于细胞的异常增殖和恶性转化。caspase-3是caspase家族中重要的凋亡执行者之一,抑制caspase-3的活性或拮抗其功能可使细胞凋亡受抑。功能强大的凋亡抑制基因survivin主要在凋亡通路的下游抑制caspase-3发挥抗凋亡的效应[7]。为此,我们采用Western blot检测了相关凋亡蛋白survivin和 caspase-3的表达情况。结果显示抑制凋亡蛋白survivin在AEPS诱导下出现了表达显著下调,而致凋亡蛋白caspase-3的表达显著增加,从而导致SMMC-7721细胞凋亡。
bcl-2蛋白的功能是阻遏细胞凋亡,并能协助细胞抵抗免疫系统的监视作用,最终导致肿瘤的形成,其过度表达已被证实存在于多种肿瘤组织中。本研究结果表明AEPS可显著下调SMMC-7721细胞bcl-2的表达(P<0.01),提示AEPS诱导SMMC-7721细胞凋亡还可能与bcl-2的表达下调有关。
caspase家族是细胞凋亡中发挥关键作用的酶,许多凋亡诱导剂可通过 caspases依赖的方式诱导。Survivin家族凋亡相关基因通过调节线粒体途径影响凋亡的发生,survivin可直接与 caspase-3、caspase-7结合并抑制它们的活性[8,9]。bcl-2家族成员与线粒体膜通透性相关并调结膜的完整性[10]。本研究中AEPS诱导的SMMC-7721细胞凋亡,一方面可能与下调survivin和bcl-2表达有关,另一方面还可能通过增加caspase-3的表达。这些研究结果提示,线粒体途径可能是AEPS诱导SMMC-7721细胞凋亡的主要机制之一。
1 江苏新医学院.中药大辞典[M].上海:上海人民出版社,1997:2583-2589.
2 孙 涛,张国荣,王 彦etal.龙芽木化学成分、药理作用和食用价值的研究进展[J].人参研究,2009;1:78-81.
3 姜建芳,王思平,何新军.中药多糖抗肿瘤作用研究进展[J].中国现代应用药学杂志,2008;25(7):616-618.
4 Mitza A,M cGuirkM,Hockenberry TNetal.Human survivin isnegatively regulated by wild-type p53 and participates in p53-depend apoptotic pathway[J].Oncogene,2002;21(17):2613-2622.
5 Viard-Leveugle I,Veyrenc S,French L Eetal.Frequent loss of Fas expressin and function in human lung tumorswith overexpression of FasL in small cell lung carcinoma[J].JPathol,2003;201(2):268-277.
6 Daniel JC,SmytheW R.The role of Bcl-2 familymembers in non-small cell lung cance[J].Semin Thorac Cardiovasc Surg,2004;16(1):19-27.
7 Shin S,Sung B J,Cho Y Setal.An anti-apoptotic protein human surviving is a direct inhibitor of caspase-3 and 7[J].Biochem,2001;40(4):1117-1123.
8 O liver C L,MirandaM B,Shangary Setal.Gossypolacts directly on the mitochondria toovercome Bcl-2-and Bcl-X Lmediated apoptosis resistance[J].MolCancer Ther,2005;4(1):23-31.
9 Xu Z X,Zhao R X,Ding Tetal.Promyelocytic leukem ia protein 4 induces apoptosis by inhibition of survivin expression[J].J Biol Chem,2004;279(3):1838-1844.
10 Adams JM,Cory S.The Bcl-2 protein fam ily:arbiters of cell survival[J].Science,1998;281:1322-1326.
[收稿2010-08-27]
(编辑 张晓舟)
AEPS induces apoptosis in SMMC-7721 hepatocellular cancer cells and itsmechanism
WANGLi-Jun,SHILi-Ping.CollegeofChemistryandBiology,BeihuaUniversity,Jilin132013,China
Objective:To study themechanism of apoptosis induced by AEPS in SMMC-7721 hepatocellular cancer cells.Methods:The fluorescentmicroscopewas utilized to observe themorphological changes of apoptosis,apoptosis rate were detected with flow cytometry.Western b lot was utilized to detect the expression of survivin,caspase-3 and bcl-2.Results:Typicalmorphological changes of apoptosis in SMMC-7721 cancer cells could be observed by the fluorescencemicroscope.Compared with thatof the control cells,apoptotic rate of the cells treatedwith AEPSwas increased signifcantly(P<0.01)and ina dose-and time-dependentmanner.Western blot showed thatsurvivin and bcl-2 expressionwas signifcantly decreased(P<0.01),whereas caspase-3 expressionwas signifcantly increased(P<0.01)in SMMC-7721 cancer cells treated with AEPS.Conclusion:AEPS can markedly induce apoptosis in SMMC-7721 hepatocellular cancer cells.The mechanism might be related to the change of survivin,caspase-3 and bcl-2 exp ression.
Polysaccharide ofAraliaelataSeem(AEPS);Apoptosis;survivin;caspase-3;bcl-2
R735.7 R392.1 R730.1
A
1000-484X(2010)12-1082-04
10.3969/j.issn.1000-484X.2010.12.006
①本文为吉林省科技厅资助项目(20080913)
王丽君(1964年-),女,硕士,教授,主要从事天然药物化学成分及生物活性的研究,E-mail:lijun0926@163.com。
