恒波长同步荧光法测定吐温80-硫酸铵液固萃取体系中绿色荧光蛋白标记的融合蛋白
2010-02-03沈静茹靳光才余学红
沈静茹,靳光才,余学红,韦 康,林 敏
(1中南民族大学化学与材料科学学院国家民委分析化学重点实验室,武汉430074;2中南民族大学校医院,武汉430074)
目前50%以上原核生物表达的重组蛋白都是通过末端接有六聚组氨酸(6xH is)得以纯化[1],固定化金属鳌合亲和层析技术已成为基因重组蛋白和多肽分离纯化最有效的工具之一.王伟等[2]等用ProBand Resin亲和层析柱,得到表达的酵母GGDP合酶融合蛋白;Yao-Ch iChung等[3]用固定化N i2+螯合亲和层析提纯绿色荧光蛋白,一次可达85%的纯度;Pan L i等[4,5]通过装载有N i2+的螯合层析柱纯化大肠杆菌中绿色荧光蛋白,一次提纯率可达90%;也有采用乙醇萃取[6]法纯化绿色荧光蛋白的.上述方法有各自特点,但也存在费用昂贵、耗时、重现性不佳,有机溶剂易使蛋白变性失活等问题.液-固萃取体系[7]费用低廉、无需高档仪器设备.若利用此体系分离纯化各类蛋白应具有较大优势.本文探究了在吐温80-硫酸铵液固萃取体系中分离含绿色荧光蛋白的融合蛋白适用的荧光方法-恒波长同步荧光法.运用于该体系,初步探讨了液-固萃取体系萃取绿色荧光蛋白的可行性.
1 试剂与仪器
1.1 试剂
酵母提取物与蛋白胨(北京双旋微生物培养基制品厂);氨苄青霉素(Am p);异丙基-β-D-硫代半乳糖苷(IPTG,sigm a公司);聚乙二醇6000(分析纯,上海化学试剂厂,Japan进口分装);氯化亚砜(分析纯,上海同方精细化工有限公司);三氯甲烷(分析纯,国药集团化学试剂公司);Cu(Ⅱ)-IDAPEG6000-IDA-Cu(Ⅱ)修饰物(自制);菌蛋白质溶液(取自工程菌).
1.2 仪器
D 40-1型电动搅拌机(杭州仪表电机厂);78-1型磁力加热搅拌器(杭州仪表电机厂);手提式不锈钢蒸汽消毒器(上海三申医疗器械有限公司);高速冷冻离心机(CR 22G型,日立公司);DYY-Ⅲ2电泳仪(北京六仪仪器厂);HS-3C型酸度计(上海伟业仪器厂);HY-4调速多用振荡器(金坛市大地自动化仪器);XW 微型漩涡混合仪(上海沪西分析仪器厂);LS-55型荧光/磷光/发光光度计(PE公司).
2 结果与讨论
2.1 工程菌的培养及蛋白的表征
2.1.1 配制L u ria-Bertan i(LB)培养基及灭菌
将适量酵母提取物、蛋白胨、N aC l调节pH 7.0.分装至锥形瓶与小试管中,密封,高压蒸汽灭菌,完毕后烘干备用.
2.1.2 用于SDS-PA GE电泳的蛋白获取及SDSPAGE电泳
超净工作台紫外灯灭菌,取pQ E31-GFP与pGEM 单菌落接种于含氨苄青霉素(Am p)的LB培养基中,摇床中振摇培养过夜.从培养过夜的菌液中吸取少量转接至含Am p的LB培养基的小管中,于摇床中培养,至菌体OD600达到0.6~0.8.将已达到OD600要求的菌液用IPTG诱导,于摇床中振摇培养4~24 h.未诱导的于37℃摇床中振摇培养16 h.高速离心除去培养基,水悬浮菌体,超声波破碎.再高速离心,取适量的溶液加入等量上样缓冲液,沸水中煮沸3~5m in,离心10m in,取上清液进行电泳点样.
蛋白质的聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱表征.根据L aemm li[8]方法进行垂直电泳.5%浓缩胶和15%分离胶,电极缓冲液为T ris-G ly系统(pH 8.3).蛋白质上样量为20μL,考马斯亮蓝R 250染色.得到不同培养条件下的蛋白质SDS-PA GE图,见图1.图1中pQE31-GFP指含pQE31-GFP表达质粒,该质粒含氨苄青霉素抗性基因,可表达一个在29 kD上下含6 xH is和绿色荧光蛋白的融合蛋白.pGEM 指具有氨苄青霉素抗性,但不表达绿色荧光蛋白,可作为无表达的阴性对照菌株.
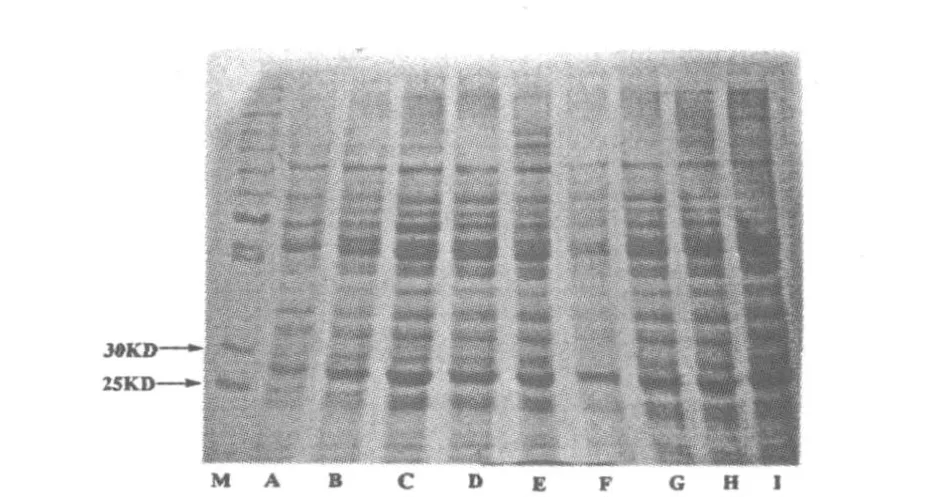
图1 各种条件下蛋白质的SDS-PAGE电泳图Fig.1 SDS-PAGE of the p ro tein
图1中B~ I条带均在25~30 kD有一条清晰的条带,符合目标蛋白的条件,而对照菌株则在此间不存在清晰的条带,说明目标蛋白已经表达出来.同时对比各个条带发现,当诱导剂的浓度在0.4mm o l/L、诱导时间为4 h时,诱导最明显,如图1中的C条带.因此选择诱导剂的浓度为0.4mm o l/L,诱导时间为4 h.
2.1.3 大量工程菌的培养及粗蛋白的获取
经过活化菌种(同前)、扩大培养(同前)、诱导表达(同前)、菌体收集(同前)和表达产物收集(于高速离心机中10 000 r/m in,恒温4℃离心30m in收集上清液,即为后续提纯所需要的粗蛋白溶液,即菌蛋白原液).
2.2 目标蛋白荧光测定表征方法探究
2.2.1 蛋白质荧光强度
将自工程菌(含六聚组氨酸绿色荧光蛋白修饰融合蛋白)中得到的蛋白质溶液,稀释100倍后于LS-55型荧光/磷光/发光光度计仪上进行荧光扫描,结果见图2a发射光谱(Ex)和图2b激发光谱(Em).调节狭缝宽度得到菌蛋白最佳测定条件:激发波长220 nm,发射波长348 nm,激发波长狭缝宽度(Em Slit)和发射波长狭缝宽度(ExSlit)均为12.5 nm.
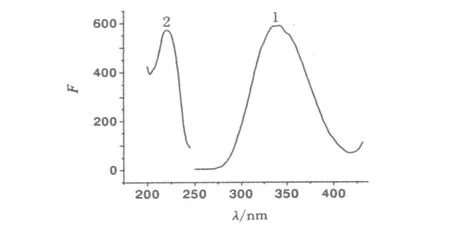
图2 菌蛋白质溶液荧光光谱图Fig.2 Fluo rescence spectra of the p ro tein
2.2.2 吐温80-硫酸铵液固萃取体系各因素对蛋白质荧光光谱的影响
配置浓度0.7%(质量/体积)PEG修饰物,1.9m o l/L的硫酸铵溶液,5.4%(体积/体积)的吐温80溶液(分别为液固萃取体系分离纯化蛋白时体系各物质的实际浓度),在激发波长220 nm处,扫描上述各溶液荧光发射光谱、激发波长和发射波长狭缝宽度均为12.5 nm,得三者的发射光谱扫描图,见图3.PEG修饰物和硫酸铵溶液无荧光现象,在348 nm处也未出现荧光峰,因此其对蛋白质的荧光测定没有影响;吐温80溶液在348 nm处有很强的荧光吸收,将吐温80溶液的浓度稀释为0.024%(体积/体积),与蛋白质原液稀释100倍在同样条件下扫描,得对比图4.
由图4知,在激发波长为220 nm 处,狭缝宽度均为12.5 nm时,吐温80溶液与菌蛋白溶液两者发射光谱基本重合,于340~350 nm处均有一明显的峰.说明吐温的存在对蛋白质的荧光测定有很大的影响,更说明在液固萃取体系分离菌蛋白时,用普通荧光法吐温80会严重干扰菌蛋白的测定,由此得到的萃取分析数据不能指导分离工作,因此需要探究其它适用于吐温80-硫酸铵液固萃取体系分离菌蛋白的荧光测定方法,以消除干扰.力求得到准确的萃取分析数据,对分离起指导作用.

图3 修饰物、硫酸铵与吐温80的荧光发射光谱图Fig.3 Em spectra o fmodifier,amm onium su lfate and tw een 80
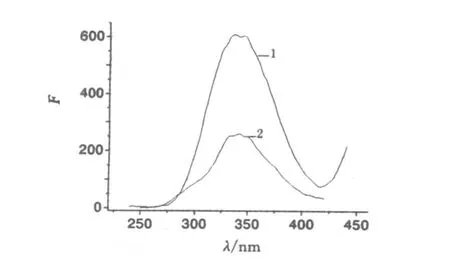
图4 菌蛋白质与吐温80溶液的荧光发射光谱图Fig.4 Em spectra of p ro tein and tw een80
2.3 液-固萃取体系中蛋白质恒波长同步荧光测定法研究
2.3.1 恒波长同步荧光扫描菌蛋白质溶液
对含绿色荧光蛋白的菌蛋白液和对照菌(pGEM)中提取的蛋白液进行恒波长同步荧光扫描时,变换不同的波长差(Δλ:10~150 nm),同时探究激发波长与发射波长的狭缝宽度对光谱峰的影响,确定恒波长同步荧光的最佳扫描方式为:Δλ为20 nm,ExSlit为10 nm,Em Slit为15 nm,扫描速度(ScanSpeed)1 200 nm/m in,按最佳扫描方式得扫描图5.
由图5曲线1可知,蛋白质的荧光光谱在287.50 nm以及487.19 nm处各有一个非常强的光谱峰,而对照菌中提取的蛋白质仅在285.50 nm附近有光谱峰,其在487.19 nm处却没有光谱峰,可确认487.19 nm处的峰为含绿色荧光蛋白的目标蛋白特征光谱峰.可在此处建立绿色荧光蛋白的恒波长同步荧光测定法,但能否作为吐温80-硫酸铵液固萃取体系分离菌蛋白的荧光测定方法还需进一步考察萃取体系中各因素的影响.

图5 2种菌的蛋白质恒波长同步荧光光谱图Fig.5 Constan t-w aveleng th synch ronous fluo rescence spectra o f p ro tein o f tw o k inds co li fo rm
2.3.2 液-固萃取体系各因素恒波长同步扫描对菌蛋白原液的影响
(1)吐温80、PEG修饰物、硫酸铵的恒波长同步荧光光谱图.在最佳扫描条件下将萃取体系组成成分硫酸铵、吐温80、PEG修饰物进行恒波长同步荧光扫描,得光谱图6,由图6可知三者均在487.19 nm处荧光强度较弱,说明在体系中用恒波长同步荧光法测定菌蛋白中目标蛋白,组成萃取体系的各成分不会对菌蛋白的测定产生干扰.
(2)酸度对菌蛋白质溶液荧光的影响.取1m L稀释10倍的菌蛋白质溶液,调节pH分别为4.2,4.9,5.1,5.9,6.3,定容至10m L,在同步荧光最佳荧光条件下,菌原液中绿色荧光蛋白的同步荧光强度变化如图7所示.结果显示pH<5.1,菌蛋白液在487.19 nm处的荧光峰基本消失.
(3)PEG修饰物、硫酸铵、吐温80溶液与蛋白质混合液的恒波长同步荧光光谱图.取3份1m L稀释10倍的菌蛋白质溶液,分别与0.7%(质量/体积)的PEG修饰物、1.9m o l/L的硫酸铵溶液、5.4%(体积/体积)的吐温80混合,于pH 6.3时扫描得各自的恒波长同步荧光光谱图,见图8.

图6 吐温80、PEG修饰物、硫酸铵的恒波长同步荧光光谱图Fig.6 Constan t-w avelength synch ronous fluo rescence spectra o f tw een80,m od ifier,amm on ium su lfate
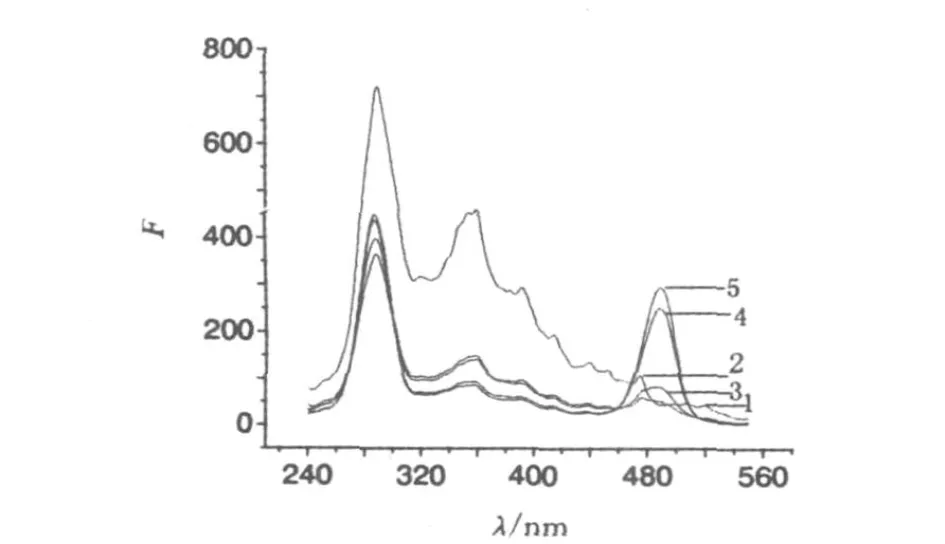
图7 酸度对菌蛋白质荧光光谱影响图Fig.7 Effecto f acidity to flurescence spectra o f p ro tein
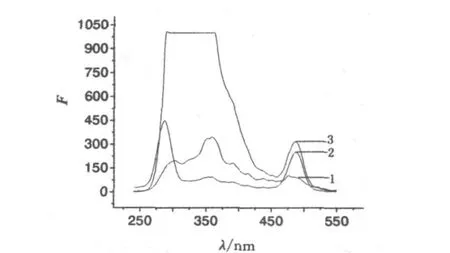
图8 PEG修饰物、硫酸铵、吐温80溶液分别与蛋白质混合液的恒波长同步荧光光谱图Fig.8 Constant-w avelength synch ronous flu rescence spectra ofp ro teinm ixedw ith PEGm odifier,amm onium su lfate and tw een 80
由图8知,蛋白质中加入硫酸铵及吐温80溶液后,478.19 nm处蛋白的荧光峰未发生变化,加入PEG修饰物后,487 nm处的峰强度减弱了,可能为PEG修饰物与蛋白质有相互作用引起的,但仍有明显的菌蛋白荧光峰存在.
(4)实际萃取体系液相、固相的恒波长同步荧光光谱.在2支比色管中加入一定量pH 6.2的硫酸铵溶液,适量PEG修饰物和吐温80溶液,一支不加菌蛋白溶液,另一支加入0.3m L菌蛋白液,定容,萃取分离后液相和固相在最佳条件下用恒波长同步荧光扫描,得图9.
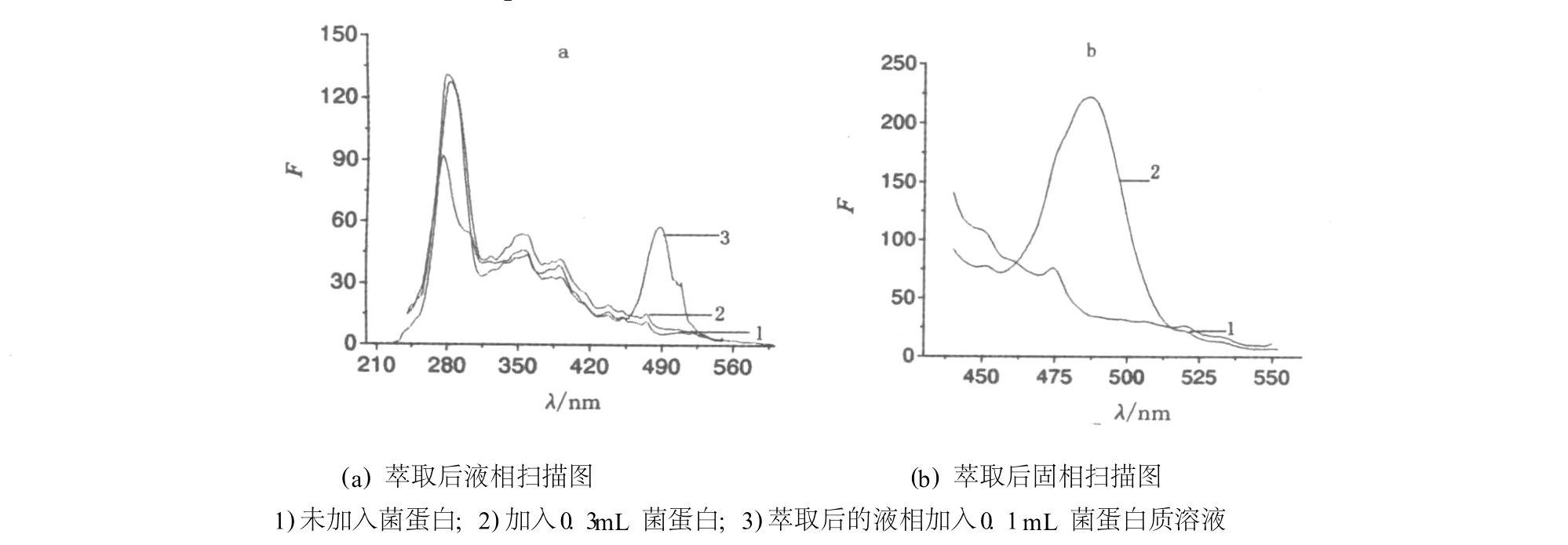
图9 实际萃取体系液相、固相的同步荧光光谱Fig.9 Constan t-w avelength synch ronous flu rescence spectra of liqu id phase,so lid phase
由图9a曲线1和图9b曲线1可知,未加入菌蛋白萃取后的液相和固相487.19 nm波长处无荧光蛋白的光谱峰;加入了0.3m L菌蛋白萃取后的液相扫描图(图9a曲线2)在487.19 nm处的荧光强度也很弱,但对应固相的同步荧光光谱峰很明显(图9b曲线2),强度很大,说明目标蛋白大部分都萃取至固相中;图9a曲线3说明后加入萃取后液相的菌蛋白液中含绿色荧光蛋白的光谱峰在强度和位置上均未发生变化,说明菌蛋白在此条件下无构象上的变化,也说明实际分离体系各因素对同步荧光测定法测定菌中绿色荧光蛋白没有影响.
(5)萃取体系的标准曲线.不同量菌原液在液固萃取分离后液相和固相中用恒波长同步荧光法(即 Δλ= 20 nm,ExSlit 10 nm,Em Slit1 5 nm,ScanSpeed 200 nm/m in,487.19 nm)测定其荧光强度.得图10.

图10 萃取体系的标准曲线Fig.10 Standard curve of ex traction system
由图10可知,萃取后的液相与固相的标准曲线线性相关系数分别为R=0.999 35和R=0.997 48,说明萃取体系其他因素不对绿色荧光蛋白的测定构成干扰,用恒波长同步荧光法测定吐温80-硫酸铵液固萃取体系分离纯化后液相和固相含绿色荧光蛋白的菌中融合蛋白是可行的.
2.4 液-固萃取体系纯化菌蛋白的初步探究
2.4.1 修饰物对固相收得率的影响
1.9m o l/L硫酸铵溶液、5.4%(体积/体积)吐温80溶液,PEG修饰物浓度分别为0,0.7%(质量/体积),菌蛋白质溶液均加入0.3m L(一一对应参比),定容到10m L,液固分离后,用恒波长同步荧光法测定液相和固相溶液487.19 nm处荧光强度,计算固相收得率(用萃取后固相的恒波长同步荧光强度比萃取后固相和液相恒波长同步荧光强度之和).计算一次萃取固相收得率分别为41.31%,76.90%.此结果说明加入一定量的PEG修饰物后,吐温80-硫酸铵液固萃取体系对目标蛋白的固相收得率有明显的提高.
2.4.2 酸度对固相收得率的影响
在一定条件下调节体系萃取pH至5.7,6.2,6.8,液固分离定容后测定荧光强度(一一对应参比),计算一次萃取固相收得率.结果分别为74.91%,93.50%,84.10%.可知当修饰物存在时,酸度对收得率也有较大影响,pH 6.2时,一次萃取固相收得率最高达93.50%;而不加修饰物,将pH调为6.2时,一次萃取固相收得率为63.24%.结果表明酸度对固相收得率有明显的影响(不调酸度的原始吐温80-硫酸铵液固萃取体系pH 5.4,一次萃取固相收得率为41.31%),但PEG修饰物与目标蛋白的特殊相互作用却能大大提高液固萃取体系的分离选择性.同时也说明恒波长同步荧光法适用于该体系中含绿色荧光蛋白的融合蛋白荧光测定.
3 结语
培养了含六聚组氨酸绿色荧光蛋白修饰融合蛋白的工程菌,从菌中得到了粗蛋白溶液,用SDSPA GE电泳初步验证了绿色荧光蛋白的表达.用普通荧光和恒波长同步荧光2种方式对从工程菌中收集的蛋白原液进行了比较,确定了液固萃取体系中适用的恒波长同步荧光法.通过调节酸度和提高选择性运用吐温80-硫酸铵液固萃取体系初步分离了菌中目标蛋白,调节酸度至pH 6.2时一次萃取固相收得率可达63.24%(不调酸度原始体系为41.31%),进一步提高选择性,加入聚乙二醇修饰物一次萃取固相收得率最高可达到93.50%.
[1] Ch iang YW,W u J C,W ang K C,et al.Efficien t exp ression o f histidine-tagged large hepatitis delta an tigen in bacu lovirus-transduced baby ham ster k idney cells.W o rld jou rnal o f gastroen tero logy[J].2006,12(10):1 551-1 557.
[2] 王 伟,孟 超,朱 平,等.绿色荧光蛋白标记的表达载体pH is-EGFP的构建[J].中国生物工程杂志,2005,25(9):35-39.
[3] Chung Yao-Ch i,L iu Hung-Jen,Hu Yu-Chen.Facile m on ito ring o f avian reovirusσB exp ression and pu rification p rocesses by tagged green fiuo rescen t p ro tein[J].Enzym e andM icrobial Techno logy,2004,35:494-500
[4] L i Pan,Guan Hong,L i Jin,et al.Hetero logous exp ression,pu rification,and characterization o f cytoch rom e P450sca-2 and m u tan ts w ith im p roved so lub ility in Escherich ia co li[J].Pro tein Exp ression and Pu rification,2009,65:196-203.
[5] L iu Zhu,Bartlow P,V arakala R,et al.U se of p ro teom ics fo r design o f a tailo red host cell fo r h igh ly efficien t p ro tein pu rification[J].Jou rnal of Ch rom atography A,2009,1 216:2 433-2 438.
[6] Sam ark ina O N,Popova A G.et al.U niversal and rap idm ethod fo r pu rification o f GFP-like p ro teins by the ethano l ex traction[J]. Pro tein Exp ression and pu rification,2009,65:108-113.
[7] 李步海,杨 波.吐温-80盐-水液-固萃取体系[J].科学通报,1990(3):192-194
[8] L aemm liU K.C leavage of structu ral p ro teins du ring the assem b ly o f the head o f bacteriophage T 4[J].N atu re,1970,227:680-685.
