红掌“亚丽桑娜”体细胞胚胎发生的探研
2010-01-25刘雪莲付志欣顾地周
刘雪莲,付志欣,顾地周
(通化师范学院 生物系,吉林 通化 134002)
亚丽桑娜(Arizona)是近年来从国外引进的优良观赏红掌花卉品种,是天南星科花烛属多年生常绿草本植物,又名安祖花、火鹤、花烛、灯台花等,是名贵的观赏花卉.红掌繁殖以分株为主,也可用扦插繁殖,但繁殖速度很慢,远不能满足日益增长的市场需求[1-4],因此很多学者尝试用组织培养的方法快速繁殖红掌幼苗.目前国内外关于红掌组织培养的研究报道较多,其中主要以研究培养基成分、外植体种类对红掌植株再生的影响[5-8]和通过愈伤组织途径快繁红掌幼苗的报道居多[9-12],而通过胚状体途径快繁红掌尚未见报道.本试验以亚丽桑娜红掌为试验材料通过胚状体途径快速繁殖红掌,可解决红掌组培过程中繁殖系数低、周期长等问题,为建立经济高效的红掌标准化种苗生产体系提供新途径.
1 材料与方法
材料处理:取温室中盆栽红掌苗新生嫩叶(卷曲)用洗洁精洗净,在超净工作台上用0.05%链霉素灭菌20min,然后用70%乙醇灭菌30s,用无菌水冲洗4~5次;将叶片切口处剪掉,用镊子接种到诱导培养基上进行培养.
胚性愈伤组织的诱导:诱导基本培养基为MS,激素2,4-D与6-BA的组合方案见表1.将消毒灭菌后的外植体,接种至诱导培养基中,每瓶接种3个,每个处理接种30个外植体,培养50d后统计胚性愈伤组织诱导率.
胚状体的诱导:试验方案见表2,将启动培养的胚性愈伤组织接种到胚状体诱导培养基中,培养35d后统计胚状体的发生率.
胚状体的成苗培养:试验方案见表3,将单株芽状突起(即完整的胚状体)接种至成苗培养基中,培养20d后统计其成苗率.
培养条件:培养基内添加琼脂粉6.4g/L,蔗糖30g/L,pH值5.8,培养温度25±2℃,光照强度2500Lx,光照时间为12h/d.
2 结果与分析
2.1 红掌胚性愈伤组织的诱导
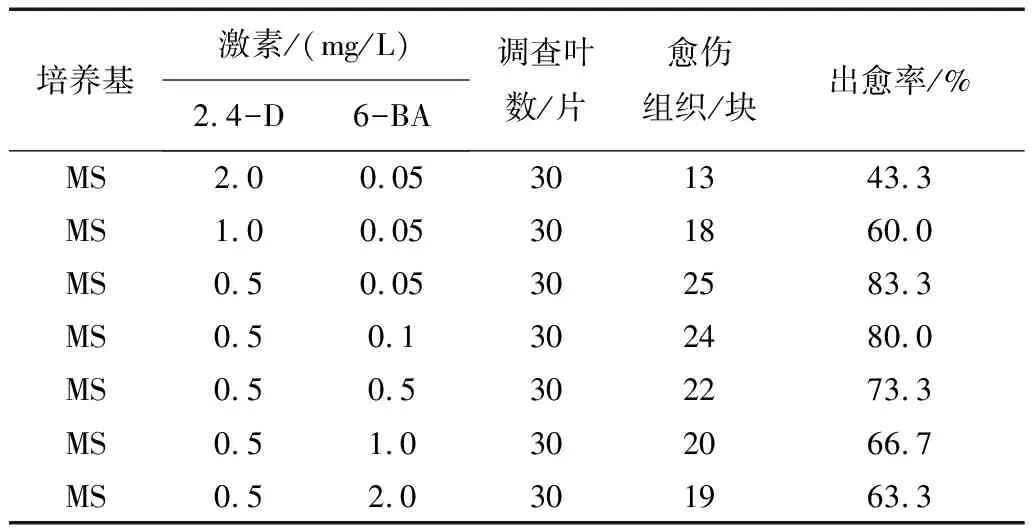
表1 不同培养基对红掌胚性愈伤组织诱导的影响
将无菌外植体接种到诱导培养基中培养,10d后外植体切口处开始膨大,叶片逐渐加厚,30d后叶片切口膨大处开始出现少量黄色胚性愈伤组织(图1),50d后统计不同培养基的诱导效果.由表1可知低浓度的2.4-D和低浓度的6-BA组合更利于红掌胚性愈伤组织的诱导,其中MS+2.4-D0.5mg/L+6-BA0.05mg/L培养基中幼叶胚性愈伤组织的诱导效果最好,出愈率高达83.3%,且生长状态良好,呈黄色,较松散.培养基MS+2.4-D0.5mg/L+6-BA0.1mg/L诱导效果次之.试验中发现高浓度的2.4-D能促进外植体迅速膨大,但出愈率较低,培养过程中外植体有死亡现象发生.
2.2 红掌胚状体的诱导

表2 不同培养基对红掌胚状体诱导的影响

图版说明:1.由幼叶诱导的胚性愈伤组织;2.胚性愈伤组织表面形成的瘤状组织;3.瘤状组织在扫描电镜下的形态;4~7.不同发育时期的胚状体(依次为球形胚、心形胚、鱼雷形胚、子叶形胚);8.瘤状组织发育成芽状突起(即完整的胚状体);9~10.由胚状体发育成的无菌苗;11~12.试管苗移栽.
在原培养基上反复继代几次后,胚性愈伤组织的数量不断增加,在其未转绿之前,将其转接到成胚培养基上继续培养,胚性愈伤组织生长迅速,逐渐由黄绿色向绿色转变,25d后胚性愈伤组织发育成瘤状颗粒组织(图2),将这些瘤状组织在扫描电镜下观察发现其为处在不同发育时期的胚状体(图3~7).不同培养基中瘤状组织发生的数量、速度、大小、质地及胚状体的发育时期均存在着显著差异.培养35d后进行统计和观察(见表2),结果发现6-BA浓度较低时,胚状体的发生速度较慢,发生率较低,瘤状组织少且小,胚状体的发育较慢多处在早期发育阶段;而6-BA浓度为0.5mg/L时,胚状体发生、发育的速度较快且发生率较高,多数处在心形胚和鱼雷形胚时期;而当6-BA浓度高于0.5mg/L时,胚状体的发生速度较快,但发生率较低,瘤状组织多但较瘦小,胚状体的生长发育受到抑制.继续培养时各培养基上的瘤状体进一步膨大形成芽状突起并发育成完整的胚状体(图8).综上所述,在本次试验中培养基MS+6-BA0.5mg/L最适合胚状体的发生,且用于胚状体的继代效果很好.
2.3 红掌胚状体的成苗培养
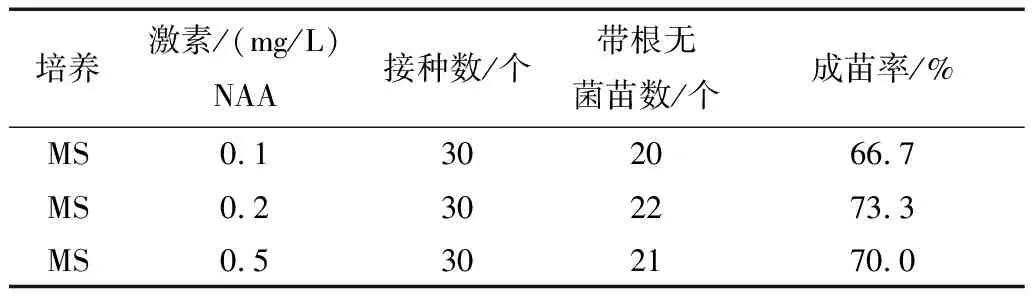
表3 不同培养基对红掌胚状体成苗的影响
诱导出的胚状体在原培养基上继续培养时可进一步发育成根苗俱全的无菌苗(图9、10),但需培养的时间较长,为提高繁殖速度可将胚状体单个分离下来接种到成苗培养基上培养.由表3可以看出,不同浓度的NAA对红掌胚状体的成苗率影响不是很大,但NAA浓度为0.2mg/L时成苗率较高为73.3%且植株生长健壮,因此,可在此培养基上进行成苗.红掌组培苗可在田园土、草炭、河沙按2:1:1比例配制的基质中驯化移栽,成活率可达85%以上(图11、12).
3 结论
通过体细胞胚胎发生途径来快速繁殖红掌有成苗率高、不需生根、繁殖周期短等特点,是红掌种苗快繁的好途径.本试验条件下不同激素浓度对红掌体细胞胚胎发生的影响很大,较低浓度的2.4-D有利于红掌胚性愈伤组织的诱导,而6-BA浓度的高低对胚性愈伤组织的诱导率影响不大,但对胚状体的诱导有很大的影响.试验表明最佳胚性愈伤组织诱导培养基为MS+2.4-D0.5mg/L+6-BA0.05mg/L;最适合胚状体发生的培养基为MS+6-BA0.5mg/L;在MS+NAA0.2mg/L培养基上能快速优质的成苗.
本试验利用电镜对胚性愈伤组织上的瘤状突起进行观察,证明其为不同发育阶段的胚状体,但胚状体具体发生过程及其内部的组织结构变化未能反映出来,因此,在今后应对此方面进一步加以研究.
参考文献:
[1]北京市花卉研究所.室内花卉—新引进的国外观叶植物[M].北京:中国经济出版社,1989:128-130.
[2]肖三元,梁国平.红掌组织培养及快速繁殖[J].云南热作科技,2000,23(2):12-13.
[3]张桂和,徐碧玉,彭存智,等.安祖花茎段培养与离体繁殖[J].上海农业学报,2001,17(3):13-16.
[4]夏春华.安祖花研究进展[J].热带农业科学,2000(3):49-53.
[5]黄萍萍.红掌快速繁殖技术研究[J].黎明职业大学学报,2004(1):59-61.
[6]PIERIK R L M. Callus multiplication of Anthurium andraenum lind in liquid media [J].Neth J Agric Sci,1975,23(4):299-302.
[7]兰芹英,仇玉萍,张远辉,等.不同红掌品种的叶片、叶柄和茎段愈伤组织的诱导及植株再生[J].西北植物学报,2003,23(6).
[8]陈华林.不同培养条件和外植体处理对红掌品种组培效果的影响[J].西南园艺,2003(4):35-37.
[9]潘学峰,潘梅,洪世军.红掌叶片愈伤组织的诱导与植株再生[J].海南大学学报,2000,18(1):144-149.
[10]江如蓝,张施君,郑迎冬,等.红掌的组织培养和快速繁殖[J].仲恺农业技术学院学报,2002,15(4):49-53.
[11]肖三元,梁国平,杨焱,等.红掌不同品种产生愈伤组织的差异[J].热带农业科技,2005,28(2):7-9.
[12]蔡维藩.红掌组织培养与快速繁殖[J].亚热带植物科学,2002,31(3):66-68.
