结核分枝杆菌对左氧氟沙星与莫西沙星的交叉耐药性及gyrA和gyrB基因突变分析
2010-01-24李国利陈澎孙昌文张灵霞李邦印赵雁林
李国利 陈澎 孙昌文 张灵霞 李邦印 赵雁林
(1.解放军第309医院结核病研究室 北京 100091;2.北京市结核病胸部肿瘤研究所 北京 101149)
在世界范围内,结核病仍然是严重危害人民身体健康的传染病之一。近年来,耐药结核分枝杆菌(M ycobacterium tuberculosis,M TB)菌株,特别是耐多药(m ultidrug-resistant,MDR)和广泛耐药(extensively drug-resistant,XDR)M TB菌株的出现和传播,严重威胁着结核病的控制。
氟喹诺酮类(Fluoroquinolones,FQs)药物是重要的二线抗结核药物,应用于耐药和MDR结核病的治疗[1]。随着该类药物应用的增加,临床上对该类药物的耐药率升高,我国全国结核病耐药基线调查报告(2007—2009年)[2]中报导MDR结核病患者中氧氟沙星(Ofloxacin,.OFX)耐药率高达27.43%。左氧氟沙星(levofloxacin,LVF)和莫西沙星(moxifloxacin,M XF)是耐药结核病治疗中主要的 FQs药物,甚至被 WHO推荐为耐OFX的MDR结核病的治疗[3]。本文通过检测M TB临床分离菌株LVF和 M XF的最低抑菌浓度(minimal inhibition concentration,M IC),并进行 gyrA和gyrB基因 FQs药物耐药决定区DNA测序,研究LV F与M IX之间的交叉耐药,分析gyrA和gyrB基因突变位点分布及突变位点与耐药水平的关系,为临床用药、为建立M TB FQs药物敏感性快速基因检测方法及结果分析提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 本室保存的M TB标准菌株 H37Rv(A TCC 27294)和 2006—2009年间收集的 121株M TB临床分离菌株。经改良罗氏培养基比例法药物敏感性试验[4]获得 INH、PFP、SM、EMB、KM、LVF对M TB菌株的药物敏感性结果。LVF耐药界限定在>1μg/m l[5],66株为LV F耐药的M TB菌株,其中12株为耐LVF的多耐药(poly-resistance,PR)M TB菌株,33株为耐LVF的MDR-M TB菌株,21株为LVF耐药的 XDR-M TB菌株;25株为LV F敏感的PR-M TB和MDR-M TB菌株;30株为全敏感M TB菌株(表1)。
1.1.2 药物 盐酸LV F,上海长征富民金山制药有限公司产品,批号09040602;盐酸 M XF,拜耳医药保健股份公司产品,批号BXFA T1B 11。
1.1.3 培养基 改良罗氏培养基和含药改良罗氏培养基由本室自制。含药培养基药物终浓度分别为:LVF 0.5、1.0、2.0、4.0、8.0、16、32μg/m l,M XF 0.25、0.5、1.0、2.0、4.0、8.0、16μg/m l。
1.1.4 PCR引物 引物 gyrA-F5′-GA TGACAGACACGACGTTGC-3′和 gyrA-R 5′GGGCTTCGGTGTACCTCA T-3′,扩增 398 bp gyrA 基因片段 ;引 物 gyrB-F5′-CCACCGACGCGAAAGTC-3′和 gyrB-R-5′-CTGCCACTTGAGTTTGTACA-3′,扩增524 bp gyrB基因片段。引物由北京六合华大基因科技股份有限公司合成。
1.2 方法
1.2.1 M IC检测 刮取适量在改良罗氏培养基上传代培养3周龄生长良好的M TB H37Rv菌株和M TB临床分离菌株培养物,在带玻璃珠无菌0.5%吐温80-生理盐水试管内磨菌制备菌悬液,振荡2~3min后,室温静置15~20 min,取上层液体稀释制备1mg/m l(MacFarland No.1)菌悬液。将1 mg/m l菌悬液10倍倍比稀释至10-2mg/m l,分别接种于含药培养基和不含药对照培养基斜面上,接种菌终浓度为10-3mg/m l。置37℃培养4周后观察结果。不含药对照管生长旺盛,以不含肉眼可见菌落或菌落数少于1%的药物浓度最低管为M IC。
1.2.2 DNA提取及PCR扩增 刮取在改良罗氏培养基上传代培养3周龄生长良好的M TB H37Rv菌株和M TB临床分离菌株培养物,采用OM EGA公司Bacterial DNA Kit按说明书抽提DNA,-20℃保存备用。
在30μl PCR反应体系内,引物gyrA-F和引物gyrA-R(或引物gyrB-F和引物gyrB-R)终浓度各为0.2μmol/L,dA TP、dCTP、dGTP和 d TTP终浓度各为0.2 mmol/L,Taq DNA聚合酶1μ,10×PCR缓冲液3.0μl,DNA模板1~5 ng,加去离子水至30μl。置 PCR扩增仪内,扩增条件为94℃变性5 m in后,94℃1 min、57 ℃1 m in(gyrA基因)或42℃1 m in(gyrB基因)和72℃1 m in循环35次,72℃延伸7min。2%琼脂糖凝胶电泳检测扩增产物。1.2.3 DNA测序 PCR产物由北京六合华大基因科技股份有限公司纯化、应用双脱氧链终止法在ABI3730 XL全自动测序仪上测序。应用DNASTAR Lasergene.Ⅴ7.1生物医学软件进行序列分析。
2 结果
2.1 M IC结果
2.1.1 M TB标准菌株 H37Rv的 M IC LVF和M XF的 M IC分别为≤0.5μg/m l和≤0.25μg/m l。
2.1.2 30株全敏感M TB菌株的M IC 30株中,29株LVF和M XF的M IC分别为≤0.5μg/m l和≤0.25μg/ml;1株分别为1.0μg/ml和≤0.25μg/ml。
2.1.3 25株LV F敏感的PR和MDR-M TB菌株的M IC 25株中,18株LV F和M XF的M IC分别为 ≤0.5μg/m l和 ≤0.25μg/m l;4株分别为1.0μg/m l和 0.5μg/m l;3株分别为 1.0μg/m l和0.25μg/m l(表 1)。

表1 结核分枝杆菌临床分离株LVF与MXF的M IC和gyrA与gyrB基因突变位点a
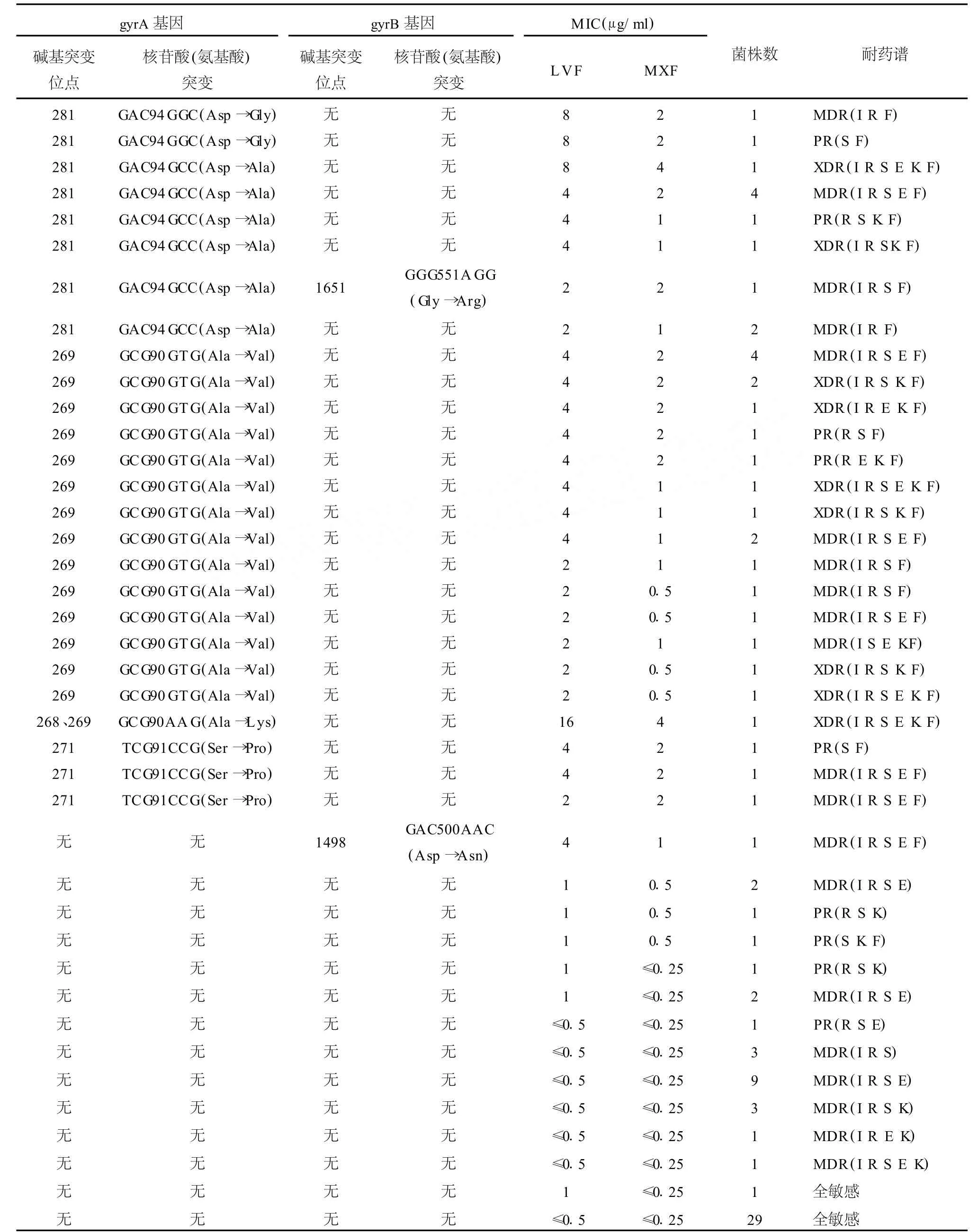
续表1
2.1.4 66株LV F耐药的 PR、MDR和 XDR-M TB菌株的M IC 66株中,6株LVF和M XF的M IC分别为16μg/m l和8.0μg/m l;2株分别为16μg/m l和4.0μg/m l;1株分别为 8.0μg/m l和 8.0μg/m l;18株分别为8.0μg/m l和4.0μg/m l;5株分别为8.0μg/m l和2.0μg/m l;17株分别为4.0μg/m l和2.0μg/m l;7株分别为4.0μg/m l和1.0μg/m l;2株分别为2.0μg/m l和2.0μg/m l;4株分别为2.0μg/m l和1.0μg/m l;4株分别为 2.0μg/m l和0.5μg/m l(表 1)。
2.2 DNA测序结果
2.2.1 M TB标准菌株 H37Rv测序结果 与genebank报导的M TB标准菌株 H37Rv序列比对,未见基因突变。
2.2.2 30株全敏感M TB菌株和25株LV F敏感的PR-M TB菌株、MDR-M TB菌株测序结果 所有菌株除均有gyrA基因95位密码子AGC→ACC(Ser→Thr)突变外,所测gyrA和gyrB基因序列与M TB标准株 H37Rv序列比对,未见其他突变。
2.2.3 66株LVF耐药的 PR、MDR和 XDR-M TB菌株测序结果 所有菌株均可见gyrA AGC95ACC(Ser→Thr)突变。66株LVF耐药菌株中,7株(10.6%)gyrA GAC94AAC(A sp →A sn)、22株(33.3%)gyrA GAC94GGC(A sp→Gly)、9株(13.6%)gyrA GAC94GCC(A sp→A la)、1株(1.5%)gyrA GAC94CAC(A sp→His)和 1株(1.5%)gyrA GAC94TAC(Asp→Tyr)突变;3株(4.6%)gyrA TCG91CCG(Ser→Pro)突变;19株(28.8%)gyrA GCG90GTG(A la→Val)突变;1株(1.5%)gyrA GCG90AAG(A la→Lys)突变;1株(1.5%)gyrB GAC500AAC(A sp→A sn)突变。2株(3.0%)gyrA GAC94(AAC或 GCC)(Asp→Asn或A la)和gyrB GGG551A GG(Gly→A rg)双位点突变。其余菌株未见gyrB基因突变(表1)。
3 讨论
FQs药物在试管内和体内具有良好的抗M TB作用,对巨噬细胞内外M TB均有抗菌活性,较高级的FQs药物抗菌活性高于较低级的FQs药物[6-7]。通常认为FQs药物间存在交叉耐药[8],但较低级的FQs药物与较高级 FQs药物间的交叉耐药程度不完全清楚。较低级的FQs药物耐药后,还能选用较高级的FQs药物吗?本研究中66株耐LV F M TB临床分离株中,8株LVF的M IC为16μg/m l,M XF的 M IC为 8μg/m l或 4μg/m l;23株LV F的 M IC为8.0μg/m l,M XF的M IC为4μg/m l或2μg/m l;1株 LVF和 M XF的 M IC均为 8.0μg/m l;24株LVF的 M IC为4.0μg/m l,M XF的 M IC为 2μg/m l或 1μg/m l;2株 LV F和 M XF的 M IC均为2.0μg/m l;4株LV F的 M IC为 2.0μg/m l,M XF的M IC为1.0μg/m l;4株LVF的M IC为2.0μg/m l,M XF的 M IC为0.5μg/m l;结果显示 M XF与LVF的M IC变化存在正相关关系,M XF M IC随LV F M IC增高而增高,LV F与M XF间存在交叉耐药性。有文献报导[9]口服400mg M XF,Cmax值3.2~4.5μg/m l,在肺泡上皮细胞衬液为5.95μg/m l,在肺泡巨噬细胞内为54.15μg/m l。本研究结果表明LV F M IC值是M XF M IC值的2~4倍,M XF抗M TB菌株的活性是LVF的2~4倍。由于M XF较高的抗M TB菌株的活性,对那些LV F低耐药 MDR-M TB菌株或 XDR-M TB菌株,当LVFM IC≤4.0μg/m l,M XF M IC ≤1.0μg/m l,特别是当M XFM IC≤0.5μg/m l时,则有可能考虑用M XF替代LV F用于化疗。但在化疗过程中,建议检测M TB菌株的M IC值,如果有条件应同时检测病人的血药浓度,以更好的指导临床用药。
FQs药物作用于M TB的主要靶位点是DNA旋转酶,通过抑制DNA酶的活性,使DNA复制停止,导致细菌死亡。DNA旋转酶由A、B 2个亚基组成,编码A、B亚基的 gyrA、gyrB基因耐药决定区核苷酸突变是引起FQs药物耐药的主要机制。
文献报导[10-16]FQs药物耐药菌株基因突变主要发生在gyrA基因,gyrB基因发生突变频率比gyrA基因低的多。本文的测序结果可见已报导的gyrA 90位、91位、94位密码子的所有单碱基突变形式,同时发现一个新的与耐药相关的 gyrA GCG90AAG双碱基突变形式;仅1株gyrB可见已报导的 GAC500AAC突变,还发现一个新的gyrB GGG551AGG突变,该突变位点与gyrA 94位密码子双位点突变,其在耐药中的作用还需进一步研究;所测序的30株全敏感M TB菌株、25株LVF敏感的PR-M TB和MDR-M TB菌株和66株LVF耐药的 PR、MDR和 XDR-M TB菌株均可见 gyrA AGC95ACC(Ser→Thr)突变,可能是 M TB临床分离菌株95位密码子存在自然遗传多态性,而与FQs药物耐药无关[9]。除上述突变外,本文未发现已报导的gyrA 70位、83位、87位、88位、89位密码子和gyrB 485位、486位、509位、538位、539位、540位、543位密码子的突变,可能是这些位点突变发生频率本身就低或是与耐药菌株的地理区域分布有关。GyrA基因90位、91位、94位和 88位突变作为FQs耐药分子标记在M TB FQs药物敏感性快速基因检测方法中得到应用[10,17],gyrA基因其他位点和 GyrB基因突变虽比例较低,但也应引起重视。
对所测gyrA基因序列分析后,我们发现了一个有意义的现象,耐药程度可能与突变位点有关。在30株gyrA GAC94(AAC或 GGC)(A sp→A sn或 Gly)突变菌株中,28株(93.3)LVF M IC 16μg/m l或8.0μg/m l,其相对应菌株 M XF M IC 8.0μg/m l或4.0μg/m l为 23株(82.1%),2.0μg/m l为 5株 (17.9%)。在29株gyrA GAC94GCC(A sp→A la)或gyrA GCG90GTG(A la→Aal)突变菌株中,28株(96.6%)LVF M IC为 4.0μg/m l或 2.0μg/m l,其相对应菌株M XF M IC为2.0μg/m l为14株(50.0%)、1.0μg/m l为 10株 (35.7%)、0.5μg/m l为4株(14.3%)。结果初步表明gyrA GAC94AAC(A sp→A sn)、GAC94GGC(A sp→Gly)突变可能引起FQs药物较高水平耐药;gyrA GAC94GCC(A sp→A la)、gyrA GCG90GTG(A la→Aal)突变可能引起FQs药物较低水平耐药。对于本研究出现频率较低的突变位点,由于菌株数量较少,则难以进行分析。这只是一个初步的结果,需扩大样本的检测量,进一步筛选gyrA,特别是gyrB FQs药物耐药相关的突变位点、研究突变位点与耐药水平的关系,为建立快速检测M TB FQs药物敏感性基因检测方法提供可靠的分子标志,同时有可能根据基因突变的位点分析耐药水平,以满足临床快速耐药性诊断和治疗的需要。
[1]Kant S,Maurya AK,Kushwaha R.A.S,Nag VL,Prasad R.M ulti-drug resistant tuberculosis:An iatrogenic p roblem[J].Bio Science Trends,2010,4(2):48-55.
[2]中华人民共和国卫生部.全国结核病耐药基线调查报告(2007—2008年)[M].北京:人民卫生出版社,2010:49-51.
[3]W HO.Guidelines for the Programmatic M anagement of D rugresistant Tuberculosis Geneva:World Health Organization.2008.WHO/HTM/TB 2004.402.
[4]中国防痨协会基础专业委员会.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:51.
[5]Wang JY,Lee LN,Lai HC,Wang SH,Jan IS,YU CJ,Hsueh PR,Yang PC.Fluoroquinolone resistance in M ycobacterium tuberculosis isolates:associated genetic mutations and relationship to antimicrobial exposure[J].J Antimicrob Chemother,2007,59:860-865.
[6]ScienceDrect.Lveofloxacin[J].Tubercl,2008,88(2):119-121.
[7]Shandil RK,Jayaram R,Kaur P,Gaonkar S,Suresh BL,Mahesh BN,Jayashree R,Nandi V,Bharath S,Balasubramanian V.Moxifloxacin,ofloxacin,sparfloxacin,and cip rofloxacin against mycobacterium tuberculosis:evaluation of in vitro and pharmacodynamic indices that best p redict in vivo efficacy[J].Antimicob Agents Chemother,2007,51(2):576-582.
[8]Davasia RA,Blackman A,May C,Eden S,Smith T,Hooper N,Maruri F,Stratton C,Shintani A,Sterling TR.Fluoroquin olone resistance in mycobacterium tuberculosis:an assessment of M GIT 960,MODSand Nitrate reductase assay and fluroquinolone cross-resistance[J].J Antimicrob Chemother,2009,63:1173-1178.
[9]Roder Guez JC,Cebri NL,Lpez M,Royo G.Mm tant p revention concentration:comparison of fluoquinolone and linezolid with M ycobacterium tuberculosis[J].J Antimicrob Chemother,2004,53(2):441-444.
[10]Giannoni F,Iona E,Sementilli F,Brunori L,Pardini M,Migliori GB,Orefici G,Fattorini L..Evaluation of a new line p robe assay for rapid identification of gyrA mutation in mycobacterium tuberculosis[J].Antimicob Agents Chemother,2005,49(7):2928-2933.
[11]Pitakasjjakul P,Wongw it W,Punorasit W,Eampokalap B,Peacock S,Ramasoota P.M utations in the gyrA and gyrB genes of fluoroquinolone-resistant mycobacterium tuberculosis from TB patients in Thailand[J].Southeast Asian J Trop Med Public Health,2005,36(4):228-237.
[12]Mokrousov I,Otten T,Manicheva O,Potapova Y,Vishnevsky B,Narvskaya O,Rastogi N.Molecular characterization of ofloxiacin-resistant M ycobacterium tuberculosis strains from Russia[J].Antimicob Agents Chemother,2008,52(8):2937-2939.
[13]Feuerriegel S,Cox HS,Zarkua N,Karimovich HA,Braker K,Rüsch-Gerdes S,Niemann S.Sequence analyses of just four genes to detect extensively drug-resistant M ycobacterium tuberculosis strains in multidrug-resistant tuberculosis patients undergoing treatment[J].Antimicrob Agents Chemother,2009,53(8):3353-3356.
[14]Groll AV,Martin A,Jureen P,Hoffiner S,Vandamme P,Portaels F,Palomino JC,Silva PAD.Fluoroquinolone resistance in mycobacterium tuberculosis and mutations in gyrA and gyrB[J].Antimicrob Agents Chemother,2009,53(10):4498-4500.
[15]An DD,Duyen NTH,Lan N TN,Hoa DV,Ha DTM,Sy DN,Farrar J,Caw s M.Beijing genotype of M ycobacterium tuberculosis is significantly associated with-level fluoroquinolone resistance in Vietnam[J].Antimicrob Agents Chemother,2009,53(11):4835-4839.
[16]Yin X,Yu Z.Mutation Characterization of gyrA and gyrB genes in Levofloxacin-resistant mycobacterium tuberculosis clinical isolates from Guangdong p rovince in China[J].J Infect,2010,61(2):150-154.
[17]Hillemann D,Rüsch-Gerdes S,Richter E.Feasibility of The Geno Type M TBDRs/assay for fluoroquinolone,Amikacin-Cap reomycin,and Ethambutol resistance testing of mycobacterium tuberculosis strains and clinical specimens[J].J Clin Microbiol,2009,47(6):1767-1772.
