结核分枝杆菌Rv2352c基因的克隆表达及其抗原活性鉴定
2010-01-24曹廷明贾红彦古淑香郑晓静李自慧杜凤娇刘洋刘忠泉邢爱英杜博平马玙张宗德
曹廷明 贾红彦 古淑香 郑晓静 李自慧 杜凤娇 刘洋 刘忠泉 邢爱英 杜博平 马玙 张宗德
(北京市结核病胸部肿瘤研究所 北京 101149)
结核病是单一致病菌引起成年人死亡的主要原因,据世界卫生组织估计每年全球约有900万新发病例,300万人死亡,死亡人数居单一传染病之首[1]。缺乏针对结核病的早期、快速、灵敏、特异的诊断技术仍然困扰着结核病防控工作。目前,结核病的诊断在诊断标志物和诊断技术等方面还存在很多空白。随着现代分子生物学特别是生物信息学、基因组学、蛋白质组学的快速发展,为开发新的结核病诊断标志物和诊断技术提供了可能和极大的便利。结核分枝杆菌Rv2352c基因是本课题组利用生物信息学和比较基因组学等方法筛选出来的特异性基因之一。2008年9月本研究构建了Rv2352c基因的高效原核表达载体,表达获得目的蛋白,并对Rv2352c蛋白的抗原性进行了研究,旨在为结核病的诊断和防治的靶抗原筛选奠定基础。
1 资料与方法
1.1 菌株与质粒 质粒p GEM?-T Easy购自p romega公司、p ET30a(+)由病毒所李琳琳博士惠赠。宿主菌DH5α、BL21(DE3)购自北京鼎国生物公司。结核分枝杆菌标准株(H37Rv)为本研究室保存。
1.2 主要试剂 TaqDNA聚合酶、His-tag Antibody、DNA及蛋白质分子量标准购自北京天根时代生物公司。Amp、Kan、IPTG及尿素购自北京鼎国生物公司。限制性内切酶Bam H I、Xho I及 T4 DNA连接酶购自NEB公司。胶回收试剂盒、质粒提取试剂盒均由Q IA GEN生物工程公司提供。硝酸纤德维素膜(NC)、HRP标记的羊抗兔 IgG、HRP标记的羊抗小鼠 IgG、HRP标记的羊抗人 IgG、IgM、IgA及DAB显色试剂,购自武汉博士德公司。Ni-N TA蛋白纯化树脂购自 Novagen公司。蛋白定量试剂盒购于普利莱基因技术有限公司。
1.3 引物设计 根据 Genebank公布的结核分枝杆菌Rv2352c全基因序列设计如下引物,上游:5′-CGGGA TCCGGTGGTGGTA TGA TTTTGGA TTTTTCGTGG-3′,含 Bam H I酶切位点 ;下游 :5′-CCGCTCGA GTCCGA TCCCGACCCGCGG-3′, 含Xho I酶切位点。相关引物均由北京赛百盛基因技术有限公司合成。
1.4 Rv2352c基因的扩增及产物的纯化 以结核分枝杆菌 H37Rv菌株的基因组DNA为模板,采用PCR方法扩增得到 Rv2352c基因片段。100 ul PCR反应体系中加入:2 ul模板,6 ul dN TP(各2.5mmol/L),10 ul Buffer(10X),1 ul上游引物,1 ul下游引物,0.5 ul(5 unit/ul)聚合酶,79.5 ul ddH2O;PCR反应条件:95℃5 min,94℃45S,60℃45S,72℃2m in,72℃10m in,反应循环数为30。PCR产物进行1%琼脂糖凝胶电泳分析,并以琼脂糖凝胶DNA回收试剂盒进行纯化,操作方法按照产品说明书进行。
1.5 重组表达载体p ET30a(+):rv2352c的构建及鉴定 将目的基因的 PCR产物和表达载体(p ET30a)用限制性内切酶Bam H I和 Xho I分别进行双酶切,琼脂糖凝胶电泳法回收纯化含粘性末端的rv2352c DNA片段及p ET30a(+)5 500 bp的大片段酶切产物,构建p ET30a(+):rv2352c重组体;转化DH 5α感受态细胞,用含30mg/L Kan的LB固体培养基筛选重组子。对挑取的重组载体进行Bam HⅠ和XhoⅠ双酶切鉴定,得到有正确插入片段的克隆,随后对双酶切验证正确的克隆进行测序,测序检验正确后,将阳性重组载体转化大肠杆菌BL 21(DE3)。
1.6 重组质粒的诱导表达及表达形式 挑取含重组质粒的大肠杆菌BL21(DE3)单菌落,并接种2m l LB培养基中,37℃过夜培养,随后以1∶50的比例将过夜培养菌重新接种于LB培养基中,37℃培养至OD600=0.6~0.8左右时,用终浓度为0.8mM的IPTG进行诱导,37℃,200转/min培养3 h,随后收集菌体,将收集的菌体沉淀用30~100μl 10 mM Tris-HCl(p H 8.0)缓冲液吹散(加入缓冲液的量视菌体量而定),加入与缓冲液等体积的2×溴酚蓝Buffer,100℃煮5 m in,进行 SDS-PA GE电泳检测。另取100μl超声(500W,30次,每次10 s,间隔15 s)后的菌悬液,13 000转/m in,离心10m in,取50 μl上清至另一 EP管,加 50μl 2×溴酚蓝Buffer,100℃煮5 min,电泳,上清去除干净后沉淀用50μl 10mM Tris-HCl(p H 8.0)溶液吹散,加入50μl 2×溴酚蓝Buffer,100℃煮5 m in,SDS-PA GE电泳。
1.7 目的蛋白的纯化及鉴定 挑选有表达的克隆,接1~2μl活化的菌液到250m l LB液体培养基中,37℃,200转/min,过夜培养。第2 d取过夜培养的250 m l菌液与等体积LB液体培养基混合,37℃,200转/min,培养至 OD=0.6~0.8,IPTG诱导(125μl(0.8M)IPTG/250 m l菌液),2.5 h后收菌。大量收菌:用400 m l大离心筒,6 000转/min,离心5m in。弃上清。超声破菌:沉淀用20~30 m l 10 mM Tris-HCl(p H 8.0)溶液吹散,超声。收集超声离心后上清和沉淀。Ni柱纯化:用纯水洗柱,至p H 7.0。挂镍,至p H 2~3。纯水洗柱至p H 7.0。10 mM Tris-HCl(p H 8.0)溶液平衡镍柱,约 100 m l。含0.5M氯化钠的10 mM Tris-HCl(p H 8.0)溶液平衡镍柱,约50 m l。含8M尿素,0.5M氯化钠的10mM Tris-HCl(p H 8.0)溶液平衡镍柱,约50 m l。稀释样品(沉淀)上样。样品需要事先加入氯化钠,终浓度为0.5M。上样结束后,用含8M尿素,0.5M氯化钠的10 mM Tris-HCl(p H 8.0)溶液洗柱。分别用含15mM咪唑、60mM咪唑、500mM咪唑的10 mM Tris-HCl(p H 8.0)(含8M尿素、0.5M氯化钠的)溶液洗脱,分别收集蛋白峰。SDS-PAGE电泳检测蛋白纯化效果。
1.8 目的蛋白的抗原性鉴定 采用Western blot法:将重组蛋白进行SDS-PA GE,随后以100 m A稳流电转1.5 h,将凝胶上的蛋白质转印到 PVDF膜上,用封闭液(5%脱脂奶粉)室温封闭2 h,PBST洗膜3次,每次5min。将PVDF膜浸于1∶100稀释的结核病人血清中室温孵育2 h,洗膜3次后,再与1∶2 500的 HRP标记的羊抗人 IgG室温反应1 h,洗膜同上。最后,将PVDF膜浸入DAB显色液中染色,以蒸馏水冲洗终止反应。
1.9 Rv2352c的多克隆抗体的制备及鉴定 取体质量2~3 kg的2只新西兰白兔,皮下初次免疫免疫剂量为200 ug蛋白/只,2周后再进行连续3次加强免疫,加强免疫的时间间隔为1周,加强免疫的剂量为为200μg蛋白/只。最后1次加强免疫两周之后,耳静脉取血,采用间接 ELSIA法进行效价测定,随后颈动脉取血,离心收集多抗血清,共收集60m l,即Rv2352c蛋白相应的兔抗血清。将获得的抗血清用结合缓冲液(100 mmol/L Tris-HCL,p H 7.5 100mmol/L NaCl)稀释后,经过0.45μm的滤膜过滤,加样到IgG亲和层析柱中,用洗脱缓冲液(100 mmol/L甘氨酸-HCL,p H 2.5)洗脱后,收集洗脱峰。以本课题组前面制备的 Rv2352c蛋白作为抗原,进行 Western blo t检测,一抗为 1∶2 000稀释的Rv2352c多克隆抗体,二抗为1∶5 000稀释的HRP标记的羊抗兔IgG,ECL法(增强化学发光法)检测。
2 结果
2.1 结核分枝杆菌rv2352c基因的扩增及表达载体的构建 在Genebank数据库中获得结核分枝杆菌rv2352c基因序列,以PCR方法扩增1 176 bp大小的rv2352c基因产物(图1)。
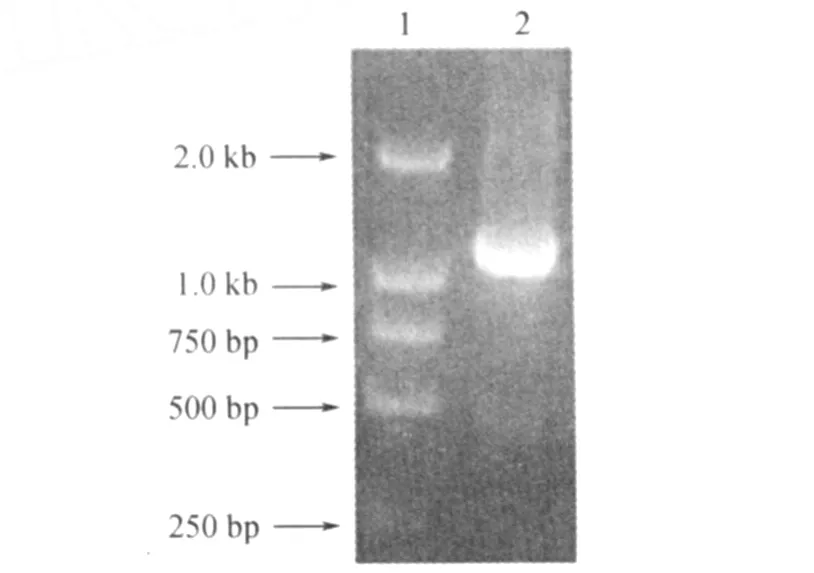
图1 rv2352c基因的PCR产物
将获得的构建p ET30a(+):rv2352c阳性重组体用限制性内切酶Bam HⅠ和XhoⅠ分别进行双酶切,双酶切图谱显示其中的一个片段大小与目的基因相似(图2)。对双酶切验证正确的阳性克隆进行测序,测序结果证实p ET30a(+):rv2352c构建成功。

图2 p ET30a(+):rv2352c的酶切鉴定
2.2 重组蛋白 Rv2352c在大肠杆菌BL 21(DE3)中的表达和纯化 将阳性重组载体p ET30a(+):rv2352c转化大肠杆菌BL 21(DE3),挑选有表达的克隆并进一步培养,制备培养菌的蛋白提取物,并分为上清液和沉淀物 2个部分。进一步的 SDSPAGE电泳结果显示,rv2352c重组表达蛋白主要在沉淀物中(图3),说明表达的重组蛋白以不溶性包涵体形式存在于胞质中。

图3 重组蛋白在BL21(DE3)菌中表达的SDS-PAGE鉴定
用Ni柱纯化重组蛋白的提取物,收集纯化产物,随后的SDS-PA GE电泳结果显示已经获得较高纯度的重组蛋白Rv2352c(图4)。

图4 Ni柱纯化重组蛋白收集物纯度的SDS-PAGE电泳鉴定
2.3 重组蛋白 Rv2352c的抗原性鉴定 重组蛋白Rv2352c可与结核病人血清在大约45 kD处,产生特异性免疫反应条带(图5)。提示该蛋白具有抗原性,在其宿主人体内很可能存在相对应的抗体。
2.4 重组蛋白 Rv2352c抗血清的效价测定及其多克隆抗体特异性鉴定 采用间接 ELSIA法对重组蛋白Rv2352c抗血清的效价进行测定,测定结果表明获得了高效价的抗 Rv2352c多克隆抗体,兔抗血清的滴度高达1∶25 600(图6)。
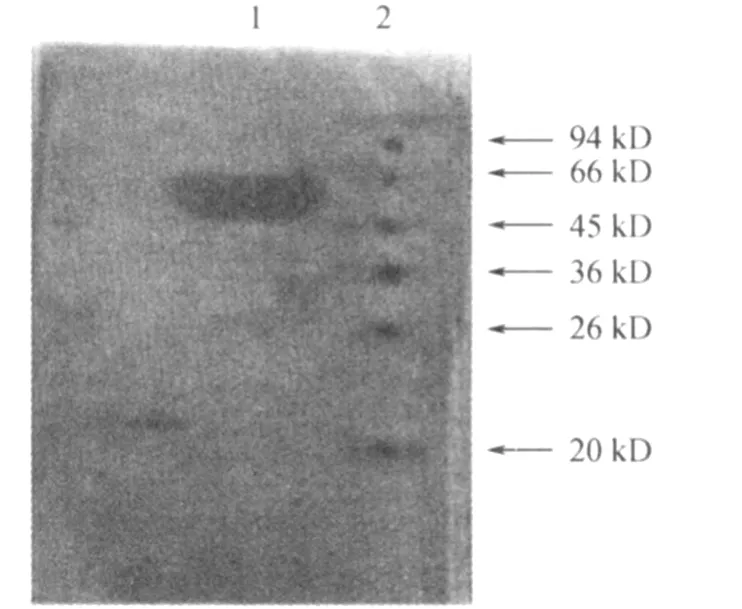
图5 Rv2352c与结核病人血清进行蛋白免疫印记分析
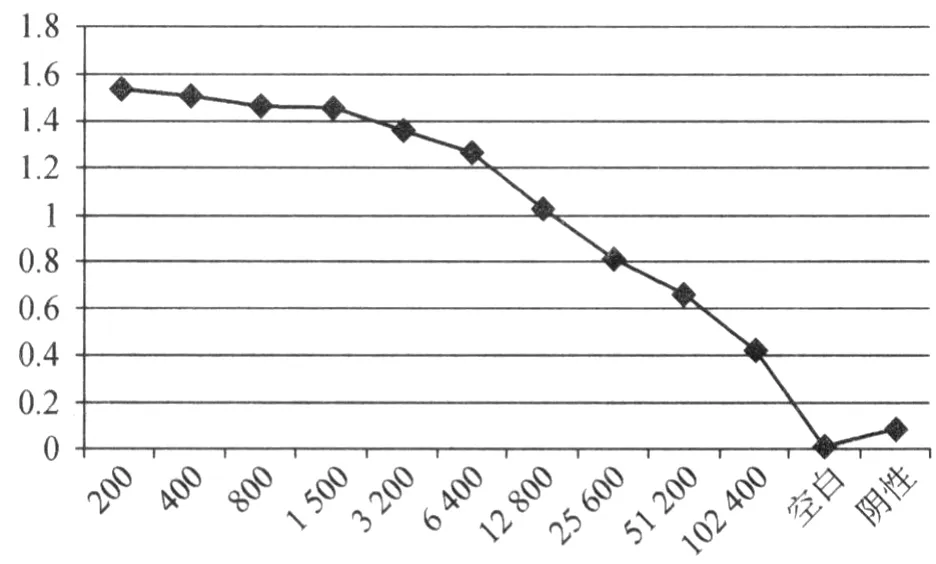
图6 Rv2352c的免抗血清的效价测定
将重组蛋白 Rv2352c抗血清用 IgG亲和层析柱进行纯化,获得重组蛋白Rv2352c的纯化多克隆抗体,随后进行Western blot的检测结果证实此多克隆抗体能够与重组蛋白Rv2352c进行免疫反应,条带位置与纯化的Rv2352c重组蛋白一致,说明此抗体能够特异性的与 Rv2352c重组蛋白发生免疫反应,可能能够用于检测结核分枝杆菌中的Rv2352c蛋白(图 7)。
3 讨论
近年来,由于多重原因造成结核病重新流行,再次成为严重的公共健康问题;特别是艾滋病和结核病的合并感染以及耐药结核病感染者持续增多,使得这一形势更加恶化,给结核病的防治带来新的挑战[2],结核病的基础和临床越来越受到世界各国的重视。长期以来,由于缺乏快速、敏感的结核病诊断技术和方法,使得难以及时筛选出结核病的潜伏感染病例和早期病例,造成结核病人漏诊、诊断时间延长或误诊,使结核病不断传播。现有的诊断方法不能满足结核病预防、控制的需要,因此迫切需要开发研制出新型快速、灵敏、特异的结核病诊断方法和技术。

图7 Rv2352c与其多抗的Western blot
经过长期的演化,结核分枝杆菌已进化为非常成功的一种致病菌。结核分枝杆菌通过呼吸道进入人体后,侵入肺泡的结核分枝杆菌被吞噬细胞吞噬,结核分枝杆菌主要寄生于巨噬细胞内,并通过其逃逸机制逃避免疫杀伤,在巨噬细胞内长期存活而造成持留(persist)[3]。结核分枝杆菌从进入宿主细胞,直至宿主发病的过程中,激发了宿主机体的强免疫反应,同时其通过调节宿主的免疫系统的平衡,使之更加适合于其在宿主体内寄生,导致宿主发病,甚至导致宿主死亡。为了准确的诊断结核病,除了检测结核分枝杆菌所导致的明显肺部病变特征外,另外主要还是靠实验室诊断来检测宿主体内是否存在结核分枝杆菌以及其所激发的免疫反应特征,并最终确诊宿主是否患了结核病及患病程度。结核病的实验室诊断目前除抗酸杆菌涂片法、结核菌培养法外,应用较多的是利用核酸探针杂交和PCR扩增等技术对结核分枝杆菌特异性DNA序列进行检测,利用抗原-抗体反应对结核分枝杆菌特异性蛋白质和多肽进行检测,EL ISPO T诊断技术、全血 IFNγ检测方法和其他细胞因子检测方法等[4],新的检测结核的诊断方法和技术还在不断的涌现[5],但仍然缺乏快速、准确的结核病诊断方法[6]。目前作为被检目标的结核菌特异性抗原主要有脂阿拉伯甘露糖抗 原[7]、38 kD[8]、ESA T6[9],CFP10,M PT64,PstsS1,Ag85B,rpoB,M r90等,但基于这些特异性抗原的诊断方法的灵敏度、特异性仍然不能够达到理想的要求,结核病诊断方法和技术的敏感性和特异性均直接取决于目标分子的特异性,目标分子特异性的高低直接影响结核检测结果的可靠性和准确性。筛选和鉴定新的特异性的目标分子作为诊断结核病的标靶仍是开发新的诊断技术的关键。
结核分枝杆菌Rv2352c基因是本课题组利用生物信息学和比较基因组学等方法筛选出来的特异性基因之一。目前对 Rv2352c基因进行的研究报道还很少。本实验构建了 Rv2352c的原核表达质粒。所用质粒PET30 a(+)是一种融合型蛋白的表达载体,通过在编码的外源蛋白的N端构建6个组氨酸残基,利用Ni-N TA树脂可方便地将外源蛋白从菌体蛋白中纯化出来。SDS-PA GE电泳分析发现,在45 kD左右出现一条明显的蛋白条带且与目标蛋白的分子量大小一致,即为Rv2352c蛋白。将目的蛋白纯化后免疫新西兰大白兔,能够激发新西兰大白兔产生高滴度的抗体反应,收集兔抗结核分枝杆菌Rv2352c抗血清,并通过亲和层析法纯化获得对应的多克隆抗体;对Rv2352c重组蛋白进行免疫印记分析,结果显示此重组蛋白不仅能够与结核病人的血清发生免疫反应,同时也能够与其兔抗血清发生免疫反应,这说明Rv2352c蛋白既有较好的免疫反应性也有很好的免疫原性。
本研究成功地构建了原核表达载体p ET30a(+):Rv2352c,并获得了纯化的 Rv2352c重组蛋白,同时还获得了该重组蛋白对应的多克隆抗体,并证实Rv2352c蛋白既有较好的免疫反应性也有很好的免疫原性。这为进一步筛选结核病的诊断和防治的靶抗原奠定了基础。
[1]World Health O rganization. Geneva,Sw itzerland:WHO;2009.Global tuberculosis control-surveillance,p lanning,financing.
[2]El-Sadr WM,Tsiouris SJ.H IV-associated tuberculosis:diagnostic and treatment challenges[J].Semin Respir Crit Care Med,2008,29(5):525-531.
[3]Vergne I,Chua J,Singh SB,Deretic V.Cell biology of M ycobacterium tuberculosis phagosome[J].Annu Rev Cell Dev Biol,2004,20:367-394.
[4]Tsara V,Serasli E,Christaki P.Problems in diagnosis and treatment of tuberculosis infection[J].Hippok ratia,2009,13(1):20-22.
[5]Lange C,Mo ri T.Advances in the diagnosis of tuberculosis.Respirology[J].2010,15(2):220-240.
[6]Al-Zamel FA.Detection and diagnosisof M ycobacterium tubercu-losis[J].Expert Rev Anti Infect Ther,2009,7 9 :1099-1108.[7]Bua A,Rosu V,Molicotti P,Das Gupta SK,Ahmed N,Zanetti S,Sechi LA.Phages specific for mycobacterial lipoarabinomannan help serodiagnosis of tuberculosis[J].New Microbiol,2009,32(3):293-296.
[8]Zhang SL,Zhao JW,Sun ZQ,Yang EZ,Yan JH,Zhao Q,Zhang GL,Zhang HM,Qi YM,Wang HH,Sun QW.Development and evaluation of a novelmultiple-antigen EL ISA for serodiagnosisof tuberculosis[J].Tuberculosis(Edinb),2009,89 4:278-284.
[9]Chou CH,Huang YT,Hsu HL,Lai CC,Liao CH,Hsueh PR.Rapid identification of the M ycobacterium tuberculosis complex by an enzyme-linked immunosorbent assay[J].Int J Tuberc Lung Dis,2009,13(8):996-1001.
