重组人红细胞生成素对于早产儿神经发育保护作用的Meta分析
2010-01-23詹国栋孙金峤陈燕琳周文浩
杨 琳 詹国栋 孙金峤 陈燕琳 周文浩
中国首次关于早产儿脑损伤的多中心研究,以其最常见的脑室周围白质软化(PVL)及脑室内出血(IVH)为切入点,明确在中国主要大城市PVL和IVH的发生率分别为2.3%[1]和9.3%[2],约10%脑损伤早产儿呈现体格、运动及智力发育不良预后,影响后期生存质量[3]。目前,国内外尚无早产儿脑损伤有效的预防和治疗方法,是国际性的重点攻克课题[1]。促红细胞生成素(erythropoietin ,EPO)是相对分子质量为(3.5~4.0)×104的糖蛋白,是促进骨髓红系祖细胞生长、增殖、分化和成熟的主要刺激因子[4],是首个被重组的人红细胞生成素(rhEPO)。EPO可能在正常胚胎的脑发育中起作用,其表达见于海马、皮质和中脑区域的神经元,还可能在缺氧条件下促进生存[5]。EPO在未成熟脑保护方面的作用在体外的神经细胞及动物模型研究中已得到证实[6,7],但机制尚不完全清楚,且目前还缺乏多中心、大样本的RCT研究证明其对早产儿神经发育保护作用的确切疗效。另一方面,随着rhEPO在早产儿早期防治贫血的应用推广,有报道在使用大剂量rhEPO时,会出现早产儿视网膜病(ROP)的可能[8]。针对rhEPO用于早产儿中枢神经系统保护作用的有效性及安全性,本文检索相关文献,采用Meta分析方法进行评估,旨在为早产儿脑损伤的预防及治疗提供依据。
1 方法
1.1 文献纳入标准 同时符合以下条件的文献被纳入: ①已发表的、未发表的和注册后正在进行中的RCT或半随机对照试验(quasi-RCT),发表形式不限,语种为英文和中文,盲法和非盲法均纳入;②研究对象为胎龄<37周的早产儿;③干预措施为rhEPO静脉注射或皮下注射,疗程内总剂量>3 000 U·kg-1,治疗开始时间≤生后7 d,使用时间≥2周;④对照组给予安慰剂或常规治疗。
1.2 文献排除标准 符合下列任意一项被排除: ①文献纳入的早产儿患有严重的先天畸形、溶血、贫血、红细胞增多、母子血型不和、严重感染、宫内TORCH感染、先天性心脏病及遗传代谢性疾病;②研究结果未包含以下1.3中的疗效判断指标。
1.3 疗效判断指标
1.3.1 疗效指标 生后12~22个月的智力发育指数(MDI)、神经运动发育指数(PDI)评分或MDI评分<70的发生率、PDI评分<70的发生率,纠正胎龄40周时新生儿行为神经评估(NBNA)评分及严重神经系统后遗症(脑瘫、失明或听力受损)发生率。
1.3.2 安全性指标 严重ROP(≥3级)、严重IVH(≥3级)、坏死性小肠结肠炎(NEC)和支气管肺发育不良(BPD)的发生率。
1.4 文献检索策略
1.4.1 数据库 PubMed、EMBASE、Cochrane图书馆、中国期刊全文数据库、万方数据库、维普中文科技期刊数据库及中国生物医学文献数据库,检索文献时间均从建库至2009年12月31日。均采取计算机检索,未手工检索灰色文献。
1.4.2 检索策略 英文检索式 :(EPO OR erythropoietin) AND(preterm OR premature OR infants OR very low birth weight OR extremely low birth weight)AND(neurodevelop-mental OR brain OR nerve);中文检索式:促红细胞生成素或重组人红细胞生成素,早产儿或未成熟儿或新生儿或低出生体重儿或超低出生体重儿。
1.4.3 原文获取途径 检索电子期刊全文数据库、复旦大学医科图书馆及复旦大学附属儿科医院信息科图书。
1.5 文献质量评价方法
1.5.1 纳入和排除文献 2名评价者按照检索策略独立完成初步检索,1名评价者独立阅读文题和摘要,筛选出可能为RCT或quasi-RCT的文献。由第3名评价者审核。2名评价者对可能为RCT或quasi-RCT的文献分别全文评价,决定是否纳入。评价者间有分歧时,通过讨论决定。
1.5.2 资料提取 ①一般信息:编号、文献题目、作者及联系方式、原始文献出处、文种、样本量及随机化方法; ②患儿的基本情况:性别、年龄、出生体重及胎龄;③治疗措施:药物名称、剂量、给药途径、给药时间、随访时间和疗效判断;④临床结局指标:药物有效性及安全性。
1.5.3 文献质量评价 对纳入文献采用Jadad量表进行文献方法学的质量评价。由2名评价者分别根据减少偏倚的最主要因素共同进行质量评价:①选择偏倚(分配隐藏方案的实施);②实施偏倚(对干预方法实施者实行的盲法);③失访偏倚(随机化后排除或失访);④测量偏倚(结局评价的盲法)。如果4条质量评价标准均完全满足,则该研究存在选择、实施、失访和测量偏倚的可能性最低,评为A级;如果其中任一条或多条质量评价标准仅为部分满足(或不清楚),则该研究存在偏倚的可能性为中度,评为B级;如果其中任一条或多条质量评价标准完全不满足,则该研究存在偏倚的可能性为高度,评为C级。2名评价者有分歧时,通过讨论决定。视纳入文献的数量决定是否进行发表偏倚分析。
1.6 统计学方法 采用RevMan 5.0 软件进行Meta分析,将资料进行定量综合。首先进行异质性检验,采用χ2检验,P≥0.1为研究间具同质性,采用固定效应模型描述;P<0.1为研究间具异质性,采用随机效应模型表达。计数资料以OR及其95%CI表示,计量资料以WMD及其95%CI表示。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 共检索到文献118篇,其中英文文献109篇,中文文献9篇。通过阅读摘要,13篇文献被初步纳入,进一步阅读全文,最终纳入2篇RCT[9,10]和3篇quasi-RCT文献[11~13](图1),其中英文文献2篇[9,10]、中文文献3篇[11~13]。5篇文献中,rhEPO治疗组纳入119例患儿,对照组纳入114例患儿。文献[9,10]纳入的是极低出生体重儿(VLBWI),文献[11~13]纳入的是胎龄<37周,出生体重<2 500 g的早产儿(表1)。
2篇文献[10,12]报道了MDI和PDI评分,文献[10]采用Bayley婴儿发育量表Ⅱ[14],文献[12]采用中国科学院心理研究所和中国儿童发展中心(CDCC)共同编制的婴幼儿智能发育检查量表[15]评估。3篇文献[11~13]报道了NBNA评分。因文献数量较少,未行发表偏倚检验。
2.2 文献质量 2篇文献[9,10]描述了具体的随机分组的方法;3篇文献[11~13]以入院顺序进行分组。文献[10]采用了分配隐藏;2篇文献[9,10]采用了研究者盲法,3篇文献[11~13]未提及;2篇文献[9,10]采用了评价者盲法,2篇文献[12,13]盲法描述不充分;2篇文献[9,10]有脱落或失访病例,并进行了解释和说明,3篇文献[11~13]无脱落或失访病例。文献[10]评为A级,文献[9]评为B级,文献[11~13]评为C级(表2)。5篇文献均报道了rhEPO治疗组和对照组的基线资料,两组基线资料的差异均无统计学意义。
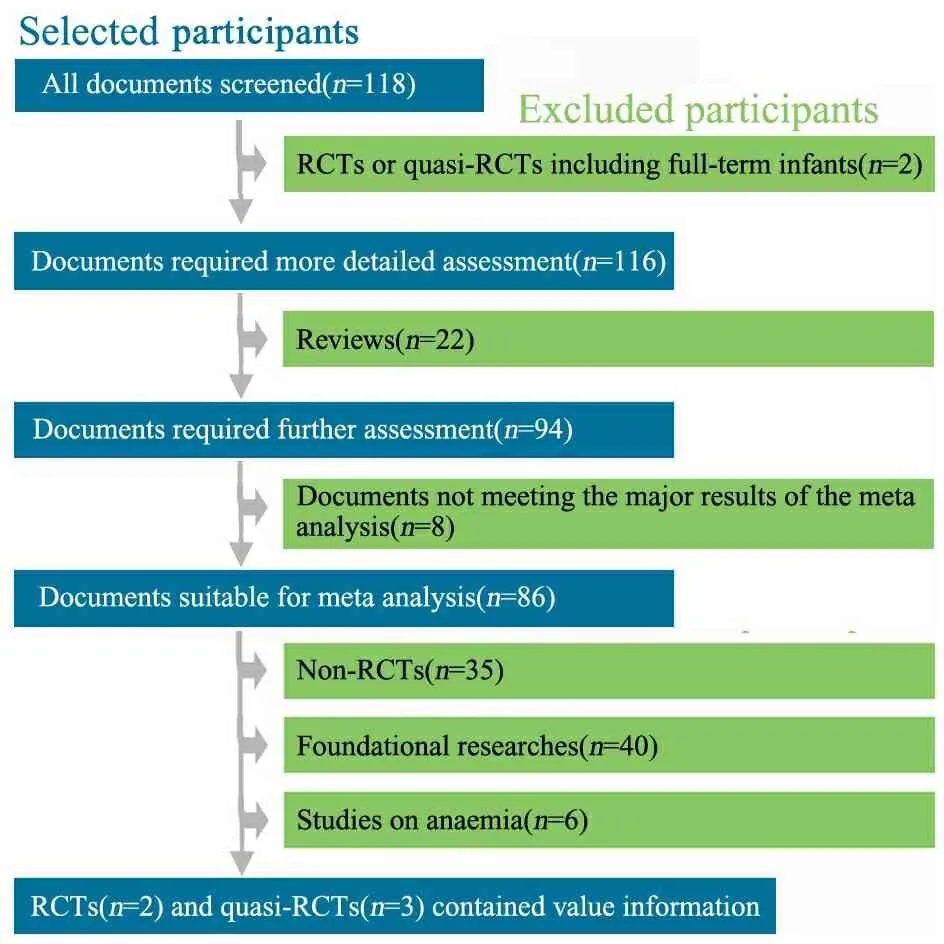
图1 文献选择过程
Notes 1)3 times per week;n1/n2:rhEPO group/control group;GA:gestational age;MDI:mental developmental index;PDI:psychomotor developmental index;NBNA:neonatal behavioral neurological assessment;%MDI<70:percentage of MDI<70; %PDI<70:percentage of PDI<70
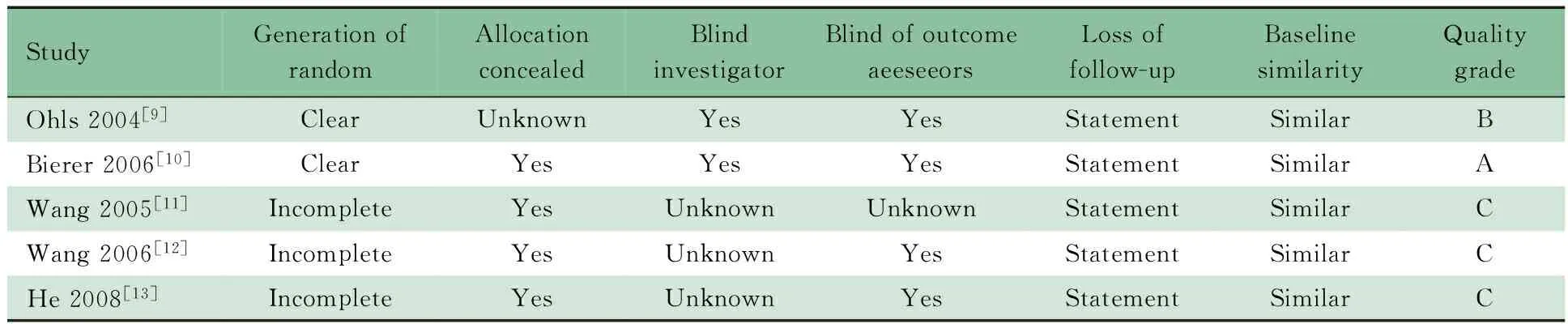
表2 纳入5篇文献的方法学质量评价
2.3 rhEPO治疗组与对照组MDI比较 2篇文献[10,12]报道了rhEPO治疗组(n= 26)和对照组(n=26)的MDI评分。异质性检验P=0.03,研究间具异质性,采用随机效应模型分析。Meta分析结果显示,WMD=7.73(95%CI: 3.45~12.01),rhEPO治疗组与对照组MDI差异有显著统计学意义,P=0.000 4(图2) 。
2篇文献[9,10]报道了rhEPO治疗组(n= 51)与对照组(n=51)MDI评分<70的发生率,异质性检验P=0.30,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,OR=0.70(95%CI: 0.31~1.61),rhEPO治疗组与对照组MDI评分<70发生率的差异无统计学意义,P=0.40(图3)。

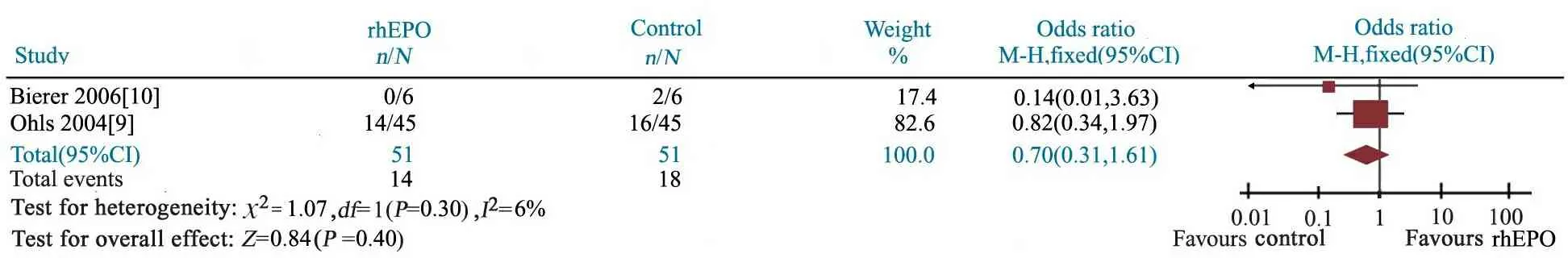
图2 rhEPO治疗组与对照组MDI评分的Meta分析
图3 rhEPO治疗组与对照组MDI评分<70发生率的Meta分析
Fig 3 Meta analysis of MDI scores below 70 in rhEPO treatment and control groups
2.4 rhEPO治疗组与对照组PDI比较 2篇文献[10,12]报道了rhEPO治疗组(n= 26)和对照组(n=26)的PDI评分。异质性检验P=0.58,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,WMD=3.81(95%CI: 0.59~7.02),rhEPO治疗组与对照组PDI评分差异有统计学意义,P=0.02(图4)。
2篇文献[9,10]报道了rhEPO治疗组(n= 51)与对照组(n=51)PDI评分<70的发生率,异质性检验P=0.42,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,OR=2.46(95%CI: 0.94~6.45),rhEPO治疗组与对照组PDI评分<70发生率的差异无统计学意义,P=0.07(图5)。
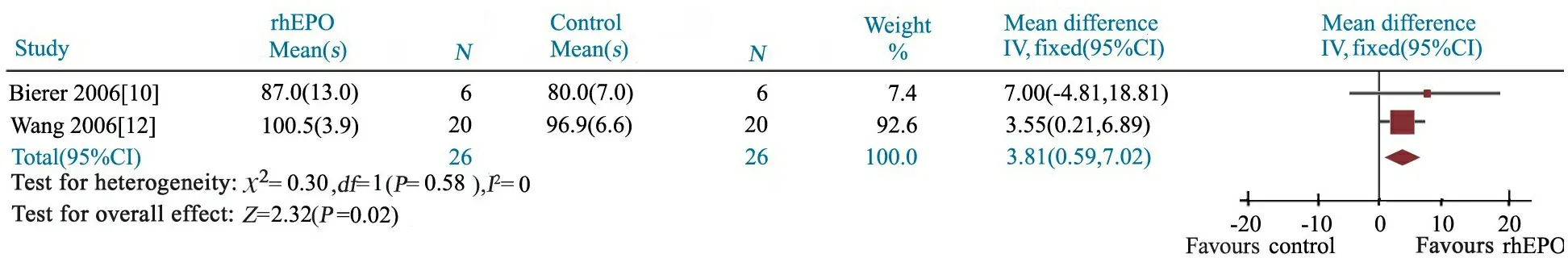
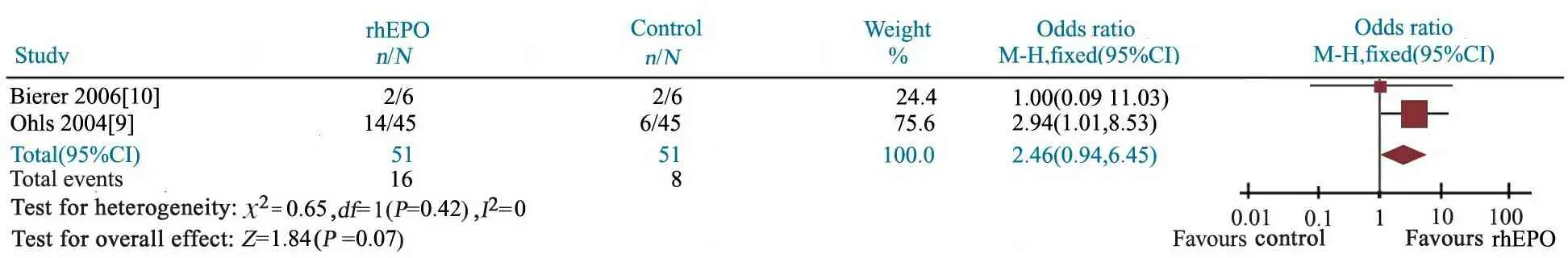
图4 rhEPO治疗组与对照组PDI评分的Meta分析
图5 rhEPO治疗组与对照组PDI评分<70发生率的Meta分析
Fig 5 Meta analysis of PDI sorces below 70 in rhEPO treatment and control groups
2.5 rhEPO治疗组与对照组NBNA评分比较 3篇文献[11~13]报道了rhEPO治疗组(n= 62)和对照组(n=57)的NBNA评分。异质性检验P=0.64,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,WMD= 1.95(95%CI: 1.56~2.35),rhEPO治疗组与对照组NBNA评分差异有显著统计学意义,P<0.000 01(图6) 。
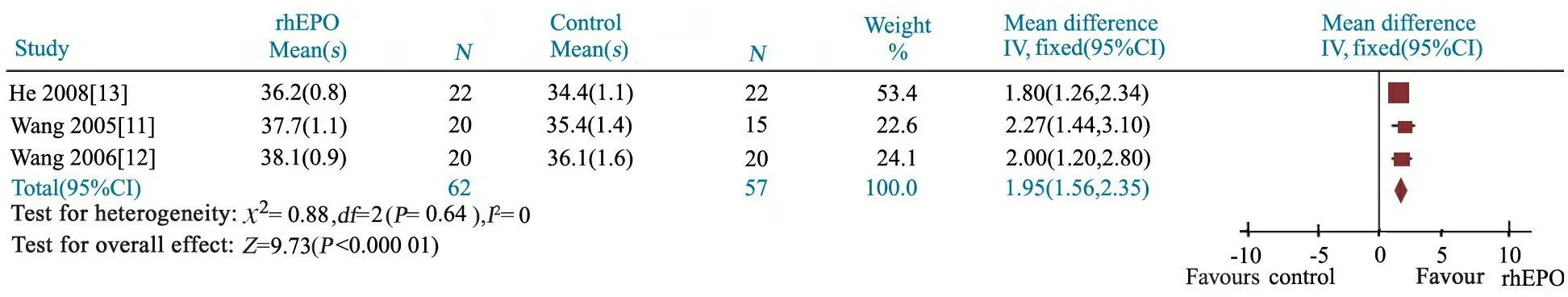
图6 rhEPO治疗组与对照组NBNA评分的Meta分析
Fig 6 Meta analysis of NBNA scores in rhEPO treatment and control groups
2.6 rhEPO治疗组与对照组严重神经系统后遗症发生率比较 2篇文献[9,10]报道了rhEPO治疗组与对照组脑瘫、失明和听力受损的发生率。因文献[10]严重神经系统后遗症发生率为0,故无法行异质性检验。Meta分析结果显示,两组脑瘫(9/54vs9/57,OR=1.08,95%CI:0.39~2.99,P=0.89)、失明(0/54vs1/56,OR=0.34,95%CI:0.01~8.56,P=0.51)和听力受损(1/54vs1/56,OR=1.04,95%CI:0.06~17.15,P=0.98)发生率的差异均无统计学意义。
2.7 rhEPO治疗组与对照组严重ROP的发生率比较 2篇文献[10,12]报道了rhEPO治疗组(n= 58)和对照组(n=59)严重ROP发生率。异质性检验P=0.44,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,OR = 1.30(95%CI: 0.50~3.43),rhEPO治疗组与对照组严重ROP发生率的差异无统计学意义,11/58vs9/59,P=0.59(图7) 。
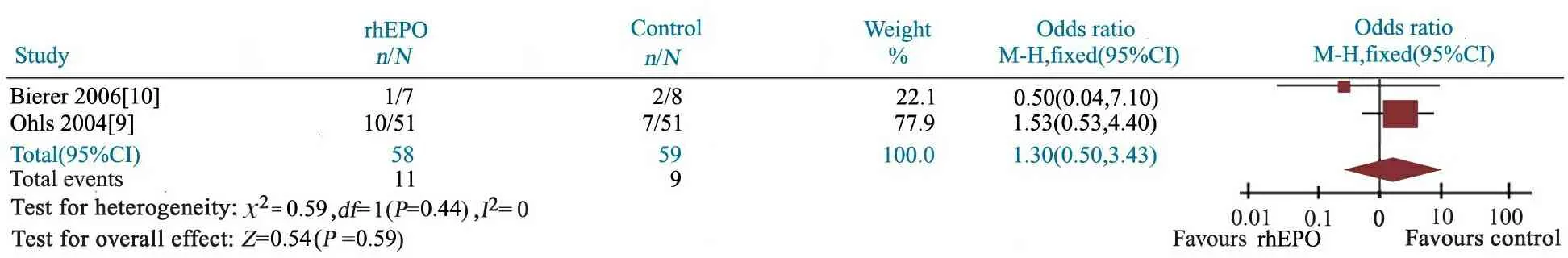
图7 rhEPO治疗组与对照组严重ROP发生率的Meta分析
Fig 7 Meta analysis of the incidence of severe ROP(stage Ⅲ or above) in rhEPO treatment and control groups
2.8 rhEPO治疗组与对照组严重IVH的发生率比较 2篇文献[9,10]报道了rhEPO治疗组(n= 56)与对照组(n=58)严重IVH的发生率。异质性检验P=0.14,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,OR = 2.91(95%CI: 0.64~13.23),rhEPO治疗组与对照组严重IVH发生率的差异无统计学意义,6/56vs2/58,P=0.17(图8)。
2.9 rhEPO治疗组与对照组NEC的发生率比较 2篇文献[9,10]报道了rhEPO治疗组(n= 58)与对照组(n=59)NEC的发生率。因文献[10]NEC发生率为0,故无法行异质性检验。Meta分析结果显示,OR = 0.57(95%CI: 0.13~2.54),rhEPO治疗组与对照组NEC发生率的差异无统计学意义,3/58vs5/59,P=0.47 。
2.10 rhEPO治疗组与对照组BPD的发生率比较 2篇文献[9,10]报道了rhEPO治疗组(n= 58)与对照组(n=59)BPD的发生率。异质性检验P=0.17,研究间具同质性,采用固定效应模型分析。Meta分析结果显示,OR = 1.06(95%CI: 0.50~2.26),rhEPO治疗组与对照组BPD发生率的差异无统计学意义,38/58vs38/59,P=0.87(图8) 。
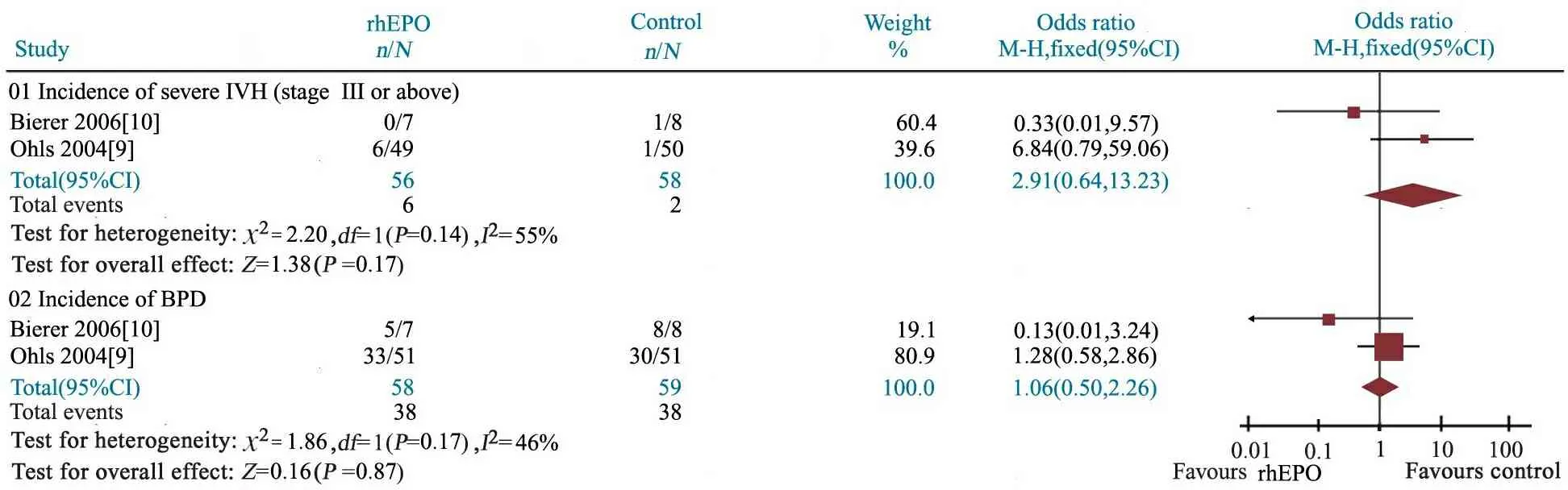
图8 rhEPO治疗组与对照组严重IVH和BPD发生率的Meta分析
Fig 8 Meta analysis of the incidence of severe IVH(stage Ⅲ or above) and BPD in rhEPO treatment and control groups
3 讨论
3.1 文献质量和证据强度 本Meta分析纳入了A级和B级文献各1篇,C级3篇,样本量均不大,说明本研究总体上的文献质量和证据强度一般。2篇文献[9,10]采用随机方法,3篇文献[11~13]随机化方法不充分;4篇文献[9,11~13]未提及分配隐藏方案,3篇文献[11~13]评价者盲法描述不充分,故认为对选择和测量偏倚的影响较大。2篇文献[9,10]有失访病例,并解释了失访原因,3篇文献[11~13]无失访病例。纳入所有文献的rhEPO治疗组和对照组基线资料均具有可比性。
3.2 rhEPO对于早产儿神经保护作用的疗效 Meta分析结果提示在应用rhEPO后,早产儿纠正胎龄40周时的NBNA评分及生后18~22月龄的MDI、PDI评分,rhEPO治疗组均较对照组有显著改善,差异有统计学意义。MDI评分<70和PDI评分<70的发生率在rhEPO治疗组与对照组间差异无统计学意义。研究表明,rhEPO在中枢神经系统对神经保护、神经发育以及神经营养均有重要作用[16,17]。从而保护早产儿的中枢神经系统。关于rhEPO应用后疗效判定的依据,国内多采用NBNA评分,对新生儿的行为能力、肌张力、原始反射和一般状况进行评分。一方面,NBNA评分多在纠正胎龄40周时进行,仅能反映近期疗效的情况;另一方面,其结果受患儿状态和评价者主观因素影响较大。国外多采用MDI和PDI评分,根据患儿智能和运动发育状况,可系统地对神经系统发育进行全面的评价,结果更可靠,指导性更好。本Meta分析结果提示,NBNA评分rhEPO治疗组显著高于对照组,但鉴于NBNA评分的局限性,这一结果需谨慎对待,不能单以NBNA评分为依据,推广rhEPO用于早产儿的脑保护。rhEPO治疗组MDI、PDI评分显著高于对照组,但因研究资料少、纳入的文献样本量小,明确结论需要进一步多中心、大样本的RCT研究来证实。rhEPO治疗组MDI评分<70、PDI评分<70的发生率与对照组差异无统计学意义,提示rhEPO对于早产儿严重的脑损伤并无明显改善作用或与纳入文献rhEPO单次使用剂量较小有关,明确结论仍需进一步研究。
rhEPO需要透过血脑屏障,与中枢受体结合后,才能发挥其可能的神经保护作用。因此,在静脉用药时,需要使用较大的剂量,有研究提示在动物实验中rhEPO单次用量达1 000~2 500 U·kg-1,才能发挥神经保护作用。但关于有效剂量的摸索,及安全性的全面论证,仍需要大量的科研及临床工作加以明确。
严重神经系统损伤后遗症如脑瘫、听力受损及失明发生率的Meta分析结果显示,rhEPO治疗组与对照组差异并无统计学意义。这一方面可能与纳入文献的样本量较小有关,另一方面,也可能与纳入文献中rhEPO单次使用剂量较小有关。
文献[9,10]未提及所使用rhEPO的制药厂商,文献[11,12]所使用rhEPO为华北制药集团生产,文献[13]所使用rhEPO为沈阳三生制药厂生产。纳入文献所使用的rhEPO并非来自同一厂商,也可能对于结果有所影响。
3.3 rhEPO对于早产儿神经保护作用的安全性 早产儿应用大剂量rhEPO的安全性也是一个重要问题。已有相关的报道指出,rhEPO可导致ROP的发生率增高[8]。文献[9,10]报道了严重ROP的发生率,Meta分析结果提示在应用rhEPO后,严重ROP的发生率在两组间差异无统计学意义。文献[11~13]未报道有不良反应的发生。文献[9,10]还报道了严重ROP、严重IVH、NEC和BPD的发生率,Meta分析结果提示在应用rhEPO后,上述各项指标的发生率在两组间差异均无统计学意义。文献[11]报道rhEPO治疗组与对照组早产儿在治疗期间平均动脉压、WBC、PLT、中性粒细胞绝对值、ALT、BUN、SCr和总胆红素的水平均在正常范围内,两组差异均无统计学意义。目前有已完成的Ⅰ/Ⅱ期临床试验证实rhEPO 500~2 500 U·kg-1早期应用于超低出生体重儿,rhEPO治疗组与对照组ROP、PVL、颅内出血、NEC以及动脉导管未闭的发生率差异无统计学意义[18]。
3.4 结论 ①早产儿早期应用rhEPO可提高NBNA、MDI及PDI评分,对中枢神经系统发育有保护作用,且并不增加严重ROP的发生率;②建议关于rhEPO对早产儿神经发育保护作用的多中心研究在实施过程中应更细化:按早产儿胎龄、脑功能分组;按rhEPO剂量分组;选择合适的近期和远期疗效判定标准,并坚持长期随访。
本Meta分析的不足之处和局限性:①相关研究资料较少、样本量不大,除1篇文献质量较好外,余4篇文献一般或较差,可能会影响分析结果的可靠性;②国内外对于早产儿神经发育的研究,所采用的评判方法并不相同,给分析造成了一定的难度。特别是纳入的3篇国内文献对于早产儿神经发育评判标准均为NBNA评分,其对于远期预后预测性欠佳;③纳入的文献所应用的rhEPO剂量并不一致,故在临床推广应用,尤其是大剂量早期应用时仍需谨慎。
[1]Chen HJ(陈惠金),Wei KL,Yao YJ,et al. Multicenter investigation for incidence of periventricular leukomalacia in premature infants in China. Chin J Contemp Pediatr(中国当代儿科杂志),2008,10(6):686-692
[2]The Subspecialty Group of Neonatology, The Society of Pediatrics, Chinese Medical Association(中华医学会儿科学分会新生儿学组),Multicenter Collaborative Team for the Study of Brain Injuries in Chinese Premature Infants. Multicenter survey for incidence of intraventricular hemorrhage in premature infants in seven big cities of China. Chin J Pediatr(中华儿科杂志), 2009,47(1):5-11
[3]Chen HJ(陈惠金),Fan XF,Gao JR,et al. Multicenter follow-up report of 147 premature infants with brain injuries from 6 hospitals in China. Chin J Contemp Pediatr(中国当代儿科杂志),2009,11(3):166-172
[4]Eckardt KU, Kurtz A. Regulation of erythropoietin production.Eur J Clin Invest, 2005,35(S3): 13-19
[5]Feng M(冯玫),Li YC. EPO与EPO受体的研究进展. Journal of Leukemia & Lymphoma(白血病淋巴瘤),2005,14(4):254-256
[6]Maiese K, Li F, Chong ZZ. New avenues of exploration for erythropoietin. JAMA, 2005,293(1): 90-95
[7]Juul S, Felderhoff-Mueser U. Epo and other hematopoietic factors. Semin Fetal Neonatal Med, 2007,12(4): 250-258
[8]Ohlsson A, Aher SM. Early erythropoietin for preventing red blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst Rev, 2006,3:CD004863
[9]Ohls RK, Ehrenkranz RA, Das A, et al. Neurodevelopmental outcome and growth at 18 to 22 months′ corrected age in extremely low birth weight infants treated with early erythropoietin and iron. Pediatrics,2004,114(5):1287-1291
[10]Bierer R, Peceny MC, Hartenberger CH, et al. Erythropoietin concentrations and neurodevelopmental outcome in preterm infants. Pediatrics,2006,118(3):635-640
[11]Wang YH(王迎红). 促红细胞生成素对早产儿贫血及神经系统的影响. Journal of Medical Forum(医药论坛杂志),2005,26(7):49-52
[12]Wang YH(王迎红),Zhu CL,Cheng XY,et al. 重组人促红细胞生成素对早产儿神经行为发育的影响. Chinese Journal of Practical Pediatrics(中国实用儿科杂志),2006,12(1):59-60
[13]He JS(何金水),Huang ZL,Yang H,et al. Early use of recombinant human erythropoietin promotes neurobehavioral development in preterm infants. Chin J Contemp Pediatr(中国当代儿科杂志),2008,10(5):586-588
[14]Sun XM(孙晓勉),Ren YH,Su ZY.Study on Bayley scales of infant development. Maternal and Child Health Care of China(中国妇幼保健),1996 ,11 (1):53-54
[15]范存仁,主编. CDCC婴幼儿智能发育测验手册.北京:团结出版社,1988
[16]Rabie T, Marti HH. Brain protection by erythropoietin: a manifold task. Physiology (Bethesda),2008,23: 263-274
[17]McPherson RJ, Juul SE. Recent trends in erythropoietin-mediated neuroprotection. Int J Dev Neurosci, 2008,26(1): 103-111
[18]Juul SE, McPherson RJ, Bauer LA, et al. A phase Ⅰ/Ⅱ trial of high-dose erythropoietin in extremely low birth weight infants: pharmacokinetics and safety. Pediatrics, 2008,122(2): 383-391
