血小板活化因子及其乙酰水解酶在新生儿感染中的变化及临床意义
2010-01-23蒋思远
蒋思远 曹 云 杨 毅 陈 超 熊 曼
新生儿免疫系统功能尚未发育成熟,易被各种病原体感染。重症感染是目前造成新生儿死亡的主要原因之一[1]。血小板活化因子(platelet-activating factor,PAF)是体内最具活性的脂质炎症介质之一。PAF乙酰水解酶(PAF-acetylhydrolase ,PAF-AH)能特异性地水解PAF,是调节血浆PAF水平的关键机制。PAF和PAF-AH在重症感染中发挥重要作用,与感染严重程度及预后相关[2,3]。因此,应用PAF受体拮抗剂[4~6]及外源性PAF-AH[7,8]治疗重症感染存在可能。目前,血浆PAF和PAF-AH在新生儿感染中的变化及作用尚不明确,也未见报道。本研究欲通过检测感染新生儿血浆PAF水平及PAF-AH活性,探讨两者在新生儿感染中的变化和临床意义,以期为在新生儿感染中应用相关治疗策略提供依据。
1 方法
1.1 纳入标准 入院时日龄<30 d的新生儿。
1.2 排除标准 符合下列条件之一被排除:①合并严重先天畸形(如染色体异常和先天性心脏病等);②合并遗传代谢性疾病;③出生时重度窒息合并多器官功能损害。
1.3 诊断标准 新生儿败血症的诊断依照2003年中华医学会儿科学分会新生儿学组制定的《新生儿败血症诊疗方案》[9]。化脓性脑膜炎、感染性肺炎、感染性腹泻、泌尿系统感染及先天性梅毒的诊断均依照《实用新生儿学》第3版[10]。非感染新生儿定义:无胎膜早破或新生儿母亲产前感染病史、无感染临床表现及实验室阳性指标的因其他原因入院的新生儿。
1.4 本研究需界定的定义
1.4.1 感染的临床表现[9]①体温改变:发热或低体温;②少吃、少哭、少动、面色欠佳、四肢凉、体重不增或增长缓慢;③黄疸;④硬肿症, 皮肤黏膜瘀斑、瘀点,脓疱疮,脐周或其他部位蜂窝织炎;⑤厌食、腹胀、呕吐、腹泻、中毒性肠麻痹或肝脾肿大;⑥气促、发绀、呼吸不规则或呼吸暂停;⑦嗜睡或激惹。
1.4.2 器官功能衰竭的诊断 依照2002年国际小儿脓毒症会议制定的儿科器官功能衰竭诊断标准[11]。
1.4.3 新生儿分期的定义 早期新生儿为日龄≤7 d,晚期新生儿为日龄>7 d[10]。
1.5 分组 新生儿感染研究在分组设计上尚无公认的方案。本研究根据有无感染的危险因素、临床症状、体征和实验室检查结果,将研究对象的感染程度探索性分为全身感染组(败血症和化脓性脑膜炎)、局部感染组(感染性肺炎、感染性腹泻、尿路感染和先天性梅毒)和非感染组。
1.6 知情同意 本研究经复旦大学附属儿科医院伦理委员会批准,获患儿家长的口头知情同意。
1.7 标本采集和处理 无感染表现的新生儿在住院期间采桡动脉血1 mL,对入组分析的新生儿在出现感染表现后48 h内采桡动脉血3 mL(其中2 mL进行血培养),合并器官功能衰竭的患儿在其出现感染症状后的第1、3、5和7天增加采桡动脉血1 mL。血样以EDTA抗凝,离心后取血浆待测PAF水平和PAF-AH活性。
1.8 血浆PAF水平和PAF-AH活性检测方法 血浆PAF水平测定应用ELISA法(中国台湾Abnova公司PAF ELISA试剂盒);血浆PAF-AH活性测定采用美国Cayman公司PAF-AH活性检测试剂盒。均按试剂盒说明书进行操作。
1.9 血浆PAF水平和PAF-AH活性的影响因素 分析感染程度、性别、胎龄、出生体重和日龄对血浆PAF水平和PAF-AH活性的影响。
2 结果
2.1 一般情况 2008年7~12月复旦大学附属儿科医院新生儿科病房(包括NICU及新生儿普通病房)依据纳入和排除标准有247例新生儿进入分析,其中全身感染组91例(包括确诊败血症31例,临床诊断败血症57例,化脓性脑膜炎3例);局部感染组63例(包括感染性肺炎45例,感染性肠炎7例,尿路感染8例,先天性梅毒3例);非感染组93例。各组间性别构成比、胎龄及出生体重差异无统计学意义。全身感染组和局部感染组的日龄均大于非感染组。各组研究对象的一般情况见表1。

表1 各组一般情况比较
Notes M:male; F:female; GA:gestational age
2.2 血浆PAF水平及PAF-AH活性的影响因素分析 多元线性回归分析表明,新生儿血浆PAF水平仅与感染程度有关(P=0.000),与性别、胎龄、出生体重及日龄无关;血浆PAF-AH活性与感染程度及日龄(P均为0.000)有关,早期新生儿血浆PAF-AH活性低于晚期新生儿;血浆PAF-AH活性与性别、胎龄及出生体重无关(表2)。
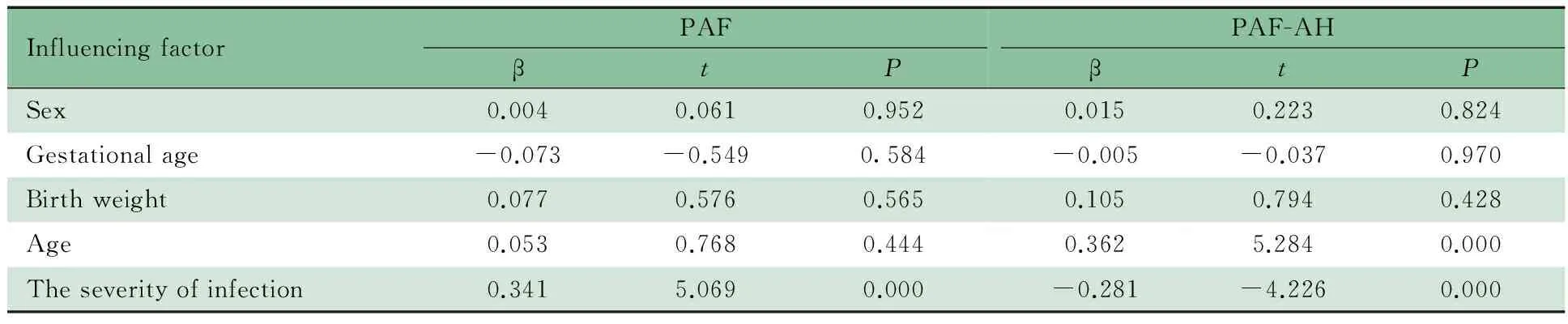
表2 新生儿血浆PAF水平和PAF-AH活性的影响因素分析
2.3 不同感染组血浆PAF水平及PAF-AH活性比较
2.3.1 血浆PAF水平 鉴于血浆PAF水平仅与感染程度相关,故进一步分析血浆PAF水平与感染程度的关系。全身感染组血浆PAF水平[(9.5±8.1)μg·L-1]显著高于局部感染组[(5.3±3.2)μg·L-1]及非感染组[(4.6±3.5)μg·L-1],P均为0.000。局部感染组和无感染组的血浆PAF水平差异无统计学意义(P=0.584)。
2.3.2 血浆PAF-AH活性 鉴于血浆PAF-AH活性与日龄相关,故分别比较早期新生儿和晚期新生儿不同感染组的血浆PAF-AH活性。表3所示,在早期或晚期新生儿中,不同感染组血浆PAH-AH活性的差异总体上有统计学意义(P分别为0.003和0.000),全身感染组血浆PAF-AH活性均显著低于局部感染组(P分别为0.019和0.000)及非感染组(P均为0.001);局部感染组和非感染组血浆PAF-AH活性的差异均无统计学意义(P分别为0.357和0.993)。
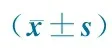

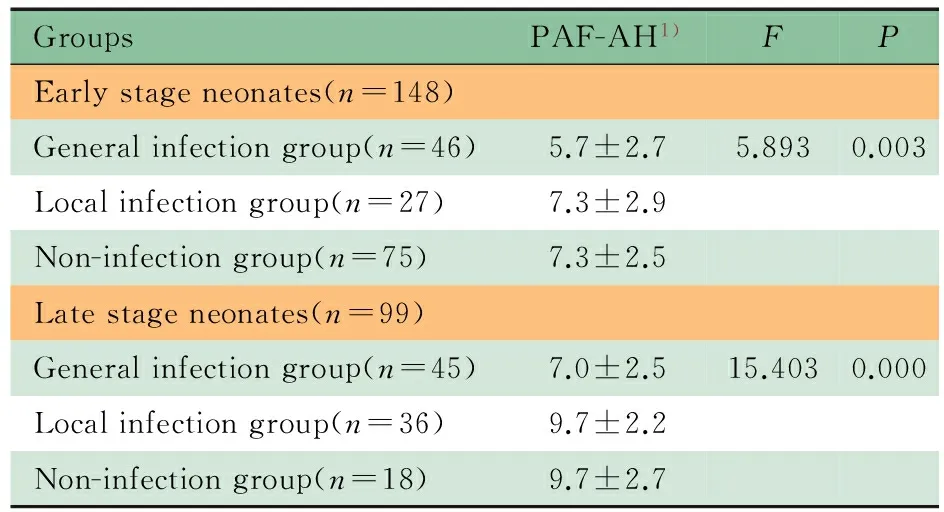
GroupsPAF-AH1)FPEarlystageneonates(n=148)Generalinfectiongroup(n=46)5.7±2.75.8930.003Localinfectiongroup(n=27)7.3±2.9Non-infectiongroup(n=75)7.3±2.5Latestageneonates(n=99)Generalinfectiongroup(n=45)7.0±2.515.4030.000Localinfectiongroup(n=36)9.7±2.2Non-infectiongroup(n=18)9.7±2.7
Notes 1)μmol·L-1·min-1
2.4 不同细菌感染时血浆PAF水平及PAF-AH活性比较 全身感染组中,31/91例为确诊败血症,其中革兰阳性菌感染17例(凝固酶阴性葡萄球菌14例,F群溶血链球菌、无乳链球菌和粪肠球菌各1例),革兰阴性菌感染12例(大肠埃希菌4例,鲍氏不动杆菌和少动鞘氨单胞菌各2例,肺炎克雷伯菌、洋葱伯克霍尔菌、荧光假单胞菌和侵肺巴斯德菌各1例),真菌感染2例(季也蒙假丝酵母菌和白色念珠菌各1例)。革兰阳性菌感染及革兰阴性菌感染新生儿的性别(P=0.917)、日龄(P=0.850)、胎龄(P=0.489)及出生体重(P=0.305)差异无统计学意义。革兰阴性菌感染新生儿血浆PAF水平显著高于革兰阳性菌感染者,(13.1±11.0)μg·L-1vs(5.4±3.9)μg·L-1,P=0.009。革兰阴性菌感染新生儿血浆PAF-AH活性显著低于革兰阳性菌感染者,(4.9±2.1)μmol·L-1·min-1vs(7.9±2.4)μmol·L-1·min-1,P=0.005。
2.5 全身感染合并器官功能衰竭患儿血浆PAF水平及PAF-AH活性的变化 12例全身感染合并器官功能衰竭患儿中,败血症10例,化脓性脑膜炎2例。其中呼吸功能衰竭11/12例,心血管功能衰竭3/12例,血液系统功能障碍4/12例。存活9例,3例分别在其病程第3、6和7天死亡。
9例存活患儿血浆PAF水平在病程1~7 d呈下降趋势,感染第7天血浆PAF水平均低于感染第1天水平,(5.6±2.4)μg·L-1vs(13.5±7.4)μg·L-1,P=0.007。3例死亡患儿血浆PAF水平呈上升趋势,末次血浆PAF水平均高于感染第1天水平,(7.2±3.6)μg·L-1vs(19.6±14.7)μg·L-1(图1A)。
9例存活患儿血浆PAF-AH活性在病程1~7 d呈上升趋势,感染第7天的PAF-AH活性均高于感染第1天,(10.1±2.8)μmol·L-1·min-1vs(4.9±1.4)μmol·L-1·min-1,P=0.000。3例死亡患儿中,1例血浆PAF-AH活性逐渐下降,2例末次血浆PAF-AH活性水平等于或稍高于感染第1天,其血浆PAF-AH活性均维持在较低水平(图1B)。
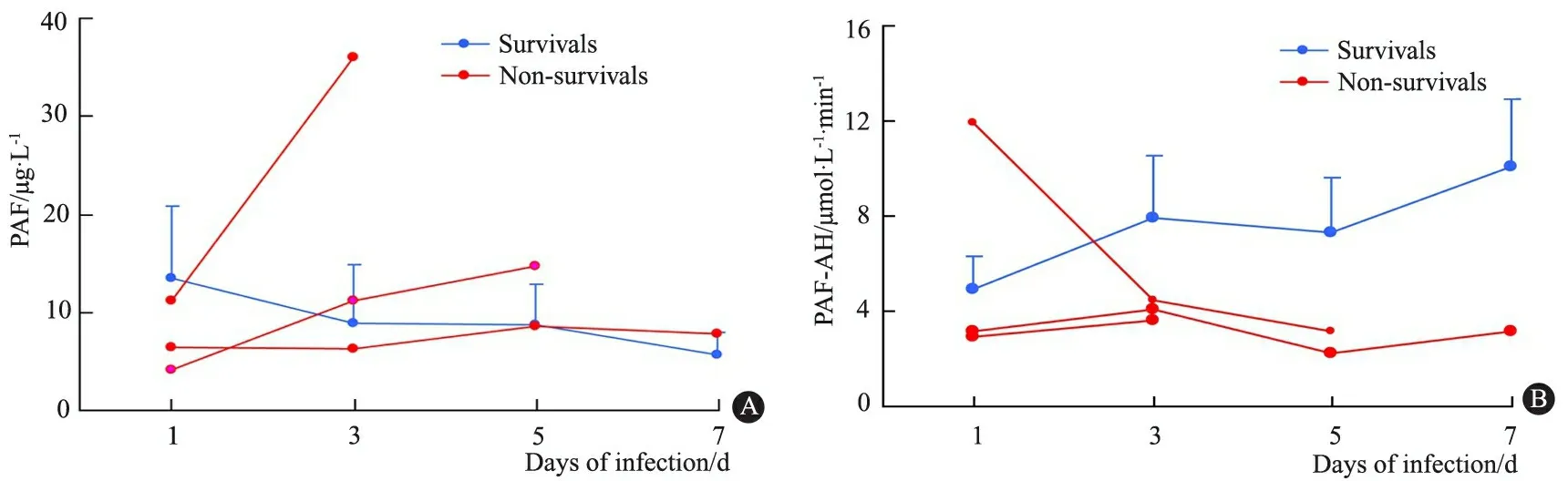
图1 全身感染合并器官衰竭患儿病程1~7 d血浆PAF水平和PAF-AH活性变化
Fig 1 Changes of plasma PAF levels and PAF-AH activities in neonates with general infection
Notes A:changes of plasma PAF levels in neonates with critical general infection;B:changes of plasma PAF-AH activities in neonates with critical general infection
3 讨论
新生儿感染在严重程度分组上尚无统一的标准。本课题组近期关于新生儿感染指标的一项研究[12]将感染程度分为重症感染、普通感染和非感染,其中败血症、化脓性脑膜炎、重症肺炎和坏死性小肠结肠炎病例进入重症感染组。根据新生儿的临床特点,上述几类感染患儿病情往往较重,但仅从疾病种类判定感染的严重程度可能不够全面,因此本研究未予采用,而延用了稍早期研究[13]的分组方法,将患儿分为全身感染组、局部感染组和非感染组,使分组较为客观、清晰并反映感染的真实情况。同时在全身感染患儿中,对合并器官功能衰竭的患儿进一步研究。另外,目前国内外多采用全身炎症反应综合征(SIRS)、脓毒症和严重脓毒症系列定义对儿科感染程度进行分类[11],但该分类方法在新生儿中应用较少,且缺少早产儿各项指标的正常值及诊断标准,故本研究也未采用。
PAF是体内最具活性的脂质炎症介质之一,能从不同途径广泛参与并影响炎症反应过程,其作用包括活化血小板、多形核白细胞及巨噬细胞,介导内皮细胞损伤,促进TNF和IL等炎症因子的合成并增强其活性,参与体内“瀑布系统”即补体系统、激肽系统和凝血纤溶系统的激活,是内源性炎症启动与放大过程的重要递质。PAF-AH是一种磷脂酶A2,能特异性作用于磷脂底物的sn-2位短乙酰基团,催化去乙酰反应,导致PAF及氧化磷脂失活,从而表现出抗炎及抗氧化作用。血浆PAF水平的调节主要依靠PAF-AH的水解作用。
成人研究表明,脓毒症和脓毒症休克等重症感染患者血浆PAF水平增高[14],血浆PAF-AH活性显著降低[2],PAF水平与感染严重程度相关[14]。本研究显示,全身感染新生儿血浆PAF水平及 PAF-AH活性也出现类似变化趋势,提示新生儿败血症和化脓性脑膜炎等全身感染时也存在PAF及其介导的炎症反应的过度活化。
本研究结果提示,新生儿血浆PAF水平及PAF-AH活性的变化还可能与感染细菌的种类相关,败血症患儿血浆PAF水平在革兰阴性菌感染者显著高于革兰阳性菌感染者,且革兰阴性菌感染者血浆PAF-AH活性显著低于革兰阳性菌感染者。产生这种差异的原因可能与两个因素有关:首先,革兰阴性菌产生的内毒素对PAF的生成具有强烈的刺激作用[15],并且能抑制PAF-AH的生成和分泌[3],同时内毒素导致的多种病理生理作用又需要PAF-AH介导,PAF-AH可以导致类似内毒素休克的病理生理状态[16];其次,革兰阴性菌感染易影响凝血纤溶系统,而PAF与凝血纤溶系统的激活密切相关[17]。在中国院内获得性感染的新生儿败血症中,革兰阴性菌感染的发生率高,且病情重,病情变化迅速,可在数小时内导致DIC和休克等。本研究结果提示,PAF-AH对鉴别败血症病原可能具有提示作用,阻断PAF-AH信号系统可能对革兰阴性菌感染具有更好的疗效,其在不同细菌感染中的变化及应用价值需进一步研究。
为进一步研究血浆PAF水平及PAF-AH活性在重症全身感染新生儿病程中的变化,本研究对12例全身感染合并器官功能衰竭的患儿进行了动态观察。结果显示,9例存活患儿的血浆PAF水平呈总体下降趋势,血浆PAF-AH活性呈总体上升趋势;死亡患儿中,血浆PAF水平呈升高趋势,血浆PAF-AH活性逐渐下降或维持在低水平。提示存活患儿存在PAF的过度活化作用,在病程中逐渐恢复,而在死亡患儿中PAF过度活化作用始终存在。本研究结果提示,血浆PAF水平和PAF-AH活性的动态变化趋势与重症感染的预后相关,PAF信号系统的持续过度激活可导致疾病的进展甚至死亡。目前有多项研究致力于通过阻断PAF作用来治疗重症感染[4~8],本研究为应用这一策略治疗新生儿重症感染提供了依据,进一步研究可尝试通过阻断过度活化的PAF信号系统来治疗新生儿重症感染,改善预后。
本研究的不足之处和局限性:①进行动态观察的病例数较少,今后的研究需要扩大样本量进一步研究;②仅观察了血浆PAF水平和PAF-AH活性在新生儿感染中的变化,今后需要进一步证实血浆PAF水平和PAF-AH活性在新生儿感染中的干预作用。
[1]Schuchat A, Zywicki SS, Dinsmoor MJ, et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study. Pediatrics,2000, 105(1 Pt 1):21-26
[2]Claus RA, Russwurm S, Dohrn B, et al. Plasma platelet-activating factor acetylhydrolase activity in critically ill patients.Crit Care Med, 2005, 33(6):1416-1419
[3]Gomes RN, Bozza FA, Amancio RT,et al. Exogenous platelet-activating factor acetylhydrolase reduces mortality in mice with systemic inflammatory response syndrome and sepsis.Shock, 2006, 26(1): 41-49
[4]Poeze M, Froon AH, Ramsay G, et al. Decreased organ failure in patients with severe SIRS and septic shock treated with the platelet-activating factor antagonist TCV-309: a prospective, multicenter, double-blind, randomized phase Ⅱ trial. TCV-309 Septic Shock Study Group. Shock, 2000,14(4): 421-428
[5]Suputtamongkol Y, Intaranongpai S, Smith MD, et al. A double-blind placebo-controlled study of an infusion of lexipafant (Platelet-activating factor receptor antagonist) in patients with severe sepsis. Antimicrob Agents Chemother, 2000, 44(3): 693-696
[6]Vincent JL, Spapen H, Bakker J,et al. Phase Ⅱ multicenter clinical study of the platelet-activating factor receptor antagonist BB-882 in the treatment of sepsis. Crit Care Med, 2000, 28(3):638-642
[7]Schuster DP, Metzler M, Opal S, et al. Recombinant platelet-activating factor acetylhydrolase to prevent acute respiratory distress syndrome and mortality in severe sepsis: Phase Ⅱb, multicenter, randomized, placebo-controlled, clinical trial. Crit Care Med, 2003, 31(6):1612-1619
[8]Opal S, Laterre PF, Abraham E, et al. Recombinant human platelet-activating factor acetylhydrolase for treatment of severe sepsis: results of a phase Ⅲ, multicenter, randomized, double-blind, placebo-controlled, clinical trial. Crit Care Med,2004, 32(2):332-341
[9]Subspecialty Group of Neonatology Pediatric Society Chinese Medical Association(中华医学会儿科学分会新生儿学组). Protocol for diagnosis and treatment of neonatal septicemia.Chin J Pedaitr(中华儿科杂志),2003,41(12):897-899
[10]金汉珍,主编. 实用新生儿学. 第3版. 北京:人民卫生出版社,2001. 3-5,349-354,359-362,435-443,497-503,717-719
[11]Goldstein B, Giroir B, Randolph A, et al. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med, 2005, 6(1): 2-8
[12]Xia Q(夏庆), Cao Y, Yang Y, et al. Variation and clinical significance of plasma pro-adrenomedullin in neonates with infection. Chin J Perinat Med(中华围产医学杂志), 2010, 13(1): 29-31
[13]Zhang JP(张金萍),Chen C,Yang Y.Clinical significance of CD64 in diagnosis of neonatal infection.Chin J Perinat Med(中华围产医学杂志),2006,9(5):320-324
[14]Sörensen J, Kald B, Tagesson C, et al. Platelet-activating factor and phospholipase A2 in patients with septic shock and trauma. Intensive Care Med,1994, 20(8):555-561
[15]Stafforini DM, McIntyre TM, Zimmerman GA, et al. Platelet-activating factor, a pleiotrophic mediator of physiological and pathological processes. Crit Rev Clin Lab Sci, 2003, 40(6):643-672
[16]Mathiak G, Szewczyk D, Abdullah F, et al. Platelet-activating factor (PAF) in experimental and clinical sepsis. Shock, 1997, 7(6):391-404
[17]Zimmerman GA, McIntyre TM, Prescott SM, et al. The platelet-activating factor signaling system and its regulators in syndromes of inflammation and thrombosis. Crit Care Med, 2002, 30(S5):294-301
