从WPC中分离β-lactoglobulin的方法
2010-01-04段翠翠霍贵成任大喜冯芳菲
段翠翠,霍贵成,任大喜,冯芳菲
(东北农业大学 乳品科学教育部重点实验室,哈尔滨 150030)
从WPC中分离β-lactoglobulin的方法
段翠翠,霍贵成,任大喜,冯芳菲
(东北农业大学 乳品科学教育部重点实验室,哈尔滨 150030)
β-Lactoglobulin是乳清中的主要蛋白,已经有很多方法应用于分离提取β-Lg,但是这些方法或技术大多数比较贵或有时候比较复杂,不能够达到足够的产量或纯度。介绍一种简便易行,重复性强,低成本的方法从浓缩乳清蛋白(WPC)中分离β-Lg,并且利用BCA法测定蛋白的质量浓度表明提取β-Lg的质量浓度很高,而SDS-PAGE表明提取的β-Lg有较高的纯度。
蛋白纯化;β-lactoglobulin;BCA;SDS-PAGE
0 引 言
乳清蛋白中的主要蛋白β-Lg是特征最明显的牛乳蛋白之一。其在乳清中的质量浓度约为3.2~3.4 g/L。人们基于不同的目的来分离β-Lg,因为其具有优良的营养价值和功能性质。如果能控制分离成本,天然β-Lg有望成为非常实用的食品添加剂[1]。
已经有很多技术被用于分离和/或提纯牛乳中的各种蛋白,例如,盐析[2,3],在质量分数为3%的三氯乙酸(TCA)条件下选择性提取β-Lg[4],阳离子交换色谱[5-6],高效液相色谱(HPLC)[7,8],快速蛋白液相色谱(FPLC)以及其他的色谱技术[9,10]和等电点聚焦[11]。但是这些方法大多数比较贵或比较复杂。此研究的目的是开发一种简便,易行,低成本的方式从WPC(浓缩乳清蛋白,80%)中分离β-Lg(分子量为18.3 ku)。本研究是参考文献[12]中的方法,然后进行了改进。
1 实 验
1.1 蛋白分离纯化系统
AKTA,美国UVP凝胶成像系统(UPLAND),CA91786 USA,酶标仪(型号680),SDS,蛋白质标样,Bio-RAd电泳仪(型号PowerPac Basic),进口浓缩乳清蛋白粉(WPC,质量分数80%),BCA蛋白浓度测定试剂盒(增强型),碧云天;96孔细胞培养板,PBS溶液,标样为抑肽酶,链霉素,β-乳球蛋白标准品,α-乳白蛋白标准品,低分子量蛋白标准品。
1.2 电泳所用试剂
质量分数为30%丙烯酰胺(Acr),质量分数为10%SDS(十二烷基磺酸钠),浓度为1.5 mol/L的Trisbase缓冲液,pH值为8.8浓度为0.5 mol/L的Tris–base缓冲液,pH值为6.8质量分数为10%过硫酸铵,TEMED(四甲基乙二胺)。样品缓冲液:去离子水15 mL,浓度为0.5 mol/L的Tris-HCl,pH值为6.8,25 mL,50%的甘油,20 mL,质量浓度为100 g/L的SDS 40 mL;质量浓度为1 g/L的溴酚蓝、电泳缓冲液为3.03g的Tris,14.41 g甘氨酸,1 g的SDS,加水溶解至1L;染色液为0.5 g考马斯亮蓝G-250,250 ml甲醇,34 ml的冰醋酸,加水至500 mL;脱色液为75 mL冰醋酸,50 mL的甲醇,加水至1L;封存液:异丁醇;配置溶液用的水都为去离子水。
2 方 法
2.1 β-Lg的分离提取
2.1.1 酪蛋白和乳清蛋白的分离
首先用浓度为1 mol/L的HCl调节一定质量分数(10%)的WPC溶液,使其达到酪蛋白的等电点,pH值为4.6,在此pH值条件下酪蛋白和乳清蛋白分离[13],然后以5 000 r/min转离心20 min,收集上清液,其主要是乳清蛋白。这一步主要是去除WPC中混有的酪蛋白组分,为使去除效果较好,将上清液再离心,取上清,重复操作3次。
2.1.2 α-La和β-Lg的分离
将第一步获得的上清液用浓度为1 mol/L的NaOH调节pH值至7.5,根据Mailliart&Ribadeau-Dumas[14],用质量分数为7%的NaCl浓度为6 mol/L的HCl调节pH值至2,使β-Lg,α-La和BSA分离。 用转速为8 000 r/min离心20 min后,在上清液中回收β-Lg,沉淀中包含浓缩的组分α-La和BSA。用质量分数为6%的NaU(pH值为2)的溶液冲洗沉淀去除沉淀中的大多数β-Lg,然后再离心,重复操作3次。随着在上清液中不断增加NaU的质量分数,β-Lg被盐析出来。在pH值为2,NaCl质量分数为30%的时候,出现β-Lg沉淀,然后用8 000 r/min转速离心20 min,将上清液倒掉,沉淀中主要是β-Lg。调节pH值为7将两种沉淀物溶解在最少量的水中,透析,然后冻干。
2.2 蛋白分离纯化进一步提纯
将冻干后的样品溶解在少量水中,进行蛋白分离纯化,分离纯化所使用的柱子是Superdex_75_10/300_GL,将样品峰和标样峰做对比,选择样品峰中和标样峰中的β-Lg出峰时间或者出峰体积一致的峰,收集此峰,即是纯化后的β-Lg。将收集好的β-Lg冻干浓缩体积。
2.3 脱盐
经过上述分离纯化,然后冻干后的β-Lg中,因为洗脱液是浓度为0.05 mol/L的乙酸钠和浓度为0.1 mol/L的氯化钠,其中含有大量的盐类,所以对其脱盐这一步骤是必不可少的,根据洗脱顺序,首先流出来的是β-Lg,然后是电导峰,收集电导峰出来之前的β-Lg。将收集后的β-Lg再冻干。得到的即是比较纯的β-Lg。
2.4 BCA法测定蛋白质量浓度
将分离纯化后的样品使用BCA蛋白质量浓度测定试剂盒(增强型)测定所得β-Lg的质量浓度。将20 μL质量浓度为1 g/L的粗β-Lg加入96孔板中,设3个重复孔,然后每孔加入200 μL工作试剂,于60℃温育30 min,于酶标仪570nm波长处读取吸光值。用试剂盒中的BCA蛋白标准溶液作标准工作曲线,BCA法标准工作曲线的具体操作是:将标准蛋白配制成质量浓度为0.5 g/L的溶液,然后按体积为0,1,2,4,8,12,16,20 μL加到96孔板的标准品孔中,加标准品稀释液补足到20μL,质量浓度分别为0,0.025,0.5,0.1,0.2,0.3,0.4,0.5 g/L的系列标准工作溶液,按BCA试剂盒说明书测定,根据统计测定结果得到线性回归方程为y=0.7821x+0.0838,相关系数R2=0.9957(见图1)。
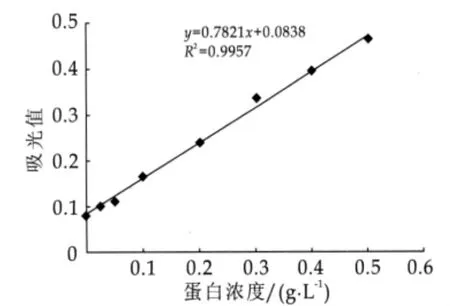
图1 BCA标准曲线
2.5 SDS-PAGE分析蛋白的纯度
(1)制备分离胶和浓缩胶:分离胶的质量分数为12%。
(2)样品制备:将样品配置成一定质量浓度的溶液(2 g/L),然后和样品缓冲液按1︰1混合,按体积分数为10%的比例加入巯基乙醇,将样品煮沸3 min,备用。
(3)电泳:将样品加入制好的胶内,上样量为10μL,分子量范围为14.4~97.4 ku。80 V恒压,当电泳条带跑出浓缩胶和分离胶分界面后110 V恒压。
(4)染色、脱色。将跑好的胶放入制好的染色液中,染色2 h,倒掉染色液,用PBS冲洗两次,然后加入脱色液,每隔2 h更换1次脱色液,直至条带清晰,约需12 h。
3 结果与讨论
3.1 根据蛋白分离纯化峰收集β-Lg
图2为β-Lg的样品峰;图3为标样峰。由图2和图3可以看出,对应标样峰中的出峰体积,可以确定此峰为β-Lg的峰,而且此峰周围几乎没有杂峰,便于收集。收集此峰,然后将收集的样品进行冷冻干燥,这一步是为了浓缩,然后进行脱盐。

3.2 脱盐
图4为β-Lg的脱盐峰。图4中,左峰是对应的β-Lg的峰,右边的电导峰对应的是盐类。由图4可以看出,所使用的脱盐柱子可以将β-Lg和盐完全分开,并且经过第一步以后β-Lg没有杂峰,是非常纯的。将脱盐后的样品再冷冻干燥,所得样品即为β-Lg的分离物。
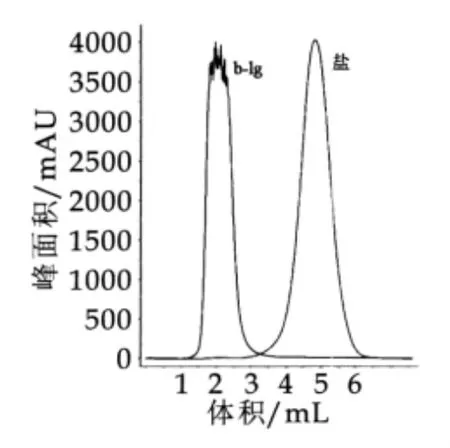
图4 脱盐峰
3.3 BCA试剂盒测定的结果
将所测得的β-Lg平均读数0.642带入标准曲线的方程中,计算β-Lg的质量浓度为0.7137 g/L,根据β-Lg原样品质量浓度为1 g/L,可知其质量分数为71.37%。
3.4 SDS-PAGE分析蛋白纯度结果分析
图5为SDS-聚丙烯酰胺凝胶电泳结果。
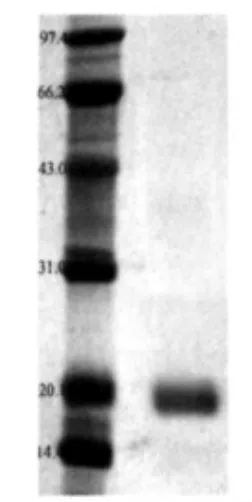
图5 SDS-聚丙烯酰胺凝胶电泳图
图5中,左边为标准蛋白(marker),从上到下分别为兔磷酸化酶B(97.4 ku),牛血清白蛋白(66.2 ku),兔肌动蛋白(43.0 ku),牛碳酸酐酶(31.0 ku),胰蛋白酶抑制剂(20.1 ku),鸡蛋清溶菌酶(14.4 ku);右边为β-Lg。
由图5可以看出,此方法所提取的β-Lg是非常纯的,没有杂峰,由此也知道上面BCA方法测定的蛋白中,质量分数为71.37%,剩余的物质基本是分离纯化后的盐类,杂蛋白很少,可以忽略。
4 结 论
本研究介绍了一种简单的方法从WPC中提取β-Lg,并用蛋白分离纯化将粗提的β-Lg进一步提纯,然后脱盐冻干,得到的即是比较纯的β-Lg。然后是利用BCA法测定蛋白质量浓度,又利用SDS-聚丙烯酰胺凝胶电泳来检测β-Lg的纯度。
传统的方法是[15]:将鲜牛乳离心去除脂肪,下层即为脱脂乳;然后凝乳,等电点沉淀法去除酪蛋白;最后是盐析,用硫酸按盐析法按饱和度将乳清蛋白沉淀下来,再将盐析后的乳清蛋白透析,然后再除盐。此方法的缺点是操作比较粗,提取出来的β-Lg纯度不够,杂蛋白质量浓度高,而且大家用凯式定氮法测量蛋白质量浓度,由于其使用了硫酸铵,所测得的含氮量会偏高。
本文根据分离纯化标样中对应分子量的峰确定粗提的β-Lg中所要收集的峰,这一步可以使粗提的β-Lg进一步纯化,脱盐过程又使得纯化β-Lg中的盐类降到最低,这两个步骤使得最终的β-Lg纯度达到最高。
利用BCA法测定上述步骤中得到的β-Lg中的蛋白质量浓度,根据标准曲线计算其结果为713.7g/L,此值说明蛋白质量浓度较高,此方法是一种纯度非常高的β-Lg分离方法。
从SDS-聚丙烯酰胺凝胶电泳的结果可以看出,经过分离纯化后的β-Lg的电泳条带只有18.3 ku处的一条带,没有其他的杂带,说明β-Lg纯度非常高。
综合本研究的实验结果可以看出,本实验使用的提取方法,能够提取出纯度非常高的β-Lg,而且操作简单,所需的仪器药品都是常规使用的,价格都不高,所以成本比较低,适合一般实验室进行中小规模的分离提取。
[1]HORTON B.Wheys of Recovery[J].Dairy Industry International,1996,61(5):39-40.
[2]MAILLIART P,RIBADEAU-DUMAS B.Preparation of B-Lactoglobulin and B-Lactoglobulin Free Proteins from Whey Retentate by NaCl Salting Out at Low Ph[J].Journal of Food Science,1988,53:743-745.
[3]MATE H J,KROCHTA J M.B-Lactoglobulin Separation from Whey Protein Isolate on a Large-Scale[J].Journal of Food Science,1994,59:1111-1114.
[4]CAESSENS,P W J R,VISSER,S,GRUPPEN H.Method for the Isolation of Bovine B-Lactoglobulin From a Cheese Whey Protein Fraction and Physicochemical Characterization of the Purified Product[J].International Dairy Journal,1997,7:229-35.
[5]OUTINEN,TOSSAVAINEN,,SYYÄOJA.Chromatographic Fractionation of A-Lactalbumin and B-Lactoglobulin with Polystyrenic Strongly Basic Anion Exchange Resins[J].Lebensmittel-Wissenschaft Und-Technologie,1996,29:340-343.
[6]KRISTIANSEN K R,OTTE J,IPSEN,R,et al.Large-Scale Preparation of B-Lactoglobulin a and B by Ultrafiltration and Ion-Exchange Chromatography[J].International Dairy Journal,1998,7:805-812.
[7]BOBE G,BEITZ D C,FREEMAN A E,et al.,Separation and Quantification of Bovine Milk Proteins by Reversed-Phase High Performance Liquid Chromatography[J].J Agric Food Chem,1998,46:458–463.
[8]BORDIN G,CORDEIRO F,RAPOSO B,et al.Identification and Quantification of Major Bovine Milk Proteins by Liquid Chromatography[J].J Chromatogr,2001,928:63-76.
[9]B MANJI,A HILL,Y KAKUDA,DM IRVINE,Rapid Separation Of Milk Whey Proteins By Anion Exchange Chromatography,J.Dairy Sci.1985,68:3176-3179.
[10]SK BASAK,A VELAYUDHAN,K KOHLMANN,et al.,ElectrochromatographicSeparationOfProteins,J.Chromatogr.A 1995,707:69-76.
[11]GODOVAC-ZIMMERMANN J,KLOSTERMEYER H,Isolation And Rapid Sequence Characterization Of Two Novel Bovine BLactoglobulins I And J[J].J Protein Chem,1996,15:743-750.
[12]WAL J M,BERNARD H,YVON M,et al.Enzyme Immunoassay of Specific Human IgE to Purified Cow’s Milk Allergens[J].Food&Agricultural Immunology,1995,7:175-187.
[13]ROWLAND S J.The Protein Distribution in Normal and Abnormal Milk[J].Journal of Dairy Research,1938,9:47-57.
[14]MAILLIART P,RIBADEAU-DUMAS B.Preparation of B-Lactoglobulin and B-Lactoglobulin Free Proteins from Whey Retentate By NaCl Salting Out at Low pH[J].Journal of Food Science,1988,53:743-745.
[16]乔秉善.变态反应学实验技术[M].北京:中国协和医科大学出版社,2002:98-100.
Separation β-lactoglobulin from WPC
DUAN Cui-cui,HUO Gui-cheng,REN Da-xi,FENG Fang-fei
(Key Lab of Dairy Science,Education Ministry,Food College,Northeast Agricultural University,Harbin 150030,China)
β-Lactoglobulin(β-Lg)is the major protein in whey,several methods for isolating β-Lg have been described.However,none of the existing processes or techniques has been effectively implemented to achieve inadequate yield/purification.The aim of this study was to introduce a simple,reproducible,and less expensive method to isolate β-Lactoglobulin from whey protein concentrate.Moreover,the use of BCA protein concentration determination shows that the concentration of extracted β-Lg is very high,while the SDS-PAGE(sodium dodecyl sulfate polyacrylamide gel electrophoresis)result shows that the extracted β-lg has a high purity.
protein purification;β-Lactoglobulin;SDS-PAGE
TS252~59
A
1001-2230(2010)01-0019-04
2009-05-17
东北农业大学生物乳业创新团队资助项目(CXT 007-2)。
段翠翠(1984-),女,硕士,从事食品科学方面的研究。
霍贵成
