植物乳杆菌C8-1产类细菌素的初步研究
2010-01-04张子健刘玉恩赵谦张柏林
张子健,刘玉恩,赵谦,张柏林
(河北农业大学 食品科技学院,河北 保定 071000)
植物乳杆菌C8-1产类细菌素的初步研究
张子健,刘玉恩,赵谦,张柏林
(河北农业大学 食品科技学院,河北 保定 071000)
从发酵2周的泡菜中分离到66株乳杆菌,以其中4株乳杆菌作为出发菌株进行紫外诱变处理得到一株产类细菌素的突变株C8-1。基于细胞形态、生理生化和16S rDNA测序数据,菌株C8-1被鉴定为植物乳杆菌(Lactobacillus plantarum)。菌株C8-1所产的类细菌素具有较宽的抑菌谱,能够抑制大肠杆菌和金黄色葡萄球菌等多种食品腐败菌和致病菌;有较好的热稳定性,在4℃冷藏5 d和-20℃冷冻5 d以及60,80,100℃和121℃分别加热15 min,活性损失均不超过6%;且抑菌活性随pH值增大逐步降低,当pH≥6时,抑菌活性消失,对胃蛋白酶、木瓜蛋白酶耐受性较强,对胰蛋白酶较为敏感。这些数据表明,产类细菌素的植物乳杆菌C8-1在食品加工中具有进一步地潜在应用价值。
类细菌素;植物乳杆菌;抑菌特性
0 引 言
在代谢过程中,乳酸菌(Lactic acid bacteria,LAB)除了能够产生乳酸、乙酸及过氧化氢以外,还可以产生具有抑菌或杀菌作用的蛋白类物质——细菌素[1-5]。鉴于乳酸菌产生的细菌素具备高效、体内无残留、无抗药性及不污染环境等特点,近年来被推荐作为生物型的防腐剂用于食品的保藏当中[6]。本研究从发酵2周后的泡菜分离筛选到能够产生广谱抑菌的产细菌素植物乳杆菌菌株,经UV诱变处理得后到一株产高效细菌素的植物乳杆菌C8-1,对其所产生的细菌素部分特性进行了研究,以下是部分结果,旨在为寻求能够潜在用于乳品保存的生物型防腐介质提供依据。
1 材料与方法
1.1 材料
实验菌株:从发酵两周后的泡菜中共分离出66株乳杆菌,现由北京林业大学工业微生物菌种保藏室(BJFU)冻干保藏。指示菌菌株及来源:抑菌谱中所用菌株见表5。金黄色葡萄球菌和大肠杆菌由河北农业大学食品学院提供;其他指示菌均由北京林业大学工业微生物菌种保藏室提供。
1.2 抑菌活性检测[7]
本研究采用单层琼脂平板打孔法,即在无菌平皿中加入浓度约107mL-1的指示菌菌悬液1 mL,倒入约20 mL的MRS培养基,混合均匀,放置30 min,打孔(直径6.8 mm)。分别向孔内加入等量的抑制菌离心发酵上清,37°C培养24 h后用游标卡尺准确测量抑菌圈的直径。
1.3 菌种的筛选
1.3.1 乳酸菌的分离
在无菌操作台中吸取发酵后期的泡菜汁进行10倍梯度稀释,分别取0.1 mL稀释度为10-5~10-7的泡菜汁于培养皿,用质量分数为2%的CaCO3的MRS培养基倒平板,混匀,37℃倒置培养48 h。挑取有溶钙圈的单个菌落进行镜检,选取革兰氏阳性菌接种于MRS液体培养基,37℃培养,备用。
1.3.2 指示菌和拟产类细菌素菌株的筛选[8,9]
采用单层琼脂平板打孔法对分离的所有乳酸菌进行两两相交拮抗,能够对大部分菌株产生明显抑菌圈的菌株选定为拟产类细菌素菌株,同时以金黄色葡萄球菌作为指示菌,进行抑菌试验。
1.3.3 紫外诱变拟产类细菌素菌株[10]
将培养至对数期的拟产细菌素菌株进行转速为12000 r/min,4°C离心5 min, 用生理盐水洗两次,进行10倍梯度稀释,选取10-5~10-7稀释度的菌液分别吸取1 mL涂布于MRS固体平板上,于黑室内无菌操作台中的紫外灯下进行诱变。紫外灯功率15W,照射距离30 cm,照射时间30 s,避光倒置培养48 h。每株出发菌诱变后达到75%~90%致死率时,从诱变平板分别挑取5个单一突变株菌落接种于MRS液体培养基,37℃培养24 h,离心发酵液,取上清。分别以各自出发菌株做参比,以金黄色葡萄球菌做指示菌,做抑菌实验,挑选抑菌圈有明显增大的突变菌株为后续试验菌株。
1.3.4 产类细菌素菌株的确定[11]
(1)排除有机酸实验。将挑选的突变菌株以体积分数为1%接种量接种于MRS液体培养基,37℃培养24h, 发酵液经转速为12 000 r/min,4°C离心20 min,将所得上清液的pH值调至5.0,并用pH值为5.0的乳酸作对照,以筛选的敏感指示菌做抑菌实验,比较抑菌效果。
(2)排除H2O2实验。将挑选的突变株以体积分数为1%接种量接种于MRS液体培养基,37℃培养24 h,发酵液经12 000 r/min,4°C离心20 min,再于80°C加热10 min以使H2O2快速分解,用筛选的敏感指示菌做抑菌试验,比较处理前后抑菌圈变化情况。
(3)硫酸铵盐析产物的抑菌实验。将挑选的突变株以体积分数为1%接种量接种于MRS液体培养基,37℃培养24 h,发酵液经12 000 r/min,4 C离心5 min去除菌体。将离心后的发酵液进行40%~70%的梯度盐析,4°C静置过夜。次日取出后12 000 r/min,4°C离心20 min,将沉淀复溶于3 mL浓度为0.02 mol/L(pH值为5.0)的柠檬酸盐缓冲液中,制成盐析蛋白液。以敏感指示菌做抑菌试验,以未经盐析处理的突变株离心发酵上清液、70%饱和度的(NH4)2SO4溶液和pH值为5.0的柠檬酸盐缓冲液作对照。观察蛋白盐析物的抑菌情况,参比对照确定产类细菌素菌株。
1.4 产类细菌素菌株的鉴定
生理生化鉴定参阅文献[12-14]。
产类细菌素菌株16S rDNA序列同源性分析鉴定:产类细菌素菌株的16S rDNA扩增及序列测定均委托宝生物工程有限公司进行。扩增产物经纯化测序得到的PCR序列在GeneBank中利用BLAST程序进行同源性比较。
1.5 产类细菌素菌株的抑菌特性
1.5.1 抑菌谱
选取植物乳杆菌、嗜酸乳杆菌、乳酸乳球菌、金黄色葡萄球菌、大肠杆菌、假单孢菌、黄杆菌、鞘氨醇杆菌等18株菌为指示菌,用产细菌素菌株的离心发酵上清液做抑菌试验,确定其抑菌范围。
1.5.2 温度稳定性试验
取产细菌素菌株的离心发酵上清液分装于不同的试管中,分别于60°C,80°C,100°C,120°C条件下分别处理15 min,4°C和-20°C分别处理5 d,以不做处理的离心发酵上清作对照,以鞘氨醇杆菌为指示菌进行抑菌试验,比较抑菌效果的变化情况,确定该细菌素的温度稳定性。
1.5.3 pH值稳定性实验
用浓度为1 mol/L为HCl溶液或浓度为2 mol/L的NaOH溶液调产细菌素菌株离心发酵上清液的pH值分别至3,4,5,6,7,8,9,10; 以不做处理的离心发酵上清液做对照,以鞘氨醇杆菌为指示菌做抑菌试验,比较抑菌效果的变化情况,确定该细菌素在不同环境pH值条件下的稳定性。
1.5.4 蛋白酶敏感性实验
将胃蛋白酶、胰蛋白酶、木瓜蛋白酶分别配制成质量浓度为5 g/L溶液,调胃蛋白酶液pH值至2.0~3.0,木瓜蛋白酶液pH值为6.0,胰蛋白酶液pH值为7.8。酶液与离心发酵上清均37℃预热1 h。分别取1 mL酶液于试管中,再分别加入4 mL产细菌素菌株的离心发酵上清液,使最终酶质量浓度为1 g/L,37℃水浴4 h进行反应。以鞘氨醇杆菌为指示菌,以未经处理的离心发酵上清液为对照,进行抑菌实验。比较抑菌效果的变化情况,确定该细菌素在不同酶处理条件下的敏感性。
1.6 试验中的数据处理
试验中所有抑菌圈直径(mm)均垂直测量两次,取两次测量的平均值,最后取3组平行测量值的平均值,所得结果为平均值±标准差。试验数据采用SPSS 10.0统计分析软件进行差异显著性分析,显著性水平均取5%(P﹤0.05)。
2 结果与分析
2.1 乳酸菌的分离
自泡菜中共筛选到119株乳酸菌,其中球菌53株,杆菌66株,镜检均为革兰氏阳性。其菌落为乳白色或略显黄色,菌落凸起,光滑、湿润,边缘整齐,符合乳酸菌菌落特征。
2.2 指示菌与拟产细菌素菌株的筛选
通过对66株乳酸菌以单层琼脂平板打孔法进行相互抑制试验,选取对多数乳酸菌有抑制作用的乳酸杆菌C8,C10,C18,C25为拟产细菌素菌株, 选择对多数乳酸菌敏感的乳酸杆菌C6。如表1所示,以乳酸杆菌C6和金黄色葡萄球菌为指示菌作指示菌进行抑菌试验,4株拟产细菌素菌株均显示抑菌性。
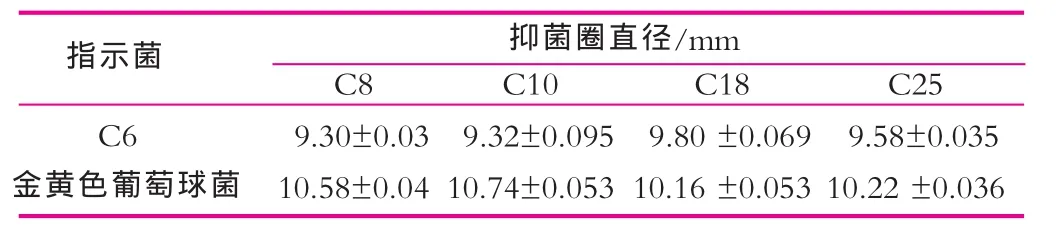
表1 拟产细菌素菌株的抑菌作用
2.3 4株拟产细菌素菌株的紫外诱变
4株拟产细菌素菌株经紫外诱变培养后分别在UV照射平板上挑取单一菌落进行抑菌试验,仅筛选到C8的诱变菌株C8-1和C10的诱变菌株C10-2抑菌活性大于出发菌株,如表2所示,因此后续实验以C8-1和C10-2为抑制菌株进行。乳酸杆菌C8经紫外诱变后活菌计数检测结果为1.04×108mL-1,对照平板计数结果为4.19×108mL-1,致死率为75.2%。

表2 诱变菌株的抑菌效果
2.4 产细菌素菌株的确定
2.4.1 酸中和实验
如表3所示,乳酸杆菌C8-1和C10-2离心后的发酵上清液被中和至pH值为5.0后,均有明显抑菌效果,而作为对照的pH值为5.0的乳酸并没有产生抑菌圈。此结果说明发酵上清液中除乳酸外还存在其它抑菌活性物质。

表3 中和有机酸后的抑菌效果
2.4.2 排除过氧化氢实验
如表4所示,乳酸杆菌C8-1和C10-2的离心发酵上清液经80°C水浴加热处理10 min,使过氧化氢充分分解后,以乳酸杆菌C6做指示菌进行抑菌试验,测量的抑菌圈直径基本没有变化,说明主要抑菌物质不是过氧化氢。
2.4.3 硫酸铵盐析产物的抑菌实验
乳酸杆菌C8-1和C10-2分别进行40%~70%硫酸铵分段盐析,离心得到的蛋白以3 mL浓度为0.02 mol/L(pH值为5.0)的柠檬酸盐缓冲液(Citrate Buffer,CB)溶解后,以乳酸杆菌C6做指示菌进行抑菌实验。实验结果显示只有菌株C8-1的盐析蛋白有抑菌作用。作为对照的70%饱和度的硫酸铵溶液和浓度为0.02 mol/L柠檬酸盐缓冲液均没有抑菌活性。由此确定乳酸杆菌C8-1为产细菌素菌株,如图1所示。

表4 排除过氧化氢后的抑菌效果
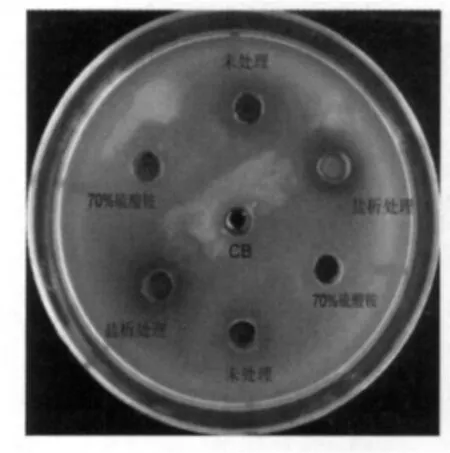
图1 C8-1盐析产物抑菌
2.5 产细菌素菌株鉴定
2.5.1 菌体形态
乳酸菌C8-1于MRS固体培养基时均为微小,凸起,圆形,光滑,乳白色菌落形态,菌落直径2~3 mm。镜检均为革兰氏阳性杆菌,菌体两端钝圆,单个或成对排列。
2.5.2 生理生化鉴定
测试表明,菌株C8-1在10℃生长,45℃不生长;在质量分数为6.5%NaCl的MRS培养基中生长;在质量分数为10%和18%NaCl的MRS培养基中不生长;在pH值为4和9的MRS中均生长;其过氧化氢酶实验阴性,不从精氨酸产氨,不水解淀粉。对18种糖醇进行糖发酵试验表明,菌株C8-1不能利用鼠李糖,阿拉伯糖反应为弱阳性,菌株C8-1的松三糖反应为弱阳性,其余反应均为阳性。根据以上特性,参阅文献[12-14],乳酸菌C8-1被初步鉴定为植物乳杆菌。
2.5.3 16SrDNA序列同源性分析
将菌株C8-1的16S rRNA序列在NCBI上用Blast程序进行同源性搜索,比对结果表明,C8-1与植物乳杆菌WCFS1(NC_004567.1)的16S rRNA序列同源性达到99%。结合细胞形态和生理生化实验,乳杆菌C8-1被鉴定为植物乳杆菌。目前,植物乳杆菌C8-1已提交到NCBI, 其Genebank accession Number是FJ378889,该菌株现由北京林业大学生物学院食品系保存(菌株资源平台编号:1511C0016000000302;菌株保藏编号:BJFU 1.0182)。
2.6 植物乳杆菌C8-1的抑菌谱
抑菌谱如表5所示。以18株菌为指示菌做抑菌谱发现植物乳杆菌C8-1所产的细菌素只对其中的4株乳酸菌不产生抑制作用,对其它菌株均有抑制效果,具有广泛的抑菌作用。值得注意的是,该细菌素不仅对乳酸菌、金黄色葡萄球菌等革兰氏阳性菌有抑制作用,而且对革兰氏阴性的大肠杆菌、黄杆菌、鞘氨醇杆菌和假单孢菌抑制性极强。
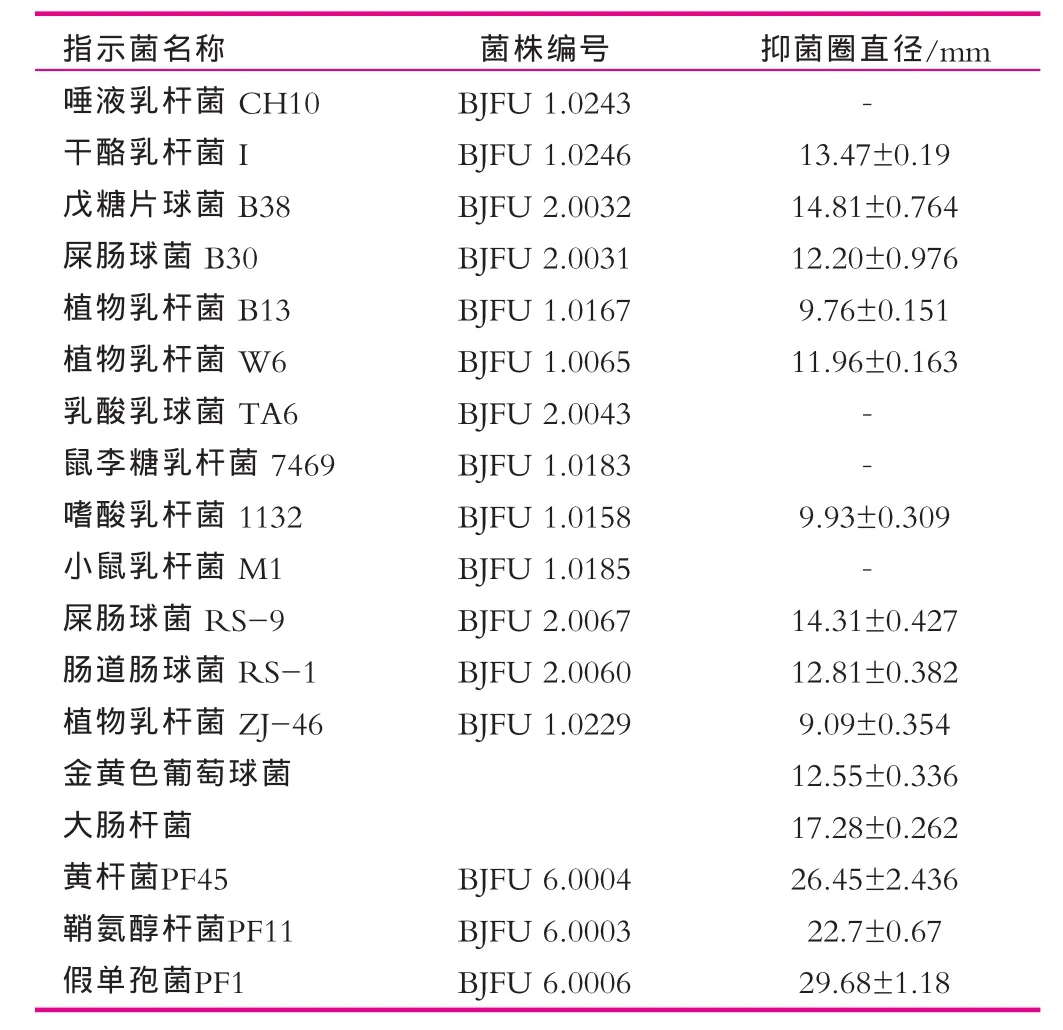
表5 植物乳杆菌C8-1所产细菌素的抑菌谱
2.2 细菌素的理化特性
2.2.1 温度稳定性
植物乳杆菌C8-1的离心发酵上清液经温度为60,80,100,121℃分别处理15 min;4℃和-20℃分别贮藏5d,以鞘氨醇杆菌PF11做指示菌进行抑菌实验,比较抑菌圈变化。
由表6可见,在60~121°C范围内,随温度的不断增加类细菌素活性逐步降低,121°C处理15 min后抑菌效果降低幅度最大,达到5.4%。4°C处理5 d后抑菌效果基本没有变化,而-20°C处理5d后抑菌效果降低幅度最大,达到5.76%。由此可见,不同温度处理后该类细菌素的抑菌活性降低不超过6%,相当稳定,因此判定该类细菌素在高温和冷冻冷藏处理时都具有较好的稳定性。

表6 类细菌素的温度稳定性
2.2.2 pH值稳定性
将植物乳杆菌C8-1的离心发酵上清液的pH值分别调至3,4,5,6,7,8,9,10; 以鞘氨醇杆菌PF11为指示菌做抑菌实验,比较抑菌圈大小的变化,结果如图2所示。
试验结果显示,该类细菌素在pH值为3~5范围内,抑菌活性随pH值升高而逐渐降低,在pH值为6~10范围内,类细菌素活性为零。该类细菌素在pH值为5.0时的抑菌活性比pH值为3.0时下降39.62%,由此确定该类细菌素仅在酸性条件下具有抑菌活性,pH≥6时失活。

图2 类细菌素的pH值稳定性
2.2.3 蛋白酶稳定性
以胃蛋白酶、胰蛋白酶、木瓜蛋白酶分别处理菌株C8-1的离心发酵上清液,以鞘氨醇杆菌PF11为指示菌进行抑菌试验,以不作处理的离心上清液作对照,比较抑菌圈大小的变化。
试验结果表明,该类细菌素经胃蛋白酶、胰蛋白酶、木瓜蛋白酶分别处理后,活性均有所降低,说明该类细菌素确系蛋白类物质。该类细菌素对胰蛋白酶最敏感,抑菌圈从处理前的24.06 mm下降为20.69 mm,抑菌活性降低14%。

表7 类细菌素对蛋白酶的稳定性
3 结束语
植物乳杆菌C8-1产生的抑菌物质对胰蛋白酶敏感,能明显抑制G-菌的生长,属于蛋白类抑菌物质。该菌株产生的类细菌素物质具有活性高、耐高温、在酸性条件下稳定等特点,有较宽的抑菌谱,能够抑制常见食源性腐败菌和致病菌,表明该类细菌素在调节肠道微生态平衡以及延长食品货架期等方面有一定的应用潜力。
[1]汤凤霞,乔长晟.天然生物食品防腐剂的研究与应用[J].世界农业,2002(2):34-36.
[2]徐进,冉陆,罗雪云.乳酸菌细菌素的生物合成与应用[J].卫生研究,2002(3):211-213.
[3]杨洁彬,郭兴华,张箎.乳酸菌:生物学基础及应用[M].北京:中国轻工业出版社,1996.
[4]贡汉生,孟祥晨,刘红娟.一株布氏乳杆菌所产类细菌素的初步纯化与部分特性[J].微生物学通报,2008,35(2):193~199.
[5]叶巍,霍贵成.乳酸菌细菌素应用研究进展[J].乳业科学与技术,2006(2):56-58.
[6]VIRGINIA S O,AIDA A P,MARIA E.N-Characterization of a Bacteriocin-like Substance Produced by Avaginal Lactobacilluss Alivarius Strain[J].Appl Environ Microbiol,1999,65(5):5631-5635.
[7]赵艳玲,邓方明,杨细平等.生物防腐剂——乳酸菌素[J].中国食物与营养,2005(2):27-29.
[8]崔建超.乳酸菌产生的细菌素的生物学特性及其在乳品中的应用[D].保定:河北农业大学,2002.
[9]BAREFOOT S F,KLAENHAMMER T R.Detection and Activity of Lactacin B,a Bacteriocin Produced by Lactobacillus acidophilus[J].Applied and Enviromental Microbiology,1983,45:1808-1815.
[10]章明春.工业微生物诱变育种[M].北京:科学出版社,1984:106-109.
[11]周光燕,张小平.四川地区自然发酵泡菜中乳酸菌的生物学特性研究[R].四川:四川省微生物资源平台菌种保藏中心,2006.
[12]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第8版.北京:科学出版社,1984.
Preliminary characterization of bacteriocin-like substance formed by Lactobacillus plantarum C8-1
ZHANG Zi-jian,LIU Yu-en,ZHAO Qian,ZHANG Bo-lin
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071001,China)
Among 66 isolates of Lactobacillus from traditional Chinese vegetables fermented for two weeks,four isolates were induced by UV light for producing bacteriocin.From these four lactobacilli strains,the mutant C8-1 was proved to produce proteins able to have antibacterial activity.Strain C8-1 was further identified as Lactobacillus plantarum according to its cell morphology,physiological-biochemistry and 16S rDNA data.Bacteriocin-like substance produced by strain C8-1 had a wide antibacterial spectrum which inhibited food spoiled and pathogenic bacteria.It showed good stability within a wide range of temperatures.When refrigerated at 4°C or frozen at-20°C for 5d as well as treated at 60°C,80°C,100°C or 121°C for 15min,the activity loss of the bacteriocin was less than 6%.Its antibacterial activity decreased with gradually evaluated pH,and disappeared when pH was higher than 6.The bacteriocin was resistant to pepsin and papain,but highly sensitive to trypsin.The present information shows that Lactobacillus plantarum C8-1 should be very potential for use as biological control agent in food processing and dairy products.
Bacteriocin,Lactobacillus plantarum,antibacterial properties
Q93-33
A
1001-2230(2010)01-0015-04
2009-09-16
本研究由国家高新技术研究发展计划(863计划)(2006AA10Z344)、国家科技基础条件平台 “工业微生物菌种资源”项目(2005DKA21204-12)资助。
张子健(1984-),女,硕士研究生,研究方向为农产品加工及贮藏工程。
张柏林
