草地早熟禾新格莱德胚性愈伤组织原生质体培养及植株再生的研究
2010-01-02赵小强马晖玲林栋周万海吴翔
赵小强,马晖玲* ,林栋,周万海,吴翔
(1.甘肃农业大学草业学院,甘肃兰州 730070;2.草业生态系统教育部重点实验室,甘肃兰州 730070;3.中-美草地畜牧业可持续研究中心,甘肃 兰州730070)
草地早熟禾(Poa pratensis)为北方主要的冷季型草坪草。其品种新格莱德因具有株体低矮、持绿期长;生活力强、经久耐用、极耐践踏;耐低修剪;极耐寒、抗旱性超群;抗病虫力突出等特点而被广泛应用于草坪绿地的建植。以新格莱德作为一种优良的亲本材料,通过以原生质体培养为基础的细胞融合技术来改良草地早熟禾其他常见栽培品种的性状特性,获得杂种优势后代,达到草地早熟禾优良品种选育的目的。迄今为止,细胞融合技术已成为改良植物性状的重要手段,而从原生质体获得再生植株是进行细胞融合的先决条件[1]。Vander等[1]建立了草地早熟禾的原生质体悬浮培养体系,获得了白化苗;随后Kirsten等[2]也建立了草地早熟禾品种“Geronimo”的悬浮培养体系,并以此悬浮细胞体系为材料获得原生质体和再生植株。
本研究从草地早熟禾品种-新格莱德成熟种子中诱导出愈伤组织,并经多次继代培养产生松软的胚性愈伤组织,再从中游离出原生质体,经原生质体培养,获得再生绿苗。这一研究成果对于进一步进行草地早熟禾体细胞杂交和外源基因的转化提供了研究基础。
1 材料与方法
1.1 愈伤组织的诱导、继代以及胚性愈伤组织的筛选
于2007年3月至2008年11月,选取草地早熟禾品种新格莱德(Nuglade)成熟种子,灭菌后接种于含3.0 mg/L 2,4-D、0.5 mg/L 6-BA的MB5(MS大量+MS微量+B5有机+铁盐+蔗糖+琼脂)培养基上诱导愈伤组织,选淡黄色或鲜黄色的愈伤组织在相同的培养基中进行继代增殖。每15~20 d继代1次,连续继代10~12次后,大部分大颗粒淡黄色的胚性愈伤组织转变为淡黄色易分散的小颗粒,最终成为稳定的细胞系,然后取此类愈伤组织,用于原生质体的分离。胚性愈伤组织的诱导和继代培养在黑暗、(25±1)℃条件下进行。
1.2 原生质体的分离与其纯化
从在固体培养基上继代培养了7~9个月、更换新鲜培养基培养了8~10 d的新格莱德愈伤组织细胞系中取1 g左右的材料,于10 mL混合酶解液中分离原生质体。在本研究中设置了4个酶处理组合。
Ⅰ:1%纤维素酶Cellulase Onozuka R-10(Yakult,日本Japan),1%离析酶Macerozyme R-10(Yakult,日本Japan);
Ⅱ:1%纤维素酶Cellulase Onozuka R-10(Yakult,日本Japan),1%离析酶Macerozyme R-10(Yakult,日本Japan),0.3%崩溃酶Driselase(Sigma);
Ⅲ:1%纤维素酶Cellulase Onozuka R-10(Yakult,日本Japan),1%离析酶 Macerozyme R-10(Yakult,日本Japan),0.3%崩溃酶Driselase(Sigma),0.3%果胶酶Pectolase Y-23(Yakult,日本Japan);
Ⅳ:1%纤维素酶Cellulase Onozuka R-10(Yakult,日本Japan),1%离析酶Macerozyme R-10(Yakult,日本Japan),0.3%崩溃酶Driselase(Sigma),0.5%果胶酶Pectolase Y-23(Yakult,日本Japan)。
其中酶溶剂(CPW-13,mg/L)为:KH2PO4(27.2)、KNO3(101.0)、CaCl2·2H2O(1 480.0)、MgSO4·7H2O(246.0)、KI(0.16)、CuSO4·5H2O(0.025)、5.0 mmol/L 2,(N-吗啡啉)-乙基磺酸、13%甘露醇,pH 5.8。经0.45 μ m微孔滤膜过滤灭菌。
在(26±1)℃黑暗条件下,将愈伤组织加入不同的酶液中静置30 min,然后在50 r/min的摇床上震荡,进行酶解。每隔2 h设置1个酶解时间段,并且每2 h测定分离出的原生质体产量和活力,以确定适宜的酶解时间。
酶解材料经200、300目无菌尼龙网筛过滤,除去没有酶解完全的组织和细胞团,滤液经250 r/min离心5~10 min收集原生质体。用酶溶剂CPW-13(成分同上)悬浮,再离心,这样反复2~3次。最后用原生质体培养液洗涤2次。
1.3 原生质体的培养和植株再生
将经洗涤的原生质体重新悬浮于原生质体培养基中,调整密度到2×105~5×105个/mL。原生质体培养介质采用常用的KM8P[4]基本培养基,含3.0 mg/L 2,4-D、0.5 mg/L 6-BA、100 mg/L水解酪蛋白、100 mg/L水解乳蛋白、1%蔗糖、0.4 mol/L甘露醇、pH为5.8。吸取2 mL原生质体悬浮液于直径为6 cm的培养皿中,在(26±1)℃,黑暗条件下液体浅层静置培养。在第7和14天时更换甘露醇浓度依次减半的新鲜的培养基。4周之后将形成的肉眼可见的小愈伤组织转移到除去甘露醇的培养基进行培养。将长至2 mm左右的小愈伤组织转移至含3 mg/L 2,4-D、0.5 mg/L 6-BA的MB5培养基继续进行培养,然后转移至含0.5 mg/L NAA、5 mg/L 6-BA的MS分化培养基上培养。
1.4 原生质体活性的检测
吸取1滴原生质体悬浮液置于载玻片上,在荧光显微镜下检测其活性。采用荧光素双醋酸酯(FDA)进行染色。FDA 用丙酮配制成5 mg/mL溶液,然后按照25 μ L FDA/mL进行染色,静置5 min后观察,随机选取3个视野统计原生质体的数量。
2 结果与分析
2.1 胚性愈伤组织的诱导、继代以及胚性愈伤组织的筛选
成熟种子在诱导培养基中培养4周后,即可诱导形成大量的愈伤组织,选取淡黄色或鲜黄色的愈伤组织(图1-1)在相同的培养基中进行继代培养,继代培养时去除水渍状的愈伤组织(图1-2)。15~20 d继代1次,继代10~12次后,愈伤组织外观呈淡黄色或鲜黄色颗粒型,质地较紧密,且用无菌水将其悬浮在倒置显微镜下观察,此时愈伤组织的细胞大多数为细胞质浓、等径、壁薄、核大、分裂旺盛,最终成为稳定的细胞系(图1-3)。试验证明,从这种愈伤组织能够分离出大量的原生质体。
2.2 原生质体的游离
2.2.1 供试材料的选择 选取活力旺盛的胚性愈伤组织是草地早熟禾新格莱德原生质体游离与培养成功的关键。研究发现,活力旺盛的愈伤组织在酶解时可获得较多且生命力强的原生质体(图1-4),且获得的原生质体在培养过程中且容易分裂,本试验所得的结论与王喆之等[3]的结论是一致的。
2.2.2 适宜的酶液成分的选定 经多次继代的淡黄色胚性愈伤组织细胞系处于旺盛生长期,取此类愈伤组织于混合酶中游离原生质体。经50 r/min震荡可得大量的原生质体。在游离原生质体时,不同的酶液组成(表1)以及酶解时间对原生质体的产量和活力都有很大的影响,经试验得到最佳的酶液组合为:1%纤维素酶Cellulase Onozuka R-10、1%离析酶Macerozyme R-10、0.3%崩溃酶Driselase、0.5%果胶酶Pectolase Y-23。
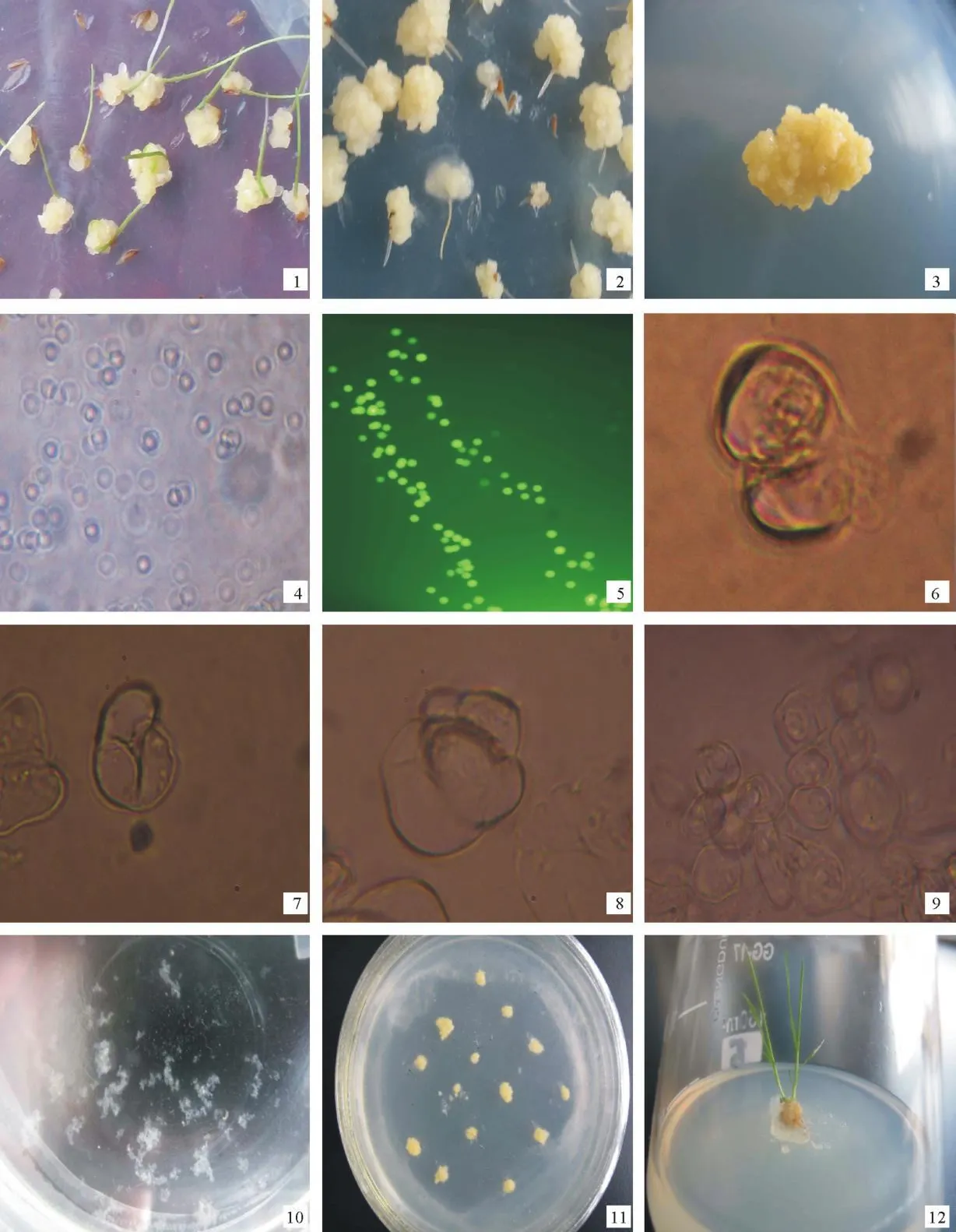
图1 草地早熟禾新格莱德原生质体培养及其植株再生Fig.1 Protoplasts culture and plant regeneration in Nuglade(P.pratensis)
2.2.3 最佳酶解时间的确定 本研究表明,酶解时间少于14 h时,原生质体的产量及其活力较低,均少于酶解14 h时的产量和活力26.7×105个/g,71.2%。当酶解时间超过18 h时,原生质体的产量为23.3×105个/g,但是活力下降下降到68.3%,不利于原生质体的培养(表2)。酶解时间以14~16 h为好。
2.2.4 渗透压的调节 酶和酶解时间是游离原生质体的主要因素,但酶液中渗透压稳定剂在原生质体的游离中也起到很关键的作用。在原生质体的分离中,常加入0.35~0.80 mol/L的甘露醇、葡萄糖、蔗糖或山梨醇来调节酶液的渗透压[4]。本试验在酶液中加入了0.40 mol/L甘露醇,有效地提高了原生质体的释放量和稳定性。
2.2.5 适宜的继代培养天数确定 在上述酶解条件下,研究了愈伤组织不同继代培养时间对原生质体分离效果的影响(图2)。结果表明,继代培养第9天时,可获得大量的具有活力的原生质体(图1-5),并且多数细胞质较浓,在以后的培养中易于分裂。因此,继代培养时间定为8~10 d。
2.3 原生质体的培养和植株再生
2.3.1 原生质体再生细胞的分裂 原生质体在KM8P基本培养基中培养2~3 d后,可观察到原生质体再生细胞的第1次、第2次和第3次分裂(图1-6,1-7,1-8)。随后可观察到再生细胞的持续分裂,并形成小细胞团(图1-9)。第9~10天时,在倒置显微镜可观察到几十个和上百个细胞的细胞团。培养2周后,原生质体持续分裂形成约10个细胞组成的细胞团。4周后,原生质体产生肉眼可见的小愈伤组织(图1-10)。
2.3.2 渗透压对原生质体分裂和生长的影响 添加渗透压减半的新鲜培养基有利于细胞的增殖。从试验中观察到,在培养过程中,渗透压对草地早熟禾的原生质体培养的影响很大。原生质体培养到第1周时,此时添加渗透压不变的新鲜培养基继续培养,1周之后在倒置显微镜下可以看到细胞的分裂速度很慢,相比较,在添加渗透压减半的继代培养中原生质体的分裂现象特别明显;培养到第2~3周时,更换渗透压再次减半的新鲜培养基,此时可以观察到较多的小细胞团,且大部分形成小愈伤组织,而渗透压没变的培养皿中的细胞只是停留在小细胞团的水平,很少形成愈伤组织。试验表明,在原生质体的培养过程中及时地补添低渗的培养基,可有力于原生质体的培养,这同Sun等[5]、蔡起贵等[6]和王喆之等[3]在玉米(Zea mays)和陆地棉(Gossypium hirsutum)原生质体培养中所得到的结果是一致的。

表1 不同的酶液组成对草地早熟禾新格莱德原生质体产量和活力的影响Table 1 The effect of different enzymes compositions on the yield and viability of protoplasts from Nuglade(P.pratensis)

表2 不同的酶解时间对草地早熟禾新格莱德原生质体产量和活力的影响Table 2 The effect of different the time of enzyme digestion on the yield and viability of protoplasts from Nuglade(P.pratensis)
随着原生质体细胞壁的形成和细胞的持续分裂,渗透压的浓度需要不断的降低,这样才有利于细胞的增长。
2.3.3 植株再生 当原生质体来源的愈伤组织长至2 mm左右时将其挑出接种到固体培养基上继代扩增,继代2次后可得胚性较强的愈伤组织(图1-11)。培养30 d后将其再转移至分化培养基上分化。30 d后供试的49块愈伤组织中,有5块分化出了芽,芽分化率为10.2%,且进一步生根形成完整的植株(图1-12)。
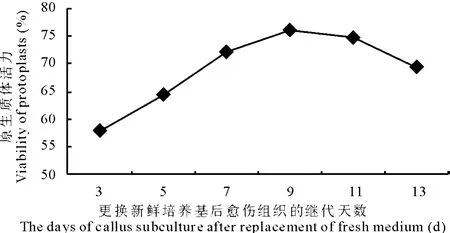
图2 草地早熟禾新格莱德愈伤组织继代时间对原生质活力的影响Fig.2 Effect of callus age on the viability of protoplast from Nuglade(P.pratensis)embryogenic calli
3 讨论
3.1 供体材料对原生质体培养的影响
有关草坪草原生质体的培养和体细胞杂交的研究及其进展,在国外已有相关的报道[1,2,7,8-10]。Dalton[8]从悬浮培养高羊茅(Festuca arundinacea)和多年生黑麦草(Lolium perenne)的原生质体中获得了再生植株;Wang等[9]建立了牛尾草(Festuca pratensis)的原生质体悬浮培养体系,产生了可育的绿色小苗;Inokuma等[10]以根尖顶端分生组织为外植体,建立了结缕草(Zoysia japonica)的原生质体植株再生体系。
禾本科植物原生质体培养获得成功的试验,几乎都是用幼胚、成熟胚诱导形成的胚性愈伤组织或胚性悬浮细胞来游离原生质体,但是建立胚性悬浮细胞途径存在两点不足:一是随培养时间的延长,细胞全能性迅速下降乃至丧失;二是悬浮培养过程极易使培养物发生大量变异致使难以保证再生出正常可育植株,这样给试验带来很多不便。Kirsten等[2]成功获得草地早熟禾品种“Geronimo”绿苗的关键是建立了愈伤组织胚性细胞悬浮系。本研究从草地早熟禾成熟种子中诱导出愈伤组织,以继代10~12次后的胚性愈伤组织为材料获得了活力较强的原生质体且进一步进行了培养,成功再生出新植株。
该研究认为,采用活力旺盛的胚性愈伤组织是草地早熟禾新格莱德原生质体再生植株的重要环节。经过多次继代培养所得的松软淡黄色或鲜黄色的愈伤组织细胞系适宜于原生质体的游离和培养。但是此过程需要较长时间。因此探讨采用何种措施来缩短继代培养的时间而获得适合于原生质体的游离细胞系是十分必要的。
3.2 酶液组成、浓度和酶解时间对原生质体分离的影响
酶解液的组成、浓度和酶解时间在原生质体培养中也是一个重要的技术环节。若酶液浓度过高,会导致原生质体的死亡;若浓度过低,却不利于原生质体的释放。王喆之等[3]、姜淑慧等[11]和王瑛华等[12]在试验中通过筛选得到了酶解陆地棉、播娘蒿(Descurainia sophia)和霸王(Zygophyllum xanthoxylum)的最佳酶解组合。酶解时间太短,游离的原生质体量少且不能满足试验的需求,时间过长又会对原生质体产生伤害[13]。刘强等[14]试验发现采用2%纤维素酶+0.5%半纤维素酶+0.5%果胶酶的混合酶酶解12 h可获得高质量的黄芪(Astragalus membranaceus)的原生质体。因此,适当的酶液组合在最佳的时间可更有利于原生质体的释放,在本研究中得出原生质体在1%纤维素酶+1%离析酶+0.3%崩溃酶+0.5%果胶酶酶液组成在14~16 h可获得产量较高且活力较强的原生质体。
3.3 渗透压对原生质体培养的影响
在植物原生质体的培养中,培养基的渗透压一般需要逐步降低。在猕猴桃原生质体培养成功的几例报道中[15,16],培养基的浓度是逐步降低的。但Binding等[17]在其试验中是一步降低的。本研究采取渗透压逐步降低的方法获得了较好的效果。此外,渗透调节物质的组合使用可以提高愈伤组织的形成率,本试验中采用甘露醇、葡萄糖和蔗糖组合来调节渗透压,使细胞维持在高渗状态下,导致质壁分离,利于酶解,并且得到了较多的愈伤组织,这与何道一和孙山[18]在苹果(Malus domestica)单倍体原生质体培养结果相似。
[1]Vander Valk P,Zeal M A C M,Creemers-Molenaar J.Regeneration of albino plantlets from suspension culture derived protoplasts of Kentucky bluegrass(Poa protensis L.)[J].Euphytica,1988,5:169-176.
[2]Kirsten A N,Else L,Elisabeth K.Regeneration of protoplast-derived green plants of Kentucky bluegrass(Poa protensis L.)[J].Plant Cell Reports,1993,12:537-540.
[3]王喆之,张苏锋,胡正海.陆地棉培养愈伤组织原生质体的制备、培养及再生植株[J].植物学报,1998,40(3):234-240.
[4]朱志清.植物细胞工程[M].北京:化学工业出版社,2003:153.
[5]Sun C S,Prioli L M,Sondahl M R.Regeneration of haploid and dihaploid plants from protoplasts of supersweet(sh2sh2)corn[J].Plant Cell Reports,1989,8:313-316.
[6]蔡起贵,郭伯琛,钱迎倩.棉花原生质体的制备、培养及再生植株[J].植物学报,1987,29:453-458.
[7]Terakawa T,Sato T,Koike M.Plant regeneration from protoplasts isolated from embryogenic suspension cultures of creeping bentgrass(Agrostis palustris)[J].Plant Cell Reports,1992,11(9):457-461.
[8]Dalton S J.Plant regeneration from cell suspension protoplasts of Festuca arundinacea and Lolium perenne[J].Journal of Plant Physiology,1988,132:170-175.
[9]Wang Z Y,Valles M P,Montavon P.Fertile plant regeneration fromprotoplasts of meadow fescue(Festuca pratensis)[J].Plant Cell Reports,1993,12(2):95-100.
[10]Inokuma C,Cho C,Okawara R,et al.Plant regeneration from protoplasts of Japanese lawngrass[J].Plant Cell Reports,1996,15(12):737-741.
[11]姜淑慧,管荣展,董海滨,等.播娘蒿愈伤组织原生质体培养体系的建立[J].草业学报,2006,15(4):94-98.
[12]王瑛华,陈刚,贾敬芬,等.霸王的原生质体培养及植株再生研究[J].草业学报,2009,18(3):110-116.
[13]于晓玲,李春强,彭明.植物原生质体技术及其应用[J].中国农学通报,2009,25(8):22-26.
[14]刘强,张宗申,丛丽娜,等.黄芪原生质体分离技术[J].广西植物,2008,28(3):411-413.
[15]肖尊安,沈德绪,林柏年.中华猕猴桃原生质体再生植株[J].植物学报,1992,34:736-742.
[16]Oliveira M M,Pais M S S.Plant regeneration from protoplasts of long-term callus cultures of Actinidia deliciosa var d eliciosa cv.Hayward(kiw ifruit)[J].Plant Cell Reports,1991,9:643-646.
[17]Binding H,Gorschen E,Jorgensen J.Protoplast culture in agarose media with particular emphasis to streaky lenses[J].Botanica Acta,1988,101:233-239.
[18]何道一,孙山.苹果单倍体原生质体培养再生植株[J].核农学报,2004,18(6):411-415.
