环境酸度对紫花苜蓿早期生长和生理的影响
2010-03-28李剑峰师尚礼张淑卿
李剑峰,师尚礼* ,张淑卿
(1.甘肃农业大学草业学院,甘肃 兰州730070;2.草业生态系统教育部重点实验室中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
土壤的酸化是一个持续不断的自然过程,土壤中动植物呼吸作用产生的CO2溶于水形成H2CO3,土壤中动植物残体经微生物分解产生有机酸等都使土壤有酸化的趋势,而酸雨也是促进土壤酸化的人为因素之一。所谓的酸性土壤是指过滤和吸收了有能力释放H+的酸性物质,即pH值低于7的土壤。但对于农业生产来说,耕作层土壤pH值低于6.6即为酸性土壤。紫花苜蓿(Medicago sativa)是一种优良的豆科牧草,具有产量高、持久性好、饲用价值高、用途广等众多优点,在世界各地的畜牧业中发挥着非常重要的作用[1],20世纪90年代中期以来,应农业结构调整、畜牧业发展的需要及国家退耕还草政策的要求,苜蓿产业逐步发展成为我国农业领域新兴产业,在范围上已经分布到除南方几个省市以外的所有地区,这主要是通常认为紫花苜蓿不适宜在酸性土壤种植所致[2]。我国广阔的红壤区域普遍偏酸性(pH<5.0),甚至呈强酸性(pH<4.5),因此限制了紫花苜蓿在我国许多省份的种植[3]。但近年的研究表明,部分半秋眠和非秋眠紫花苜蓿品种在酸性土壤中亦可正常生长[4]。宫家珺等[5]用沙培的方法研究了酸性土壤含铝量与紫花苜蓿生长的关系,发现在pH为4.5的酸性环境下,100 mg/kg以上的土壤含铝量能使苜蓿的生长受到严重抑制,而低于50 mg/kg的土壤含铝量下植株生长较好,这说明酸性土壤对紫花苜蓿生长的抑制除酸性本身以外还有其他的因素存在。Mesfint和Deborahl[6]认为铁和铝的溶解度在酸性环境下极大,苜蓿在大量吸收了这2种元素后限制了根的生长,降低了根吸收水分和所需营养物质的能力,从而使植株无法进行正常的代谢,而在中性或碱性土壤中铁和铝的溶解度低,不足以毒害植物。Josh[7]的研究也认为,限制植物生长的因素不是氢离子的活动,而是铝和锰元素的毒害作用限制了植物的生长,同时造成营养元素的缺乏。而Stoutd[8]认为,在土壤pH值高于5.5的酸性土壤中,苜蓿的产量低是由于共生细菌的固氮能力降低导致土壤中氮素的缺乏引起的。但关于高浓度的H+对苜蓿生长的抑制和毒害,目前很少有人进行相关的具体研究,并且与酸胁迫相关的研究也以在代表性酸性土壤下栽培[6-8],模拟实际生产中遇到的酸、铁、铝等多重胁迫为主,很少具体的探究环境酸度对植株的单独影响。本试验旨在研究不同酸度环境对紫花苜蓿生长和生理的影响,为紫花苜蓿在酸性土壤中的推广种植和紫花苜蓿耐酸胁迫的进一步研究提供依据。
1 材料与方法
1.1 试验材料和方法
1.1.1 供试材料 供试苜蓿品种为中种草业公司提供的WL525,种子用0.1%HgCl消毒10 min,并用去离子水冲洗干净后播种。
1.1.2 Hogland营养液的制备 大量元素:Ca(NO3)21 417 mg/L;KNO3607 mg/L;MgSO4493 mg/L;(NH4)3PO4115 mg/L;铁素:FeSO4·4H2O 28 mg/L;微量元素:H3BO32.86 mg/L;MnCl2·4H2O 1.81 mg/L;ZnSO4·7H2O 0.22 mg/L;CuSO4·5H2O 0.08 mg/L;H2MoO4·H2O 0.02 mg/L。营养液以去离子水稀释至1/4浓度后用NaOH(1 mol/L)或HCl(1 mol/L)调节pH值至所需酸度。
1.1.3 试验设计 试验于2007年进行,采用细沙作为栽培基质,经HCl浸泡后用去离子水清洗烘干备用。在直径9 cm,深7 cm,容积为600 mL的塑料花盆内铺设与底面形状一致的无纺布,盆内装入300 g干燥细沙并将沙面平整,用镊子挑选20粒大小一致的饱满种子均匀摆放细沙表面,覆盖干沙50 g。分别设pH为2,3,4,5,6和7,6个环境酸度处理;所有处理设6个重复。
将各处理塑料盆置入盛有相应pH值的1/4 Hogland营养液的水槽中,使营养液能缓慢由底部渗入,并在盆内形成高于沙表面3~5 mm的液面,然后用Haha8210型便携式pH计伸入液面以下测定pH值,直至液面pH值达到处理酸度±0.1时将盆取出。每4 d用相应pH值的Hogland营养液重复处理1次。45 d后测定生理数据及生物量、根长、根瘤数量。并以5分制计分法[9]对根瘤评分,1分为最差,5分为最好。
5分值计分法评价根瘤。1分:根瘤为中空无内容物的死亡根瘤;2分:根瘤为切面灰白色的无效根瘤;3分:根瘤切面略呈粉红色,但直径小于<0.5 mm;4分:根瘤切面呈粉红色,1 mm>直径≥0.5 mm;5分:根瘤切面呈粉红色,直径≥1 mm。
1.2 测定指标和方法
1.2.1 出苗率、生物量、根瘤数的比较 播种后每天记录各处理的出苗数,计算出苗率;每处理盆栽随机标记3株幼苗用于测量株高、叶片数、以描形称重法于出苗45 d时测定每标记植株自株顶向下第6叶的单叶叶面积[10];出苗45 d时,将栽培基质和苜蓿苗从盆中整体取出用水冲洗,直至全株完全冲洗干净,然后取出标记植株,测定其根系长度、根瘤数目、根瘤等级、单株地上生物量和地下生物量。
1.2.2 细胞膜透性的测定 参照刘慧霞和王彦荣[11]及孙铁军和苏日古嘎[12]的方法以叶片相对电导率反映细胞膜透性的大小,称取苜蓿叶片0.2 g,置入盛有去离子水的试管中,真空泵中抽气30 min使叶片浸没于水。静置20 min后,用DDS-320型电导仪测定溶液电导率。再放入沸水浴中加热30 min,冷却至室温后测定其煮沸电导率。重复3次取其平均值。用公式计算其相对电导率:相对电导率(%)=处理后叶片电导率×100/煮沸电导率。
1.2.3 植株根系活力的测定 将0.15 g新鲜根系浸没于含0.2%TTC(氯化三苯基四氮唑)的66.7 mmol/L的磷酸缓冲液,避光37℃保温1 h后加入1 mol/L的硫酸终止反应。取出根研磨后用乙酸乙酯反复提取红色的T TC还原产物三苯甲僭(TTF),485 nm波长下测定提取液的OD值。根据标准曲线计算TTC还原量[13],以单位时间内单位鲜根还原TTC的量(μg/g FW·h)表示根系还原力,以此反映植株的根系活力。
流程3:当封装后的数据包被出口隧道路由器ETR所接收后,应当对其进行解封装工作,之后按照目的地址EID2将其转发为内层数据包,并使用ACL控制列表对其进行验证。如验证结果显示EID1是源地址,则直接进入流畅,反之则遗弃数据包;
1.2.4 叶片色素含量的测定 采用吸光度法,称取0.5 g新鲜叶片,加80%的丙酮研磨提取后在波长665和645 nm处测定光密度,并计算叶绿素含量(mg/g)。
1.2.5 叶绿素荧光特性的测定 用FMS-2型便携式调制荧光分析仪(Hansatech公司)进行叶绿素荧光动力学参数测定[14]。测定前将叶片暗适应30 min后测定Fo(初始荧光)、Fm(最大荧光)、Fv(可变荧光),计算Fv/Fm(叶片PSⅡ原初光能转化效率)和Fv/Fo(PSⅡ潜在活性)。
1.3 数据分析
采用DPS 3.0专业统计分析软件进行数据分析和差异显著性检验。
2 结果与分析
2.1 环境酸度对苜蓿出苗率和存活率的影响
不同的酸度处理(简称酸度,下同)对苜蓿种子出苗率和成活率的影响有较大差异(表1),处理14 d后弱酸组(pH≥5,且pH<7)的发芽率略高于对照(pH=7,下同),而中强酸处理组(pH≤4)发芽率显著低于对照和弱酸处理组133.53%~29.11%(P<0.05,下同);出苗45 d后,pH≥4的酸度下植株成活率与对照差异不显著,pH≤3的处理的成活率均显著低于对照,其中pH=2的酸处理下所有植株在出苗19 d后全部死亡。(因此本试验45 d后的数据无pH=2的处理);种子发芽率与环境pH值呈显著的单峰曲线变化,相关系数r达0.972**,(*显著相关,**极显著相关),而存活率在pH≥4的环境下差异不大。由此可见,环境酸度对出苗率的影响显著大于植株的存活率,说明植株在出苗后在酸性环境下有所适应,具备了一定的耐受能力。环境弱酸处理组的出苗率和存活率均略高于对照,说明弱酸性环境有利于苜蓿的出苗和存活。
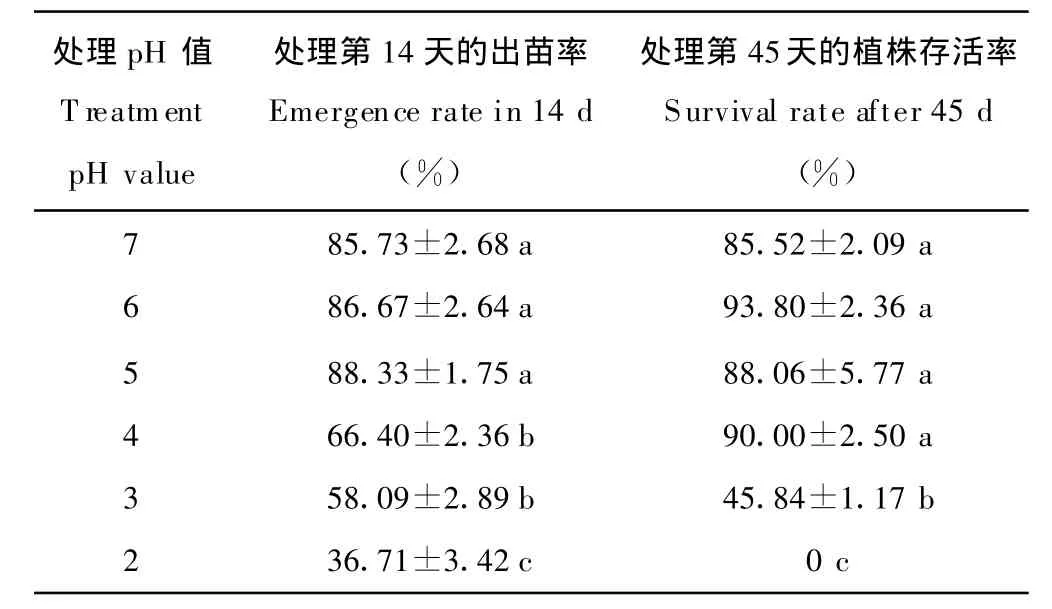
表1 环境酸度对紫花苜蓿出苗率和存活率的影响Table 1 Effect of pH value on the survival rate and emergence rate of M.sativa
2.2 环境酸度对苜蓿株高,叶片数和叶面积的影响
环境酸度对苜蓿幼苗的生长速率有很大的影响(图1),在试验期间pH=5的植株生长最快,在15 d后显著高于其他处理(P<0.05),但在29~40 d与pH低于5的其他处理一样生长变缓。pH为4和6两处理间的植株在29 d内高度差异不明显,但在29~40 d pH=6的处理高度增长量显著高于其他处理,且生长速率明显快于对照;pH≤3的处理在15 d内虽生长较为缓慢,仍分别达到对照的70.4%和74.8%,但在出苗15~40 d则基本停止生长,甚至枯死。这一结果说明植株受到酸胁迫的影响是一个持续的积累过程。
环境pH值为5和6的处理单株叶片数最多,并在出苗40 d时显著高于其他处理,分别高出对照23.6%和27.2%(图2);在出苗15 d时各处理间叶片数目差异最小,40 d时差异最大;在pH≤7的范围内,单株叶片数与环境pH值之间呈显著的正相关,相关系数达0.924*;然而在出苗8 d时发现pH≤4的处理中,植株叶片数高于其他处理,并高出对照15.15%~48.20%;李剑峰[9]对正常条件下砂培90 d的成苗进行酸胁迫10 d后亦增加叶片数目17.8%~22.0%,这说明酸性环境在短时间内有促进植株叶片分化形成的作用,但长时间的酸胁迫会抑制新生叶片的产生,本试验pH≤4的各处理在处理29 d后,叶片数目增长缓慢,显著低于对照和弱酸处理组(P<0.05)。
出苗40 d时各处理的单叶面积和同时期的叶片数变化规律基本相似(图3),处理叶面积随pH值的增大而呈明显的单峰型变化趋势。其中pH=5的处理单叶叶面积最大,达54.39 mm2,高出对照20.87%;pH=3的处理叶面积为28.52 mm2,仅为对照的63.14%,显著低于其他处理(P<0.05)。

图1 环境酸度对紫花苜蓿生长高度的影响Fig.1 Effects of pH value on shoot height of M.sativa
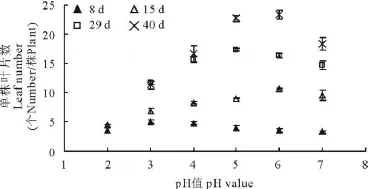
图2 环境酸度对紫花苜蓿单株叶片数的影响Fig.2 Effects of pH value on leaf number per plant of M.sativa
2.3 环境酸度对苜蓿生物量、根长和根瘤的影响
环境酸度对苜蓿生物量及根瘤,尤其对根瘤等级的影响明显(表2),出苗45 d时,pH=5处理下的单株根瘤数达15个,极显著的高于其他处理,说明该酸度能够刺激苜蓿根系根瘤的产生,根瘤等级低于对照,但差异不显著。而当处理pH值在6~7时根瘤数目差异不大;pH低于4时,植株产生的根瘤无效或已死亡;从根瘤等级评分数据可见,pH在5~7时,植株的根瘤处于正常生长状态,差异不显著。在pH=6时,根瘤生长表现最好,评分可达4.3分,说明该酸度最适宜于根瘤的生长,当环境pH值低于4时植株则不存在有效根瘤,这与李力和曹凤明[15]的研究结果一致,其测试的所有根瘤菌株在pH=4时都不生长;单株地下生物量与地上生物量的变化趋势基本相同,随着pH值的增大而呈单峰变化趋势。2项指标在pH=5处理下最高,分别高出对照35.15%和59.09%,并显著高于其他处理(P<0.05)。以pH=5为峰值,其他处理植株根系的地上、地下生物量随着环境pH值的上升或下降而降低;植株根长与环境pH间呈显著的正相关(图4),在pH值为3~7时相关系数达0.819。
根据以上形态及生物量测定的结果,参照宫家珺等[5]的方法根据紫花苜蓿对土壤酸度的耐受性分为最适、中适及低适生长区间。综合出苗率、成活率、株高、单株叶片数、单叶面积、生物量和根瘤个数在酸性环境中随pH的变化规律:环境pH值在5~6的范围内,紫花苜蓿植株的生长状态最好,甚至在某些方面表现优于对照,故将此范围划为苜蓿在酸性土壤中的适宜生长区间;pH值低于4的环境酸度下,苜蓿的出苗率、存活率、株高、单叶面积,生物量和根瘤个数均随Fe2+含量的增大而呈急剧下降的趋势,并显著的低于对照(P<0.05)。表明这一环境已不适宜苜蓿的生长,说明pH值低于4的环境酸度可划分为酸性土壤中紫花苜蓿对环境酸度的低适生长区间。而pH在6~7或4~5的区间内时,以上各个指标均与对照差异不大,故可划分为中适长区间。
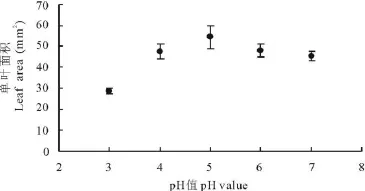
图3 环境酸度对紫花苜蓿单叶面积的影响Fig.3 Effects of pH value on leaf area of M.sativa
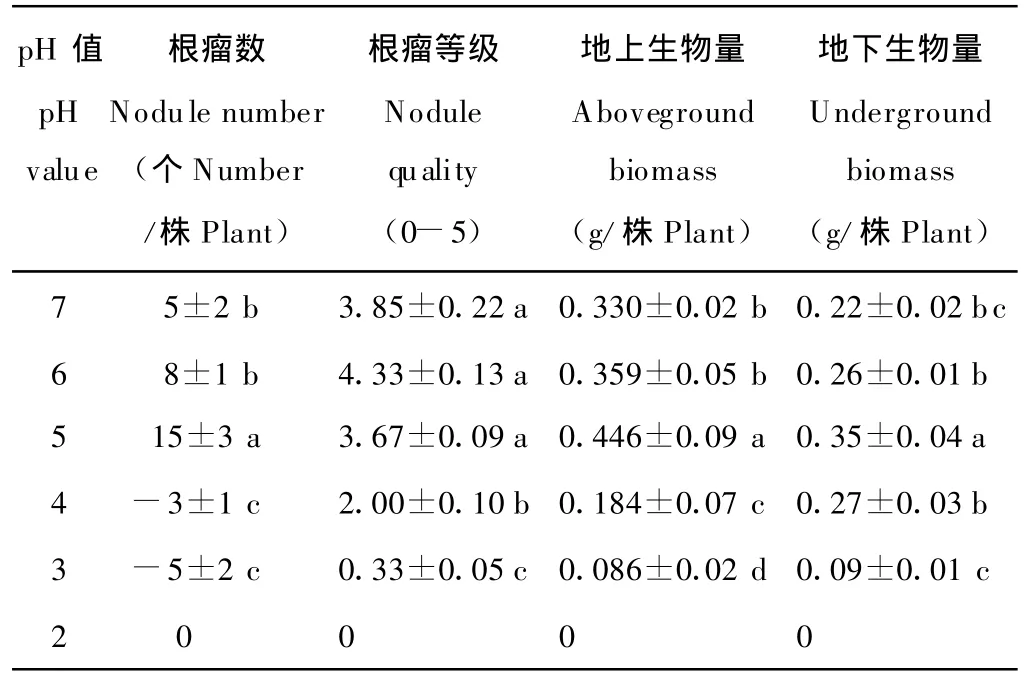
表2 环境酸度对苜蓿单株茎叶重,根重和根瘤数的影响Table 2 Influence of acid environment on biomass of above and blow ground and root nodule number
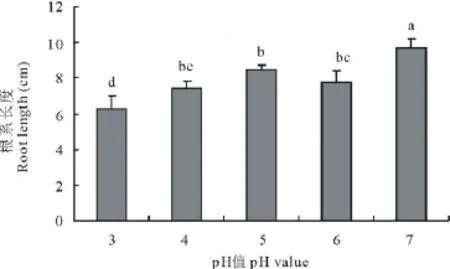
图4 环境酸度对紫花苜蓿根长度的影响Fig.4 Effect of pH value on root length of M.sativa
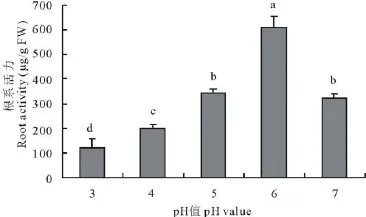
图5 环境酸度对苜蓿植株根系活力的影响Fig.5 Effects of pH value on root activity of M.sativa
2.4 环境酸度对苜蓿根系活力影响
根系活力是根系生理活性和养分吸收运转能力的反映[16]。本试验处理45 d后,pH=6的处理下植株的根系活力最大(图5),达到525.860 μg/g FW,之后随着环境pH值的降低,根系活力也依次降低,在pH值为3的处理下,根系活力已锐降至124.207 μg/g FW,而对照下的根系活力则高出pH=4的处理73.2%。经回归分析表明,pH≤6的范围内,根系活力与环境pH值之间呈显著的正相关,相关系数达0.935。
2.5 环境酸度对苜蓿叶片细胞膜透性的影响
细胞是选择透过性膜,它能够调节细胞内外物质的运输和交换[17],酸胁迫下可导致细胞膜结构的破坏,使细胞膜透性增大,相对电导率增高。45 d时当处理酸度在pH为2~6时,叶片相对电导率与环境pH值间呈负相关关系(图6),相关系数达0.918**;其中pH=6的酸度下叶片的相对电导率仅为0.085(1=100%),而pH=5的处理下细胞膜透性维持在与对照相似的水平;植株叶片相对电导率在pH=4时出现明显的跃升,证明pH=4的酸度已达到植株对环境酸度的耐受极限,pH为3和4的处理相对电导率分别高出对照291.3%和107.9%,此时植株已表现出严重受害。
2.6 环境酸度对苜蓿叶片叶绿素含量和光化学效率的影响
叶绿素作为重要的光合色素,在光合作用过程中担负着光能吸收和转化的重要作用。出苗45 d时,叶绿素含量各酸度处理间差异较大,随着环境pH值的增加呈明显的单峰型变化(图7),相关系数达0.946。pH=5处理下的叶绿素含量最高,高于对照31.2%,pH=6处理下叶绿素含量亦高于对照27.9%;pH≤4的环境酸度下叶绿素含量则明显低于对照。
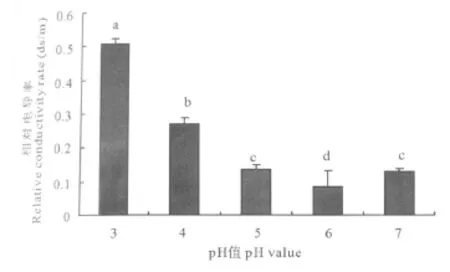
图6 环境酸度对苜蓿叶片电导率的影响Fig.6 Effect of pH value on relative conductivity of M.sativa
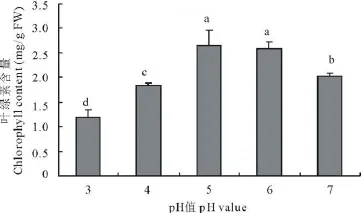
图7 环境酸度对苜蓿叶绿素含量的影响Fig.7 Effect of pH value on chlorophyll content of M.sativa
Fm/Fv和Fv/Fo常用于度量植物叶片PsⅡ原初光能转化效率和PsⅡ潜在活性,是表明光化学反应状况的2个重要参数[18]。15 d时苜蓿幼苗的荧光参数Fv/Fm和Fv/Fo随环境pH值的增大呈极显著的二项式相关(图8,9),相关系数R2高达0.968**和0.913**;45 d时Fm/Fv的变化较15 d时趋于平缓,而Fv/Fo的变化在pH≥5处理间比较明显。其中pH=6处理的Fv/Fo明显高于所有处理,并略高于14 d时的水平,且Fv/Fm亦高于其他处理,说明幼苗在经历一段时期对弱酸环境的适应后,在pH=6的酸度下光能转化效率和PsⅡ潜在活性都达到最大值。而pH=4和5的处理45 d时的Fm/Fv值均低于15 d时的表现;在pH≤4的环境酸度下,Fm/Fv和Fv/Fo随酸度的增大而下降的趋势最为明显,且彼此间差异显著(P<0.05)。
3 讨论
3.1 环境酸度与苜蓿生长及生理间的关系
不同的环境酸度对于苜蓿植株的影响差异较大。在pH≥5的弱酸环境下,植株的叶面积、株高、生物量等生长指标及叶绿素含量等生理指标均高于甚至部分显著高于中性环境(pH=7),这说明弱酸环境能够刺激苜蓿幼苗的生长。同时根据根系活力及膜透性指标也可以发现,弱酸环境对于植株的根系和质膜的透性还是有微弱的负面影响。综合这两部分结论,参照宫家珺等[5]对铝离子和Fe2+在酸性环境下对该苜蓿品种的胁迫研究,初步认为弱酸环境下,苜蓿在酸性土壤下面临的主要胁迫因素是土壤中的铝、铁离子,酸性本身对植株的胁迫作用较微弱,仅为H+对根系长度,根系活力和膜透性的影响。但在实际栽培土壤中,较多的H+为亚铁离子和铝离子的活化提供了条件,放大了铁、铝离子对植株的伤害,这就解释了Mahler[19]研究发现的相同土壤成份下,弱酸环境下苜蓿生长状况明显低于中性条件的现象。
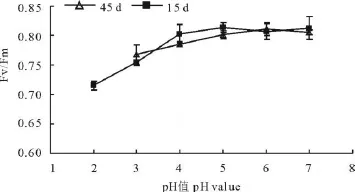
图8 环境酸度对苜蓿叶片PSⅡ原初光能转化效率(Fv/Fm)的影响Fig.8 Effect of pH value on PSⅡprimary chemical efficiency(Fv/Fm)of M.sativa leaf

图9 环境酸度对苜蓿叶片PSⅡ潜在活性(Fv/Fo)的影响Fig.9 Effect of pH value on PSⅡpotential activity(Fv/Fo)of M.sativa leaf
随着环境pH值的进一步降低,在pH=4的酸度下,苜蓿幼苗在表观上仍能维持生长,而实际上膜结构已受到严重的损伤,根系活力也分别降至pH=5的处理及对照下的57.8%和61.1%,叶片的光合效能随之减弱,植株高度和叶片数的增长分别与15 d和29 d后趋于停滞。
所有pH≤4的处理下根瘤全部死亡或无效,出苗率、叶面积、地上生物量等生长指标也随着酸度的增加而呈明显的下降趋势,pH≤3的各处理植株均可观察到叶片出现皱缩和白色坏死斑点[8],异状叶大量产生。但本研究也发现,尽管pH=4的酸性环境下苜蓿多项生理及生长指标均显著低于对照,但其单株地下生物量并不低于对照,且25 d时将各酸度下的6个处理中的3个去除酸胁迫后继续生长,发现pH=4的处理下植株生长有所恢复[9],并在45 d时株高及叶片数、生物量等指标与对照(pH=7)处理差异不显著。而pH低于4的环境则无法使苜蓿幼苗长期生存,去除酸胁迫后亦无法恢复生长。这说明pH=4的酸度下,植株仍能维持最低限度的生长,故在pH≥4的土壤中,若Fe2+和铝离子含量不足以造成植株的胁迫就完全可以进行苜蓿的引种和栽培。但pH值低于4的土壤环境,不论其他离子是否造成伤害,仅酸胁迫而言对苜蓿幼苗也是致命的。
3.2 紫花苜蓿在不同酸度环境下的光合生理
最大光化学量子产量Fv/Fm和光系统潜在活性Fv/Fo是度量叶片光系统Ⅱ(PSⅡ)原初光能转换效率和潜力的重要参数。正常条件下,Fv/Fm值不受物种和生长条件的影响,变幅非常小,但在逆境条件下这一比值明显降低[20]。出苗15 d时,在pH为4~7的处理下Fv/Fm值差异并不显著,而在45 d时,pH=4的处理下该值明显低于对照,同时pH=5的处理下Fv/Fm值也有所下降。2个时期的数据反映出在pH为4~5时,环境酸度对幼苗光能转化效率的促进作用仅表现为短时间的刺激作用,随着处理时间的延长逐渐有所下降;光系统潜在活性Fv/Fo在pH≤4的处理下,15和45 d时的数值差异不大。而在弱酸处理组下,15 d时处理间的差异不显著,45 d时表现为pH值高于或低于6的处理Fv/Fo值均下降。说明光系统潜在活性在pH=6时达到最大,并随着环境酸度的增大而降低;出苗45 d时,pH<4的处理间Fv/Fm和Fv/Fo都显著低于弱酸处理组,这与叶绿素含量及叶片电导率的变化基本吻合。这一结果与Holden等[21]的研究发现一致,即强酸环境下高浓度的H+使PEP羧化酶和RuBP羧化酶的活性降低,叶绿体趋于解体破坏,造成植物叶片的失绿,直接引起光合效率的下降。
4 结论
在不同程度的酸性环境中,pH=4的环境酸度为苜蓿幼苗的耐受极限,表现在此酸度下苜蓿幼苗的形态指标和生理指标值与对照均有显著差异,如该处理下的出苗率为66.4%,仅为对照的77.4%,幼苗叶片上开始产生明显的白色枯斑,无存活根瘤,地上生物量和根系活力分别仅有对照处理的55.6%和61.1%,但此时植株的成活率和叶片的叶绿素含量与对照无显著差异。表明这一酸度水平上虽已产生明显的胁迫症状,但植株仍可以耐受,并在去除胁迫后能够恢复正常生长,但一旦pH值低于4,植株则无法耐受,很快停止生长甚至死亡;不计铝、铁等离子的作用,仅就酸度而言,5~6之间的土壤pH值,是苜蓿在酸性土壤中的最适生长区间,植株的生长表现均优于或不低于对照,各项生理指标也表明未受到胁迫伤害,反而表现出一定的促进作用。
[1]孙洪仁,张英俊,历卫宏.北京地区紫花苜蓿建植当年的耗水系数和水分利用效率[J].草业学报,2007,16(1):41-66.
[2]王新海,毕玉芬,奎家祥.耐酸性紫花苜蓿的研究进展[J].云南农业大学学报,2005,20(5):705-709.
[3]戚志强,玉永雄,胡跃高.当前我国苜蓿产业发展的形势与任务[J].草业学报,2008,17(1):107-113.
[4]郭彦军,黄建国.紫花苜蓿在酸性土壤中的生长表现[J].草业学报,2006,15(1):84-89.
[5]宫家珺,李剑峰,安渊.酸性土壤中铝离子对紫花苜蓿生长和生理的影响[J].中国草地学报,2008,30(3):52-58.
[6]Mesfint S,Deborahl A.Over pression of malate dehydrogenase in transgenic alfalfa enhances organic acid synthesis and confers tolerance to Aluminum[J].Plant Physiology,2001,127:1836-1844.
[7]Josh B.Possible solutions to remedy the detrimental effects of soil acidity on tropical agriculture[J].Geology of Soils,1996,11:36-38.
[8]Stoutd G.Growth of Alfalfa on Acid Soils When Established with Pre-inoculated Coated Seed[M].Canada Agriculture and Agri-Food,1994:87-110.
[9]李剑峰.紫花苜蓿在酸铁胁迫下的适应性研究[D].兰州:甘肃农业大学,2007:34-36.
[10]谭一波.叶面积指数的主要测定方法[J].林业调查规划,2008,33(3):47-49.
[11]刘慧霞,王彦荣.水引发对紫花苜蓿种子萌发及其生理活动的影响[J].草业学报,2008,17(4):78-84.
[12]孙铁军,苏日古嘎.10种禾草苗期抗旱性的比较研究[J].草业学报,2008,17(4):42-49.
[13]王芳,刘鹏,朱靖文.镁对大豆根系活力叶绿素含量和膜透性的影响[J].农业环境科学学报,2004,23(2):235-259.
[14]郭士伟,张云华,金永庆.小白菜(Brassica chinensis L.)黄苗突变体的叶绿素荧光特性[J].作物学报,2003,29(6):958-960.
[15]李力,曹凤明.花生根瘤菌的抗逆性初步研究[J].微生物学通报,2000,1:42-47.
[16]刘建新,胡浩斌,赵国林.多裂骆驼蓬中生物碱类物质对玉米幼苗生长及某些生理特性的影响[J].草业学报,2007,16(1):75-80.
[17]王友保,张莉.铜对狗牙根生长及活性氧清除系统的影响[J].草业学报,2007,16(1):52-57.
[18]Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].Chinese Bulletin of Botany,1999:16(4):444-448.
[19]M ahler R L.Impacts and Management of Soil Acidity under Direct Seed Systems-Status and Effects on Crop Production[R].Direct Seed Conference,CA,January,2002:16-18.
[20]Schreiber U,Bilger W,Klughammer C.Applications of Chlorophyll Fluorescence in Photosynthesis Research[M].Hydrobiology and Remote Sensing,Dordrecht:Kluwer Academic Publishers,1988:151-155.
[21]Holden M J,Luster D G,Chaney R L,et al.Fe3+-chelate reductase activity of plasma membranes isolated from tomato(Lycopersi conesculentum Mill.)root[J].Plant Physiology,1991,97:537-544.
