“酸碱盐溶解性表”的解读和应用
2009-11-17付海龙
付海龙
〔关键词〕 化学教学;酸碱盐溶解性表;应用
〔中图分类号〕 G633.8〔文献标识码〕 C
〔文章编号〕 1004—0463(2009)11(A)—0058—01
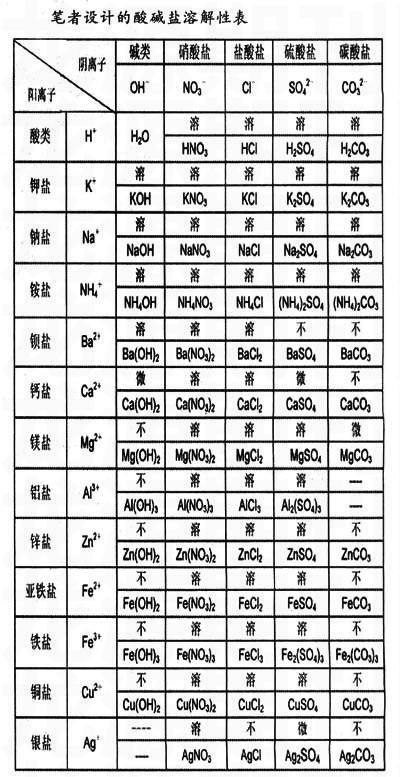
在毕业会考中,对“酸碱盐”一章的化学式、化学方程式的考查所占分值比较大,再加上复分解反应,学生需要掌握的知识点很多,给他们的学习带来很大的压力。本人结合自己的教学实践,发现利用“酸碱盐溶解性表”可以很好地解决学习“酸碱盐”这一章的四个难点问题。
1. 利用“酸碱盐溶解性表”可以加深学生对酸、碱、盐的理解。H+ 与酸根阴离子依次形成的除H2O外,还形成HNO3,H2SO4等,同理,OH-与每一行形成的除H2O外,还形成NH4OH,KOH,NaOH等。所以酸就是电离时生成的阳离子全是H+的化合物,碱就是电离时生成的阴离子全是OH-的化合物,盐则是电离时能生成金属阳离子和酸根阴离子的化合物。
2. 运用“酸碱盐溶解性表”可以给盐进行分类。如右表,按酸根阴离子将盐分类:第三列与每一横行(除第二行外)交叉处形成的盐全是硝酸盐,以此类推第四列形成盐酸盐,第五列形成硫酸盐;若按阳离子分类:则第三行与第三列起每一列交叉处形成钾盐,以此类推第四行形成钠盐,第五行形成铵盐。
3. 结合“酸碱盐溶解性表”巧记溶解性。碱中能溶NH4+,K+,Na+,Ba2+;硝酸盐全溶,盐酸盐不溶Ag+;硫酸盐不溶Ba2+,Ca2+,Ag+;碳酸盐只溶NH4+,K+,Na+。在复分解反应中,针对不同的反应,对反应物、生成物都有一定的要求。如,盐和盐的反应,要求反应物都是可溶性盐,而生成物中,至少有一种盐不溶。那么怎样知道哪些盐可溶,哪些盐不溶呢?可利用“酸碱盐溶解性表”很快正确判断出到底能不能发生反应。如,判断AgNO3和NaCl溶液间能否发生反应,可采用复分解反应书写规则“双交换,不变价”的方法,假想可以生成,那么就有生成物AgCI↓和NaNO3溶液,发现符合复分解反应的条件,所以该反应可以发生。
4. 化学式中正负化合价的代数和为零,可以很快正确书写各物质的化学式。笔者采用“两表合一”的教学方式,即将“酸碱盐溶解性表”和“常见酸碱盐化学式表”两表合一,使同学们就像查字典一样查写化学式,达到事半功倍的效果。如,写硝酸铵的化学式:先查NH4+,再查NO3-,结合起来就是NH4NO3,同理写硫酸铝的化学式:先查Al3+,再查SO42-,结合起来就是Al2(SO4)3。
笔者设计的酸碱盐溶解性表
