大鼠骨骼肌挫伤后骨骼肌肌钙蛋白I mRNA的表达变化
2009-06-03
[摘要] 目的 应用实时荧光定量PCR技术检测大鼠骨骼肌挫伤后肌钙蛋白I mRNA(sTnI mRNA)表达情况,分析其与挫伤的关系。方法 建立大鼠骨骼肌挫伤模型,分别在挫伤后0.5h,1h,6h,12h,18h取材。提取挫伤肌肉中的总RNA,逆转录合成cDNA第一条链,以cDNA作为模板,通过特异性上下游引物荧光定量PCR检测cDNA的拷贝数,选取管家基因核糖体蛋白L32为参比基因,对扩增结果进行相对定量分析。结果 大鼠骨骼肌挫伤后0.5h、1h、6h、12h、18h 的sTnI mRNA表达量分别为正常组的66.7%、46.6%、31.9%、18.5%和15.3%,呈时序性表达下调趋势。结论 大鼠骨骼肌挫伤后0.5h内sTnI mRNA的表达即开始下调,18h内sTnI mRNA的表达有一定的时间规律性,可望作为临床诊断骨骼肌损伤的指标之一。
[关键词] 骨骼肌损伤; 骨骼肌肌钙蛋白I; 实时荧光定量PCR
[中图分类号] R642 [文献标识码] A [文章编号] 1673-9701(2009)13-40-03
Expression of sTnI mRNA in Rat Skeletal Muscle after Contusion
ZHANG Lei SUN Junhong LU Jian WANG Yafang WANG Yingyuan
Department of Forensic Pathology,Shanxi Medical University School of Forensic Medicine,Taiyuan 030001
[Abstract] ObjectiveTo investigate the expression of skeletal troponin I mRNA(sTnI mRNA)changes induced by contusion in rat skeletal muscle using Real Time PCR,aimed to provide some help for forensic estimation of wound age. MethodsThe 36 rats were divided into two groups randomly:contusion group(5 subgroups) and control group,the contusion was performed on the right posterior limb of rat. The samples were extractd respectively at 0.5h,1h,6h,12h,18h after contusion. Total RNA were isolated from skeletal muscle of two groups,and reverse transcription polymerase chain reaction was conducted to synthesize the 1-st strand cDNA. With the use of sequence-specific primers,the expression level of sTnI mRNA was studied by Real Time PCR. ResultsOur results normalized by Ribosomal Protein L32(rpL32) showed that mRNA levels of sTnI were 66.7%,46.6%,31.9%,18.5% and 15.3% in contusion groups compared to control group respectively at 0.5h,1h, 6h,12h,18h,which present down-regulated after contusion within 18hs time-orderly. ConclusionThe time-order expression of sTnI mRNA after contusion was potentially indicative for diagnosis of early muscle injury.
[Key Words]Muscle injury; sTnI mRNA; Real time fluorescence quantitative polymerase chain reaction
骨骼肌损伤以及骨骼肌疾病在临床上颇为常见,进行快速准确的诊断十分重要。传统酶学指标如CK、CK-MB等并非骨骼肌所特有,且缺乏敏感性和特异性,加之剧烈运动后也可导致血中CK、CK-MB的轻微升高,给骨骼肌损伤,特别是轻微损伤、多发性损伤的早期诊断带来了不小的困难。sTnI与cTnI相似的特性,给骨骼肌损伤以及疾病的诊断提供了新的思路。
本实验拟通过建立大鼠骨骼肌挫伤模型,采用实时荧光定量PCR(Real Time PCR)检测大鼠骨骼肌挫伤后不同时间点骨骼肌肌钙蛋白I mRNA(Skeletal troponin-I mRNA,sTnI mRNA)的表达量,探寻其时序性变化规律,旨在为骨骼肌损伤以及疾病的诊断提供客观依据。
1 材料与方法
1.1 试剂与主要仪器
总RNA提取试剂盒(SV Total RNA Isolation System)购自美国Promega公司;反转录试剂盒(PrimeScript RT-PCR Kit)及实时荧光定量试剂盒(SYBR Premix Ex Taq)购自大连宝生物工程有限公司;美国Stratagene公司Mx3005P实时荧光定量PCR仪;美国SIGMA公司低温高速离心机2-16PK型。
1.2 实验动物及分组
健康成年清洁级Sprague-Dawley大鼠36只,由山西医科大学实验动物中心提供。雌雄不限,体重(300±15)g,随机分成6组,每组6只,包括5个损伤组(0.5h,1h,6h,12h,18h)和1个正常对照组。
1.3 动物模型制作及取材
1.3.1 动物模型制作 经口鼻乙醚麻醉大鼠,选取大鼠右后肢股四头肌作为挫伤着力点,用本室自制的褪毛剂褪净着力点附近约2.5cm×2.5cm区域的鼠毛,仰卧位固定于鼠板上,充分暴露打击区域。利用改进的Marmarou自由落体装置,250g重力锤自150cm高度垂直自由落下,造成大鼠右后肢股四头肌处肌肉挫伤(解剖证实损伤率达100%)。
1.3.2 取材 大鼠存活至预定时间后迅速脱颈处死。打击区域常规手术消毒后,无菌手术剪剪开皮肤及浅层肌肉,暴露股四头肌损伤处,取材并严格称重40mg,将检材包裹好后迅速置于液氮中保存备用。

1.4 总RNA的提取及检测
1.4.1 总RNA的提取 严格按照SV Total RNA Isolation System试剂盒说明进行操作。提取完毕后,取4μL进行紫外分光光度测定,5μL上样电泳检测完整性。
1.4.2 总RNA纯度及完整性的检测 紫外分光光度仪测定OD260/ OD280值在1.9~2.0之间,总RNA浓度约为230ng/μL;1.5%甲醛变性琼脂糖凝胶电泳检测总RNA的完整性,可见清晰较亮的28s、18s两条带,28s宽度约为18s的两倍,说明总RNA的完整性较好,符合后续实验的要求,如图1。
1.5 反转录体系及反应条件
模板总RNA进行65℃水浴5min变性后迅速冰上放置,同时按反转录试剂盒操作说明冰上配制反应混合液如下:5×PrimeScript Buffer 2μL,RT Enzyme Mix 0.5μL,Oligo dT Primer(50μM)0.5μL,Random 6mers(100μM)0.5μL,总RNA模板500ng,用Nuclease-Free水补足10μL反应体系。反应条件:37℃反应15mins,85℃灭活5s,-20℃保存备用。
1.6 实时荧光定量PCR
采用SYBR Green I 荧光嵌合法进行Real Time PCR。按照实时荧光定量试剂盒(SYBR Premix Ex Taq)操作说明冰上配制反应混合液如下:SYBR Premix Ex Taq 12.5μL,Forward Primer(10μM)0.5μL,Reverse Primer(10μM)0.5μL,cDNA模板2.0μL, Nuclease-Free水9.5μL。选取内源性管家基因(House Keeping Gene)核糖体蛋白L32(Ribosomal Protein L32,rpL32)作为参比基因,反应体系同上。每组样本均设空白对照及复管。目的基因与参比基因均按以下反应程序:第一阶段:95℃,预变性,10min,1个循环;第二阶段:95℃,变性,30s;60℃,退火、延伸20s,40个循环;第三阶段为融解曲线绘制阶段:95℃,1min;55℃,30s;95℃,30s。
目的基因及参比基因扩增所用上下游引物序列均引自GeneBank,由本室研究人员通过专业Primer5.0软件设计优化,经BLAST检索确认特异性,委托上海Invitrogen生物技术有限公司合成,序列见表1。

1.7 数据分析和统计学处理
反应结束后,由StratageneMxPro QPCR软件自动分析并输出荧光定量结果。采用SPSS 11.5统计学软件对所得数据进行分析处理,应用单因素方差分析进行组间均数比较、Student-Newman- Keuls(SNK)法两两比较,P值小于0.05被认为两者之间的差异有统计学意义。
2 结果
2.1sTnI mRNA扩增曲线
各组样本PCR过程基本都在第12个循环开始起峰,曲线拐点清楚,基线平而无上扬现象;指数期曲线斜率为1.05,表明扩增效率较高;各管的扩增曲线平行性好,表明扩增效率相近,如图2。

2.2 sTnI mRNA融解曲线
扩增反应结束后,系统在55℃~95℃范围内自动进行融解曲线的绘制。如图3所示:各样本融解温度集中在88℃,融解曲线均为单一峰型,基底窄而峰高,表明并无引物二聚体等非特异性扩增产生。

2.3 sTnI mRNA相对定量结果
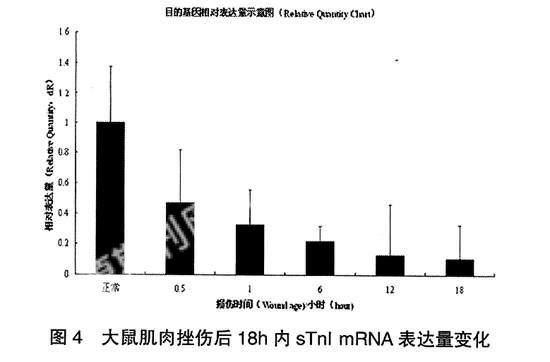
统计学分析显示组内各样本间两两比较的P值> 0.05,说明损伤后各样本sTn I mRNA表达量的变化与个体因素无关;各取材时间sTn I mRNA相对含量各组间比较的P值< 0.05,各组间两两比较的P值< 0.05,说明大鼠骨骼肌挫伤后sTnI mRNA的表达量随损伤时间的延长(18h内)逐渐下调具有统计学意义;而18h和12h两组相比较其P值> 0.05,说明sTnI mRNA随着损伤时间的延长,已经趋于一个低水平稳态的表达,见表2。

2.4 大鼠肌肉挫伤后18h内sTnI mRNA表达量变化
大鼠肌肉挫伤后18h内sTnI mRNA表达量变化趋势见图4。
3 讨论
骨骼肌肌钙蛋白(Skeletal Troponin,sTn)是由C、T、I 3个亚单位组成的复合体,TnI亚基为单一多肽链,是肌肉收缩的分子开关,通过抑制细丝中的肌动球蛋白(Actomyosin)的ATP酶活性,抑制肌球蛋白(Myosin)与肌动蛋白的结合,进而阻止肌肉的收缩[1]。生理情况下极少有sTnI 释放到血液中,只有当骨骼肌损伤、病变发生后,sTnI才会大量出现在循环系统中。研究证实sTnI的释放与骨骼肌损伤类型及程度有密切关系,严重外伤会导致骨骼肌细胞骨架网(Cytoskeletal network)和收缩装置结构(Contractile apparatus)的迅速崩解,TnI与肌原纤维分离,结合部分以固定形式存在的sTnI从肌纤维不断崩解破坏而释放,其本身及酶解片段进入血循环,造成血中sTnI浓度迅速升高[2-4]近年来,骨骼肌损伤的临床诊断研究取得了一定的进展:Kiely[5]等利用酶免疫测定法对16例多发性肌炎(Polymyositis)和皮肌炎(Dermatomyositis)患者血清中sTnI、cTnI、CK、及CK-MB的浓度进行了测定。与对照组相比,sTnI、CK及CK-MB均显著升高,而cTnI并未达到可检出限浓度(0.03μg/L)。结果表明CK与CK-MB具有相关性(Spearman r = 0.99,P < 0.0001),同时sTnI与CK-MB间有相关性(Spearman r = 0.98,P < 0.0001),说明在骨骼肌炎性病变时,sTnI、CK及CK-MB均会大量释放入血,但考虑到上述指标组织特异性时,认为sTnI较CK及CK-MB更具有诊断意义。Onuoha[6]等同样利用酶免疫测定法(Immunoenzymometric assay)对16例骨折病人(包括胫腓骨、股骨、颅骨骨折等)和20例软组织损伤病人(挫伤、扭伤、韧带撕裂伤等)血浆中sTnI、CK-MB及弹性蛋白酶(Elastase)进行定量测定(患者无心脏疾病,且尚未进行外科治疗),设对照组17例。结果表明骨折病人和软组织损伤病人血浆中sTnI含量明显升高,分别为(15.25±2.4)ng/mL及(10.41±1.8)ng/mL,明显高于对照组(2.5±0.9)ng/mL水平且具有统计学意义,MB、Elastase浓度与对照组比较并无显著性差异,同时,损伤组和对照组均未检出cTnI。表明sTnI对骨骼肌损伤有诊断意义,且敏感性和特异性均优越于CK-MB、Elastase等指标,并认为sTnI含量与损伤程度呈相关性。
本实验观察到大鼠骨骼肌挫伤后0.5h、1h、6h、12h、18h 的sTnI mRNA表达量分别为正常组的66.7%、46.6%、31.9%、18.5%和15.3%,呈时序性表达下调趋势。其机制目前尚不清楚,作者推测在损伤早期以组织出血、水肿、坏死为主要改变时,机体启动主动防御机制使sTnI mRNA的表达量下调,有利于受损的肌纤维保持收缩状态,在一定程度上固定了损伤的范围,避免了损伤的加重;也有可能在损伤早期,大量的炎性因子直接抑制了sTnI基因的表达。
急性严重创伤可直接造成患者骨骼肌变性及坏死,肌红蛋白、酸性代谢产物、血管活性物质和组织毒素等大量释放入血,而骨骼肌损伤诱发急性肾功能衰竭占创伤后急性肾功能衰竭的33.8%[7],是导致急性肾功能衰竭的重要因素。本实验利用Real Time PCR检测到大鼠骨骼肌挫伤后早在0.5h内sTnI mRNA的表达即开始下调,18h内sTnI mRNA的表达有一定的时间规律性,对于临床诊断骨骼肌损伤、推断损伤时间,以便及时治疗并预防骨骼肌损伤导致的急性肾功能衰竭有重要意义。
[参考文献]
[1] Mukhopadhyay S,Langsetmo K,Stafford WF,et al. Identification of a Region of fast skeletal troponin T required for stabilization of the coiledcoil formation with troponin I[J]. The Journal of Biological Chemistry,2005, 280(1):538-547.
[2] Vijayan K,Thompson JL,Norenberg KM,et al. Fiber-type susceptibility to eccentric contraction-induced damage of hindlimb-unloaded rat AL muscles[J]. J Appl Physiol,2001,90(3):770-776.
[3] Simpson JA,Labugger R,Hesketh GG,et al. Differential detection of skeletal troponin I isoforms in serum of a patient with rhabdomyolysis:markers of muscle injury[J]. Clin Chem,2002,48(7):1112-1124.
[4] Simpson JA,Van Eyk J,Iscoe S. Respiratory muscle injury,fatigue and serum skeletal troponin I in rat[J]. J Physiol,2004,554(3):891-903.
[5] Kiely PD,Bruckner FE,Nisbet JA,et al. Serum skeletal troponin I in inflammatory muscle disease:relation to creatine kinase,CK-MB and cardiac troponin I[J]. Ann Rheum Dis,2000,59(9):750-751.
[6] Onuoha GN,Alpar EK,Dean B,et al. Skeletal troponin-I release in orthopedic and soft tissue injuries[J]. J Orthop Sci,2001,6(1):11-15.
[7] 陈冬萍,庄海梅,邵瑛,等. 急性创伤严重骨骼肌损伤后肾功能损害的护理观察[J]. 中华护理杂志,2007,10(42):888-889.
(收稿日期:2009-01-02)
