苏云金芽孢杆菌aiiA基因载体构建及石斛兰转化*
2009-05-08潘丽晶张妙彬梁擎中范干群
潘丽晶,张妙彬,梁擎中,范干群,程 萍
(珠海市农业科学研究中心,广东 珠海 519070)
石斛属是兰科中最大的属之一,广泛分布于亚洲热带和亚热带地区至大洋洲。石斛兰因其种类繁多、花姿优美、花色艳丽、花期长,其中许多种类还带有芳香的气味,既可盆栽观赏,又可做成切花装饰,深受人们喜爱,具有良好的市场前景。目前,国际上最具商业价值的几个大属的兰花(包括石斛兰),普遍存在着病虫害严重、栽培和养护环境苛刻、成花周期长、开花控制难度大、花色花形不丰富等问题[1]。其中,病害问题乃是兰花生产者最头痛的问题,因为目前的兰花主要是在温室生产,温室内种植密集,且常年温暖湿润,通风不畅,极利于病虫繁殖和传播,管理稍有不慎便会引发兰花病害,而多数病害一旦发生即对兰株造成永久的贬值,令生产者蒙受巨大的经济损失。
在石斛兰的各种病害中,软腐病(soft rot)是主要的细菌性病害,该病菌在兰科中可以危害蝴蝶兰、文心兰、石斛兰、拖鞋兰和狐狸尾兰等,是目前台湾蝴蝶兰上最普遍最致命的病害之一。软腐病的主要病原菌是欧氏杆菌Erwimiacarotovorasubsp.carotovora,欧氏杆菌的毒性基因表达受N-乙酰高丝氨酸内酯(N-acylhomoserine lactone,AHL)信号分子的调控。因此,AHL信号分子为生物防治植物细菌病害提供了新靶点。Dong等[2]从芽孢杆菌一亚种Bacillussp.240B1中分离到一个编码AHL水解酶类基因aiiA(autoinducer inactivation)。将aiiA基因导入烟草和马铃薯,转基因的烟草叶子和马铃薯块茎对E.carotovora侵染的抗性明显比非转基因的对照组强,表现为侵染后不出现病斑或显著推迟病斑的出现[3]。Lee等[4]发现aiiA基因广泛存在于多个苏云金芽胞杆菌(Bacillusthuringiensis,Bt)亚种中,将这些aiiA基因与Dong等人[3]分离的aiiA基因进行比对发现,其核苷酸序列和编码的蛋白序列的相似性分别高达89%~95%和90%~96%,并且证实,Bt的aiiA基因同样可降解AHL致病信号因子以及降低E.carotovora致病的活性。2007年,柴鑫莉等将来自Bt经密码子优化的人工合成aiiA基因导入魔芋,其AHL内酯酶活性检测表明转基因植株魔芋叶片的蛋白可以降解AHL信号分子[5]。周燚[6]、张霞[7]也分别证实了Bt中aiiA基因的抗软腐病活性。
近来,转基因技术在植物新品种选育中日益发挥重要作用,也为石斛兰的品种改良提供新途径。至今,未见将aiiA转入石斛兰以及其它兰花品种的相关报道。本研究从苏云金芽孢杆菌(Bt)中克隆出aiiA,并将其装载入植物表达载体pCAMBIA1301中,利用根癌农杆菌EHA105介导转入石斛兰,以期培育出具有软腐病抗性的石斛兰品种,进而为其它兰花品种的软腐病防治提供新的参考和有效途径。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试验的石斛兰品种为栽培于珠海市农业科学研究中心兰花资源圃的“大熊猫1号”(Dendrobiumekapol‘Panda no.1’),取其自交种子经无菌萌发的类原球茎(PLBs)为转化受体。
1.1.2 菌株及质粒 苏云金芽胞杆菌Bt-10为中山大学庞义教授赠送;质粒载体pCAMBIA1301来自CAMBIA,Canberra, Australia;大肠杆菌EscherichiacoliDH5α、根癌农杆菌(EHA105)(具有利福平抗性)为本室保存。
1.2 方法
1.2.1 石斛兰类原球茎(PLBs)的培养 取石斛兰“大熊猫1号”的自交果实经次氯酸钠消毒,切开果实将种子播种在萌发培养基(1/2 MS培养基+20 g·L-1蔗糖+1 g·L-1活性炭+8 g·L-1琼脂粉,pH 5.8)上,25 ℃、每日光照16 h条件下进行无菌培养。一个月后取无菌萌发的类原球茎(PLBs)作为菌液侵染受体。
1.2.2 含aiiA基因的植物表达载体的构建
(1)引物设计及PCR
根据pCAMBIA1301全序列和aiiA基因全序列特征,运用DNASTAR软件,分别设计扩增CaMV35S启动子、Nos polyA片段和aiiA基因全长读码框的引物。
CaMV35S启动子:C1: 5′-GAATTCATGGTGGAGCACGACACT-3′(引入的位点:EcoRⅠ)
C2: 5′-GGTACCAGAGATAGATTTGTAGAG-3′(引入的位点:KpnⅠ)
Nos polyA:N1: 5′-CTGCAGCGTTCAAACATTTGGCAATAAA-3′ (引入的位点:PstⅠ)
N2: 5′-AAGCTTCCCGATCTAGTAACATAG-3′ (引入的位点:HindⅢ)
aiiA基因:A1:5′-GGATCCATGACAGTAAA-GAAG-3′ (引入的位点:BamHⅠ)
A2:5′-CTGCAGCTATATATACTCAGG-3′ (引入的位点:PstⅠ)
(下划线部分为引入的酶切位点)。引物由Invitrogen 公司合成。50 μL PCR反应体系:模板DNA 50 ng,两种引物各0.25 μmol·L-1,Taq酶0.5 U,dNTP 200 μmol·L-1。以pCAMBIA1301为模板扩增CaMV35S启动子和Nos polyA片段,以Bt-10单菌落为模板扩增aiiA基因,扩增条件为:95 ℃变性5 min,50 ℃退火1 min,72 ℃延伸1 min,30个循环,最后72 ℃延伸10 min。
(2)载体的构建
转基因载体的构建策略如图1所示。质粒提取、酶切,DNA片段回收、连接、转化等按文献[8]的方法略加修改进行。PCR产物连入pMD18-T克隆载体,连接产物转化E.coliDH5α,经序列测定后,以相应的限制性内切酶酶切,回收并纯化,分别连入pCAMBIA1301,转化DH5α,得到重组质粒pSAN。重组质粒经酶切鉴定后,进一步经ABI PRISM377(ersion3.3)自动分析仪进行测序鉴定。

图1 植物表达质粒pSAN的构建
1.2.3 根癌农杆菌介导的石斛兰转化 参照张秒彬等的方法[9],取100 ~ 200 μL 保存于-70 ℃冰箱含表达载体pSAN的农杆菌EHA105,转接到40 mL附加利福平和卡那霉素的YEB液体培养基中,28 ℃ 200 r/min培养至一定A600。取10 mL菌液,4 ℃ 5 000 r/min离心10 min,收集菌体,去上清,用20 mL稀释培养基(1/2 MS基本培养基+20 g·L-1蔗糖,pH 5.5)重悬菌液。稍切去类原球茎的顶端,将其浸入农杆菌侵染液中,28 ℃ 180 r/min侵染30 min。取出PLBs,用灭菌滤纸吸干,转入共培养基(1/2 MS基本培养基+1.0 mg·L-1BA+20 g·L-1蔗糖+8 g·L-1琼脂粉+100 μmol·L-1乙酰丁香酮,pH 5.5),25 ℃暗培养5 d。将PLBs转到选择培养基(1/2 MS基本培养基+1.0 mg·L-1BA+20 g·L-1蔗糖+1 g·L-1活性炭+8 g·L-1琼脂粉+20 mg·L-1潮霉素+250 mg·L-1头孢霉素,pH 5.8),25 ℃培养,每日光照16 h。每隔20 d将存活PLBs进行转瓶继代培养,丢弃褐化死亡的PLBs。
1.2.4 抗性植株的检测 当抗性石斛兰PLBs在含潮霉素的选择培养基上筛选5~6个月时已经分化出叶片,这时可进行转基因植株的检测。
(1)GUS染色检测:参照Jefferson等[10]的GUS组织化学染色方法进行染色。取抗性和对照植株的叶片浸于X-Gluc 染色液中,于37 ℃保温3~12 h后,用乙醇脱色,观察蓝色斑点形成情况。
(2)PCR检测:采用张妙彬等的改良CTAB法(未发表)提取抗性石斛兰小苗基因组DNA,分别扩增T-DNA区域aiiA基因以及潮霉素抗性基因(hpt)片段片段。
hpt引物:HPT1: 5′-GCTGGGGCGTCGGTTTCCACTATCCG-3′;
HPT2: 5′-CGCATAACAGCGCTCATTGACTGGA-GC-3′。
引物A1与A2,PCR反应体系与反应条件同1.2.2。反应结束后,取样5 μL在w=1.0%琼脂糖凝胶上进行电泳检测。
2 结果与分析
2.1 载体构建
以Bt-10单菌落为模板扩增aiiA基因,取PCR产物4 μL电泳检测,获得约765 bp大小的条带(图2,泳道1);以pCAMBIA1301为模板扩增CaMV35S启动子和Nos polyA片段,分别得到520 bp和250 bp大小的扩增产物(图3,泳道1、2)。将3个片段分别克隆到pCAMBIA1301表达载体上,转化E.coliDH5α,得到重组质粒pSAN,挑选阳性克隆,纯化质粒,限制性酶切鉴定,结果与预期大小一致(见图4泳道1,2)。

图2 aiiA PCR产物

图3 CaMV35S启动子和Nos polyA PCR产物
2.2 农杆菌转化石斛兰PLBs及潮霉素抗性苗的获得
经农杆菌菌液侵染的PLBs放至共培养基上,黑暗下共培养5 d后,PLBs生长状态如图5A所示。将转化的PLBs及未转化的PLBs(阴性对照)转至含潮霉素的选择培养基进行培养,每隔20 d记录PLBs生长情况,并将存活PLBs转至新的选择培养基上。PLBs经过约2个月的选择培养后,未转化的PLBs (阴性对照) 在潮霉素筛选下已全部死亡(图5:B), 而转化的PLBs有部分表现出潮霉素抗性并长出新的PLBs(图5:C)。经过了4个月的选择培养,部分潮霉素抗性的PLBs再生成带根的小植株(图5:D),可初步判断其为转基因植株。

图4 重组质粒pSAN酶切鉴定

图5 石斛兰PLBs共培养、选择培养和抗性苗再生情况
2.3 潮霉素抗性苗的GUS组织化学染色
挑取不同株系的潮霉素抗性类原球茎和抗性苗进行GUS组织活性检测。结果如图6所示,抗性类原球茎出现蓝色(图6:B),抗性苗的叶片和新长出的根也出现蓝色或蓝色斑点(图6:C),而对照未出现蓝色或蓝色斑点(图6:A)。

图6 转基因石斛兰的GUS染色
2.4 抗性苗的PCR检测
提取GUS染色阳性的3株抗性苗的叶片基因组DNA,利用特异引物对(A1和A2)和(HPT1和HPT2)进行aiiA基因和hpt基因的PCR 扩增。
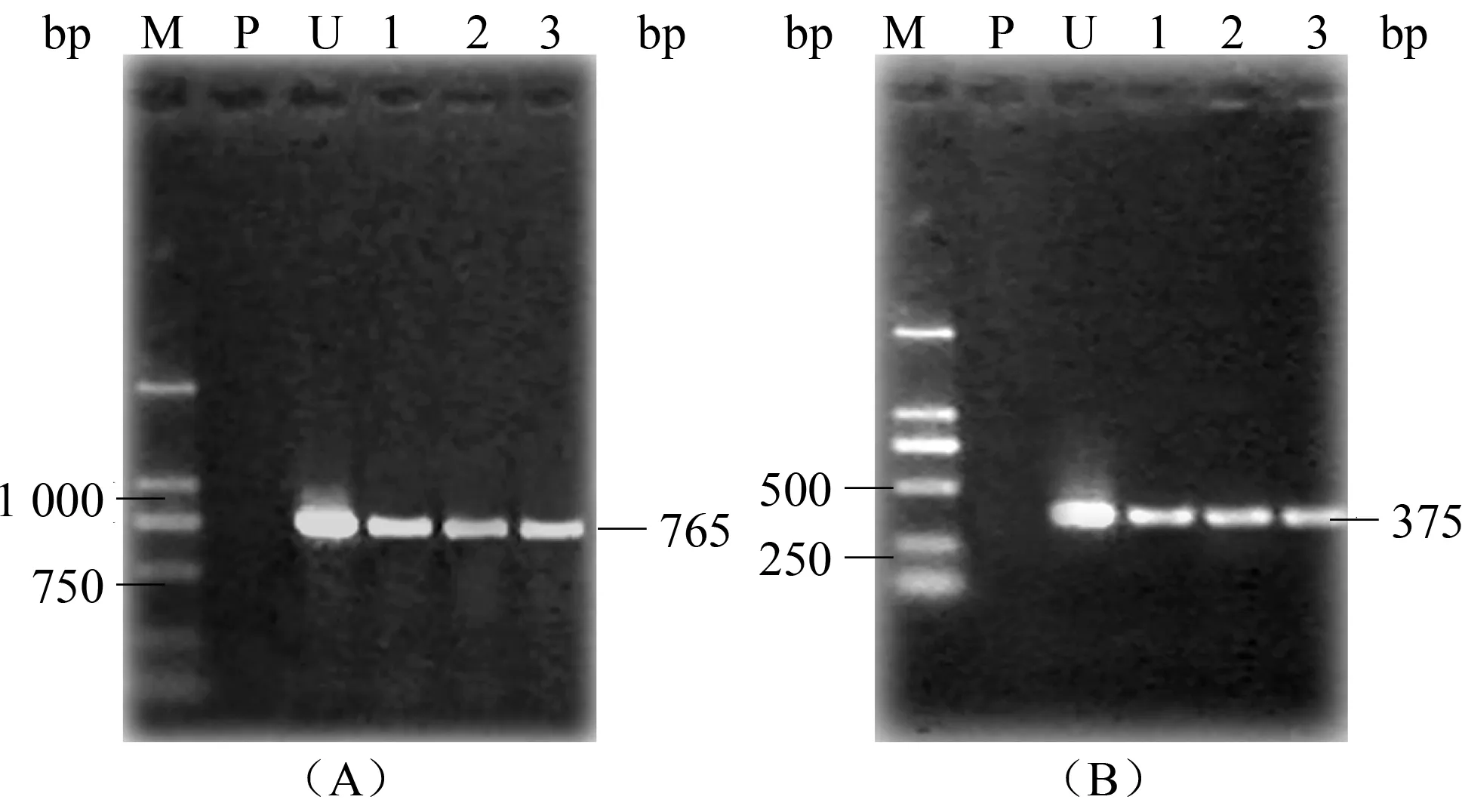
图7 潮霉素抗性苗PCR检测
图7A可以看到3株抗性苗均扩增出765 bp大小的片段,B可以看到3株抗性苗扩增出375 bp大小的片段,与预期aiiA和hpt的扩增片段大小一致,而未转化对照植株没有扩增出相应条带。
从抗性苗的GUS组织化学染色结果以及外源基因hpt和aiiA的PCR结果可证实这些抗性苗为转基因苗。
3 讨 论
植物软腐病是一种严重的世界性流行病害,在全球范围内广泛分布。软腐病由欧文氏菌属的细菌引起, 兰花各种属易受细菌性软腐病侵害,植株和切花品质因此大为下降。在一些植物的转基因研究中已证实苏云金芽孢杆菌中含有的aiiA基因具有抵抗细菌性软腐病的作用,在兰花的病虫害防治和育种研究中尚未见相关报道。本文从苏云金芽孢杆菌(Bt)中克隆出aiiA基因,并将其装载入植物表达载体,利用根癌农杆菌EHA105将该基因介导转入石斛兰。目前,已经获得了含aiiA的转基因苗,这将进一步为利用转基因手段创造抗病力强的石斛兰品种以及兰花的病虫害防治打下基础。由于石斛兰转基因苗生长缓慢,至今还不足以进行下一步的功能验证。待转基因植株可移栽至温室并生长稳定以后,将对其进行软腐病病原菌的接种,以验证该aiiA对转基因石斛兰植株表现出软腐病抗性。
参考文献:
[1] 李杰. 几种名贵洋兰转基因受体系统的建立及遗传转化[D].南京:南京林业大学, 2005:63.
LI Jie. High effitient plantlets regeneration system and genetic transformation inPhalaenopsis,OncidiumandCymbidium[D]. Nanjing: Nanjing Forest University, 2005:63.
[2] DONG Y H, XU J L, LI X Z, et al.AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence ofErwiniacarotovora[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97 (7): 3526-3531.
[3] DONG Y H, WANG L H, XU J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase[J]. Nature, 2001, 411: 813-817.
[4] LEE S J, PARK S Y, LEE J J, et al. Genes encoding the N-acyl homoserine lactone-degrading enzyme is widespread in many subspecies ofBacillusthuringiensis[J]. Applied and Environmental Microbiology, 2002, 68 (8): 3919-3924.
[5] 柴鑫莉,周盈,林拥军,等.苏云金芽孢杆菌抗软腐病aiiA基因转化魔芋研究 [J].分子植物育种,2007,5(5):613-618.
CHAI Xinli, ZHOU Ying, LIN Yongjun,et al. Regeneration of transgenicAmorphophalluskonjacexpressing synthesized acyl-homoserine lactonase(aiiA) gene fromBacillusthuringiensis[J].Molecular Plant Breeding, 2007, 5(5):613-618.
[6] 周燚,孙明,喻子牛. 苏云金芽孢杆菌AiiA 蛋白对魔芋软腐病菌的抗病活性[J].武汉大学学报:理学版,2004,50(6):761-764.
ZHOU Yi, SUN Ming, YU Ziniu. Activity ofBacillusthuringiensisAiiA protein against soft rot disease forAmorphophalluskonjaccause byErwiniacarotovorapv.carotovora[J]. Journal of Wuhan University: Natural Science Edition , 2004, 50(6):761-764.
[7] 张霞,胡玉琴,贾振华,等. 含苏云金芽孢杆菌aiiA基因的重组荧光假单胞菌的构建及对软腐病的抗病活性[J].华北农学报,2006,21(4):13-16.
ZHANG Xia, HU Yuqin, JIA Zhenhua, et al. Construction of genetic modified pseudomonas fluorescens which habouringaiiAgene fromBacillusthuringiensisand its activity against soft rot disease[J]. Acta Agriculturae Boreali-Sinica, 2006, 21(4):13-16.
[8] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning: A laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989.
[9] 张秒彬,梁擎中,肖浩,等. 农杆菌介导石斛兰遗传转化的研究[J].园艺学报,2008,35(4):565-570.
ZHANG Miaobin, LIANG Qingzhong, XIAO Hao, et al. Study onAgrobacterium-mediated transformation ofDendrobium[J]. Acta Horticulturae Sinica, 2008, 35(4):565-570.
[10] JEFFERSON R A, KAVANAGH T A, BEVAN M W. GUS fusion:β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. EMBO Journal, 1987, 6: 3901-3907.
