小肠粘膜下层复合成骨诱导的骨髓基质干细胞体内成骨的实验研究
2009-04-11张开刚曾炳芳张长青
张开刚 曾炳芳 张长青
小肠粘膜下层复合成骨诱导的骨髓基质干细胞体内成骨的实验研究
张开刚 曾炳芳 张长青
目的探讨利用组织工程方法,以小肠粘膜下层为支架材料复合成骨诱导后的骨髓基质干细胞构建骨组织的可行性。方法将取自兔骨髓中的骨髓基质干细胞经成骨诱导液诱导后,与经处理的猪小肠粘膜下层在体外共培养。1周后,将共培养的猪小肠粘膜下层埋置于无胸腺裸鼠皮下。分别在不同时间进行扫描电镜、透射电镜、组织学和免疫组织化学观察。结果体外培养时,见细胞与材料粘附良好,且分泌大量的细胞外基质,细胞分化、增殖活跃。大体观察植入体内的细胞-材料复合物,见颜色变白,组织硬度增加,组织学和电镜观察见有大量骨组织形成。免疫组化示细胞为具有分泌特异性骨钙蛋白的成骨细胞。结论骨髓基质干细胞经成骨诱导为成骨细胞后与小肠粘膜下层共培养,植入裸鼠体内后可形成骨组织,小肠粘膜下层是一种良好的骨组织工程支架材料。
组织工程小肠粘膜下层骨支架材料骨髓基质干细胞
骨缺损修复是骨科面临的难题之一,骨移植是治疗骨缺损的有效方法。骨移植材料因来源受限、免疫排斥和疾病传播等原因,限制了其临床应用。应用组织工程技术构建骨组织,用以修复骨缺损,为临床骨缺损治疗提供了新的途径[1-2]。
小肠粘膜下层(Small intestinal submucosa,SIS)与骨髓基质干细胞(Bone mesenchymal stem cells,BMSCs)有良好的组织相容性[1],可用作骨组织工程支架。本实验将两者共培养后植入体内,探讨其成骨可行性。
1 材料和方法
1.1 主要仪器和试剂
相差显微镜(Olympus,日本),扫描电镜(FEIQuanta 200,Philips,荷兰),透射电镜(JEM-200CX,日本);新生牛血清(杭州四季青生物制品公司);胰蛋白酶(Sigma公司);地塞米松(Sigma公司);维生素C(Sigma公司);β-甘油磷酸钠(Sigma公司);24孔培养板(上海普飞生物技术有限公司);免疫组化试剂盒(DAKO,美国);鼠抗兔骨钙蛋白(OCN)(Chenicon,美国);裸鼠(上海市肿瘤研究所)。
1.2 SIS制备
1.2.1 物理方法处理
小肠取自体重200 Kg以上的封闭饲养的猪,小肠在运输过程中置于冰中,并且清洁过程在猪死亡后4 h内完成,小肠的浆膜层和肌层用裹有纱布的刀柄去除,在去除粘膜和肌层过程中用40℃温水持续冲洗。
1.2.2 化学方法处理
按Abraham等[2]的方法制备。把用物理方法处理后的小肠顺小肠长轴纵行剖开,切成15 cm长后再经过一系列的化学方法处理。每一步化学方法处理工程中,材料与溶液的体积比例保持在1∶100,并且所有的处理过程均在室温下进行。步骤:①将机械方法制得的SIS浸泡在含有100 mmol/L EDTA和10 mmol/L NaOH溶液中(pH=11~12)16 h;②用去离子水将基质冲洗干净,在含有1 mmol/L HCl和1 mmol/L NaCl溶液中(pH=0~1)浸泡6~8 h;③用去离子水冲洗基质,然后在1 mmol/L NaCl的PBS中浸泡16 h;④用去离子水冲洗基质,然后在PBS溶液中(pH=7~7.4)浸泡2 h;⑤再用去离子水冲洗基质2 h(pH=5.8~7.0);⑥杀菌,将SIS在含0.1%过氧乙酸的20%乙醇溶液中浸泡8 h,用含0.05%NaN3的PBS溶液清洗2 h,然后-70℃程序冻干后用γ射线照射(25~35 KGy)消毒。
1.3 BMSCs的分离、培养
取2月龄新西兰大白兔,体重1.5~2.5 Kg,经耳缘静脉注射戊巴必妥钠全麻,用量为30 mg/Kg。胫骨上段及膝关节周围备皮,碘伏消毒皮肤,铺无菌手术巾,保持无菌状态,用小儿骨髓穿刺针接10 mL注射器,注射器内含稀释的肝素钠2 500 U/mL,加入2 mL PBS混匀,自胫骨上段前内侧穿刺抽取骨髓4 mL,缓慢注入预先加入4 mL淋巴细胞分层液的离心试管中,密度梯度离心,2 000 r/min 20 min,吸取单核细胞层,用D-Hanks液洗涤离心2次,每次1 000 r/min 10 min,按1×105cells/mL的密度接种于培养皿,加入含10%胎牛血清的DMEM培养液5 mL(其中含有青霉素100 U/mL,链霉素100 U/mL, pH值7.2~7.4),在37℃、5%CO2孵箱中培养4 d,更换培养液将未贴壁细胞弃掉。继续培养,每隔3~4 d更换一次培养液,相差显微镜下观察见细胞大部分长满贴壁后,用0.25%胰蛋白酶消化5 min后传代培养。
1.4 BMSCs与SIS复合物体外复合培养
在完全培养基中加入成骨诱导剂(β-甘油酸钠80μg/mL、地塞米松10nmol/mL、L-抗坏血酸80 μg/mL)培养的第3代BMSCs,以5.0×105个/孔的密度接种于24孔培养板,每孔加1 cm×1 cm大小的SIS材料1片,再加入培养基1 mL,于37℃、5%CO2饱和湿度条件下复合培养,每3天更换一次培养液。分别于1周、2周后取出SIS用于观察及检测。另设6个空白对照,材料上不种植细胞。
1.5 复合材料移植
将10片细胞-材料复合物和6片无细胞的材料埋植入10只裸鼠(2周龄)背部皮下,观察体内生长情况。
1.6 相差显微镜观察
逐日在相差显微镜下观察培养基有无混浊、细胞生长及与生物材料附着情况和SIS形态变化。1.7组织学观察
不同时期将体外和体内复合组织进行HE染色,观察复合组织的形态结构特征。
1.8 扫描电镜(SEM)观察
将BMSCs与SIS复合培养,分别于培养第1周、第2周,将培养孔内生物材料取出,2.5%戊二醛固定,系列丙酮脱水,乙酸异戊酯置换,临界点干燥,表面喷金后观察BMSCs在SIS上的附着、生长、分裂、增殖情况。
1.9 透射电镜(TEM)观察
将BMSCs与SIS复合培养1周、2周、4周及植入裸鼠体内4周、8周、12周后,2.5%戊二醛固定,系列丙酮脱水,浸透及环氧树酯包埋,超薄切片机切片,醋酸铀-柠檬酸铅双染色,透射电镜观察。
1.10 免疫组织化学观察
将体外及体内复合物进行骨钙蛋白(OCN)免疫双染色观察体外骨髓基质干细胞诱导为成骨细胞和复合材料植入裸鼠体内后的成骨情况。
2 结果
2.1 相差显微镜观察
细胞与材料体外共培养2~4 d时,细胞增殖不明显。单纯培养的细胞呈长梭形或不规则型(图1)。细胞经成骨诱导后变为多边形,核仁大。在第7 d后材料周围有较多细胞直接贴附于材料边缘。在10 d时大量细胞聚集材料边缘(图2)。细胞形态多为梭形及多角形。开始时,SIS呈展开的纸片状;细胞成骨诱导后,SIS的厚度和硬度比未诱导组的明显增加,未形成卷曲。
2.2 体内移植后的细胞-材料复合物大体观察
实验裸鼠植入复合物后,未出现局部感染和复合物排出。4周时,裸鼠背部种植细胞-材料复合物处触及有韧性,随着时间延长,复合物硬度增加,颜色逐渐变白。无细胞材料始终较软,12周后基本触不到材料。取材后检查发现,细胞-材料复合物颜色变白,无细胞材料为淡黄色,但表面都有血管形成(图3,4)。
2.3 组织学观察
将不同时间所取标本以甲醛固定、石蜡包埋后HE染色,行组织学观察。细胞、材料体外共培养2周时,材料表面有大量的细胞粘附,细胞成多层生长(图5)。复合物植入体内后,4周时可见大量新生软骨细胞,陷窝较大,软骨细胞不够成熟,SIS完整;8周时可见软骨化骨现象,有大量骨痂及胶原形成(图6)。单纯材料组内无软骨细胞,只有少量的炎性细胞和成纤维细胞,没有骨组织形成。
2.4 扫描电镜观察
细胞、材料体外共培养,7 d时细胞数量明显增多,基质分泌旺盛,细胞间有大量胶原纤维丝形成细胞间连接。部分细胞跨越孔隙,呈长梭形。培养10 d以后细胞数量增多,且连成片(图7)。2周时细胞数量更多,细胞层数也逐渐增加(图8)。细胞分裂增殖呈三维生长,细胞分泌大量细胞外基质,呈蜂窝状,缝隙逐渐被细胞外基质填塞而变得致密,细胞轮廓也变得模糊。
2.5 透射电镜观察
体外培养时BMSCs在SIS上呈多层生长,细胞连接紧密。胞体成梭形,膜表面有微绒毛状突起,细胞核呈梭形或不规则形,偶见有分叶形,粗面内质网丰富、扩张、增粗,细胞间基质致密,可见钙化灶形成(图9)。复合物植入体内4周时,见有大量的成软骨细胞和成骨细胞,细胞核较大,细胞内有大量的线粒体、高尔基体和粗面内质网,细胞分泌大量的细胞外基质,并有血管形成,间质中有部分钙化带形成。在血管周围可见细胞膜表面带大量绒毛的巨噬细胞(图10,11)。8周时中央部分骨细胞数量明显减少,胞浆中细胞器退化,细胞狭长,包埋于成熟的细胞外基质中。
2.6 免疫组织化学染色
体外培养的BMSCs用免疫荧光双染法检测成骨诱导后OCN呈阳性反应,表明细胞诱导分化为成骨细胞(图12)。细胞-材料复合物植入体内,免疫组织化学OCN检测示细胞呈棕黄色,表明细胞在体内形成骨细胞(图13)。

图1 BMSCs原代培养第7天(40×)

图2 BMSC与SIS体外共培养第10天(100×)

图3 植入4周后,无细胞材料软,表面形成血管

图4 植入4周后,细胞-材料复合物硬,表面形成血管

图5 体外共培养2周,材料表面有大量细胞生长(HE,40×)

图6 植入体内4周时,有大量软骨细胞形成(HE,100×)

图7 SIS与BMSCs体外共培养7 d (SEM,2 000×)

图8 SIS与BMSCs体外共培养2周(SEM,200×)

图9 SIS与BMSCs体外共培养2周(TEM,4 000×)
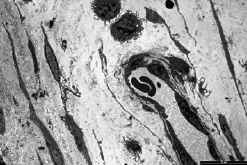
图10 复合物植入4周后,有血管形成,周围有成骨细胞、巨噬细胞和成纤维细胞(TEM,2 500×)

图11 复合物植入4周后,有大量成骨细胞和成纤维细胞,并有钙盐沉积(TEM,1 850×)

图12 体外培养的BMSCs OCN呈阳性反应
3 讨论
3.1 SIS的生物学特性
小肠粘膜下层(SIS)是从猪空肠粘膜下层分离出的无细胞胶原层,是天然的细胞外基质类材料,无免疫性,作为可吸收支架和基质材料已广泛应用于多种组织的修复,如肌腱、半月板和骨缺损的修复[3-5]。SIS这种生物材料更接近于天然结缔组织复杂的成分结构,其结构与细胞具有亲和力,可以有效地传递分子和细胞信息,具有良好的细胞相容性[6-7],可促进多种细胞在材料上的粘附、生长、分化和迁移,并含有VEGF、FGF-2、TGF-β等多种生长因子,能促进与创面愈合有关的细胞增殖,当SIS植入宿主体内后,能迅速诱导细胞浸润,刺激血管生成和宿主细胞的长入和分化,产生的再生组织在结构和功能上与原有组织相似,能为宿主细胞提供可吸收的支架材料,基本能满足生物支架材料的要求,最终达到修复组织缺损的目的。SIS包含有超过90%的Ⅰ型和Ⅲ型胶原,以及纤维粘连蛋白(FN)。Ⅰ型胶原是骨有机质组成的主要成分,在体内为钙盐的沉积提供支架;同时,体外实验中,Ⅰ型胶原促进BMSCs向成骨细胞诱导分化[8]。胶原有利于细胞粘附和早期血管的长入,并且可吸附血液中的生长因子(如BMP等)。
3.2 SIS作为骨组织工程细胞支架材料的可行性

图13 免疫组化示复合物植入体内后形成大量的成骨细胞
种子细胞和支架材料是组织工程研究的核心内容。种子细胞的功能有赖于细胞外基质的存在。细胞与材料的粘附是体外构建组织工程骨的前体和条件[9]。寻找具有良好的生物相容性、生物可降解性、来源广泛、操作处理简单、易于消毒的生物支架材料成为目前的研究热点。BMSCs具有来源广泛、对机体损伤小、分离方便、增殖快、能多向分化的优点[10],体外培养最易向成骨细胞转化,已经成为骨组织工程研究中的最佳种子细胞。体外培养中,在培养液中加入β-磷酸甘油、地塞米松、抗坏血酸后,BMSCs就能向成骨细胞转变,表达多种由成骨细胞分泌的骨基质蛋白,如Ⅰ型胶原、骨钙蛋白、骨桥蛋白等,同时细胞外基质出现钙化现象。我们将BMSCs与SIS在体外共培养后,细胞不仅具有生物活性,且能够大量繁殖,说明BMSCs与SIS具有良好的相容性,为体内植入的成功奠定了基础。
组织工程骨发挥生理功能的关键因素是血管化,只有血管化才能使细胞进行正常的新陈代谢,获得营养,维持生命力。血管再生的最早步骤是血管内皮细胞与底物材料的粘附,材料的物理特性和组成成分必须适合内皮细胞粘附,血管生成需要有能使血管内皮细胞粘附、迁移、侵入并且分化成成熟内皮细胞的底物材料。SIS能为血管内皮细胞提供良好的附着、增殖的环境。Badylak等[11]的实验证明,血管内皮细胞在水合SIS表面有良好的粘附。Hodde等[12]发现,血管内皮细胞能通过SIS中几种附着蛋白,如Ⅰ型胶原、Ⅳ型胶原、纤维结合素而直接附着在SIS上,血管内皮细胞能在SIS的两个面上生长,如果将血管内皮细胞种植在SIS的管腔面,到后期血管内皮细胞可以穿透SIS。本实验中,细胞-材料复合物植入裸鼠皮下后,在材料内形成大量的骨基质,并可见血管长入,表明植入物的血管化促进了新骨形成,也为骨细胞的新陈代谢提供了场所。在体内构建的组织工程骨中能够在早期形成血管可能与SIS中含有的VEGF有关。
3.3 SIS复合BMSCs成骨鉴定指标的选择
BMSCs在体外培养中最易向成骨细胞转化,在培养液中加入成骨诱导液(β-甘油酸钠、地塞米松、L-抗坏血酸)后,BMSCs就开始向成骨表型转变,表现为碱性磷酸酶阳性,表达各种由成骨细胞分泌的骨基质蛋白(Ⅰ型胶原、骨钙蛋白、骨桥蛋白等),同时细胞外基质出现钙化。BMSCs体外诱导分化为成骨细胞的过程,为阐明骨形成发育机制提供了参考[13]。OCN为成骨细胞所特有,本实验通过免疫组织化学证实胞浆内有OCN的表达,说明BMSCs经成骨诱导后在体外可转化为成骨细胞,植入体内后可以继续分泌细胞外基质并具有成骨能力。组织学和透射电镜结果显示成骨细胞分泌大量的细胞外骨基质,并且出现钙化带,形成类似正常的骨组织结构。
3.4 SIS复合BMSCs体内成骨的意义
本研究利用SIS制作的三维支架材料,可供细胞迁移、分化,与BMSCs在体外共培养时,细胞在支架的表面附着良好。植入体内后BMSCs能在SIS支架上诱导成骨,这就为进一步深入研究构建组织工程骨,用于临床移植,修复骨缺损奠定实验基础,为最终代替自体移植修复骨缺损提供依据。
[1]张开刚,曾炳芳,张长青.小肠粘膜下层的制备及细胞相容性的实验研究[J].中华创伤骨科杂志,2005,7:344-348.
[2]Abraham GA,Murray J,Billiar K,et al.Evaluation of the porcine intestinal collagen layer as a biomaterial[J].Biomed Mater Res, 2000,51:442-452.
[3]Derwin K,Androjna C,Spencer E,et al.Porcine small intestine submucosa as a flexor tendon graft[J].Clin Orthop,2004,423:245-252.
[4]Muller-Rath R,Mumme T,Miltner O.Meniscus replacement: current aspects in the field of tissue engineering[J].Z Orthop Ihre Grenzgeb,2004,142(5):540-545.
[5]Lee SJ,Lee IW,Lee YM,et al.Macroporous biodegradable natural/synthetic hybrid scaffolds as small intestine submucosa impregnated poly(D,L-lactide-co-glycolide)for tissue-engineered bone[J].J Biomater Sci Polym Ed,2004,15(8):1003-1017.
[6]Grimes M,Pembroke JT,McGloughlin T.The effect of choice of sterilization method on the biocompatibility and biodegradability of SIS(small intestinal submucosa)[J].Biomed Mater Eng,2005, 15(1-2):65-71.
[7]Luo J,Yang Z,Li X,et al.Cellular compatibility of small intestinal submucosa in vitro[J].Shengwu Yixue Gongchengxue Zazhi,2004, 21(5):800-804.
[8]Hsu FY,Chueh S.Microspheres of hydroxyapatite rreconstituted collagen as supports of osteoblast cell growth[J].Biomaterials, 1999,20(20):1931-1936.
[9]Gumbiner BM.Cell adhesion:the molecular basis of tissue architecture and morphogenesis[J].Cell,1996,84:345-357.
[10]曹谊林,崔磊,刘伟.组织工程在创伤骨科领域的研究进展[J].中华创伤骨科杂志,2004,6(7):724-727.
[11]Badylak S,Liang A,Record R,et al.Endothelial cell adherence to small intestinal submucosa:an acellular bioscaffold[J]. Biomaterials,1999,20(23-24):2257-2263.
[12]Hodde JP,Record RD,Tullius RS,et al.Retention of endothelial cell adherence to porcine-derived extracellular matrix after disinfection and sterilization[J].Tissue Eng,2002,8(2):225-234.
[13]Ducy P,Schinke T,Karsenty G.The ostenblast:a sophisticated fibroblast under central surveillance[J].Science,2000,289(5484): 1501-1504.
An Experimental Study of Bone Mesenchymal Stem Cells Seeds into Small Intestinal Submucosa Induced Toward Bone In Vitro
ZHANG Kaigang1,ZENG Bingfang2,ZHANG Changqing2.
1 Department of Orthopedic Surgery,Taian Center Hospital,Shandong,271000,China;2 Department of Orthopedic Surgery,Shanghai Sixth People’s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200233,China.
ObjectiveTo investigate the feasibility of bone mesenchymal stem cells(BMSCs)seeded into small intestinal submucosa(SIS)to form the tissue engineered bone through inducing culture.MethodsThe BMSCs were isolated by percoll gradient centrifugation from rabbit’s bone marrow.The BMSCs were induced to become osteogenic cells in the defined medium,and were seeded on SIS as the scaffold material for the formation of cell-SIS composite.The scaffold-cell constructs were cultured in vitro for 1 week and were implanted subcutaneously in the dorsa of nude mice.The implants were examined by scanning electron microscopy(SEM),transmission electron microscopy(TEM),histology and immunohistochemistry. ResultsBMSCs adhered and proliferated on SIS,secreted a great deal of extracellular matrices with active cellular function. Gross observation showed subcutaneous lump with considerable tenacity.Large amount of osteocyte were seen and the expression of osteocalcin(OCN)were detected by immunohistological staining technique.ConclusionIt is demonstrated that BMSCs seed SIS can be induced toward bone by induction media.The SIS is an ideal scaffold for the bone tissue engineering.
Tissue engineering;Small intestinal submucosa;Bone;Scaffold;Bone mesenchymal stem cells
Q813.1+2
A
1673-0364(2009)-02-0070-05
2009年2月2日;
2009年3月28日)
10.3969/j.issn.1673-0364.2009.04.003
271000山东省泰安市泰安市中心医院骨科(张开刚);200233上海市上海交通大学医学院附属第六人民医院骨科(曾炳芳,张长青)。
