恩替卡韦与富马酸丙酚替诺福韦初治慢性乙型肝炎患者的肾功能变化比较及影响因素分析
2025-02-27马仕鹏余燕青邬小萍王亮刘丽萍张愈靓万欣葛善飞
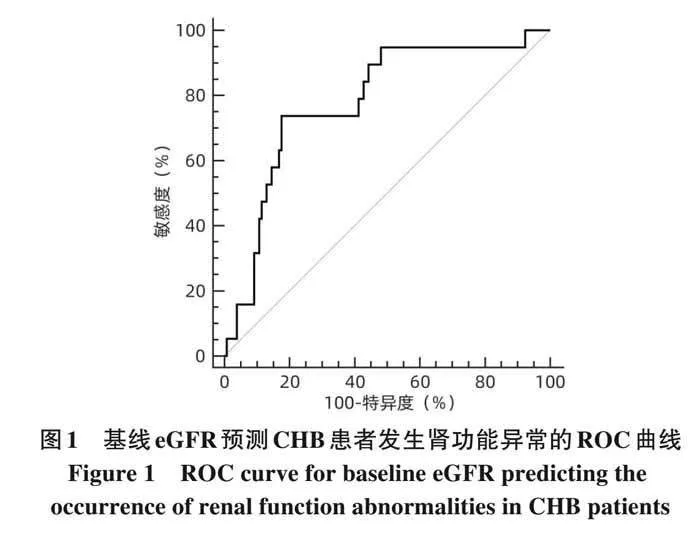

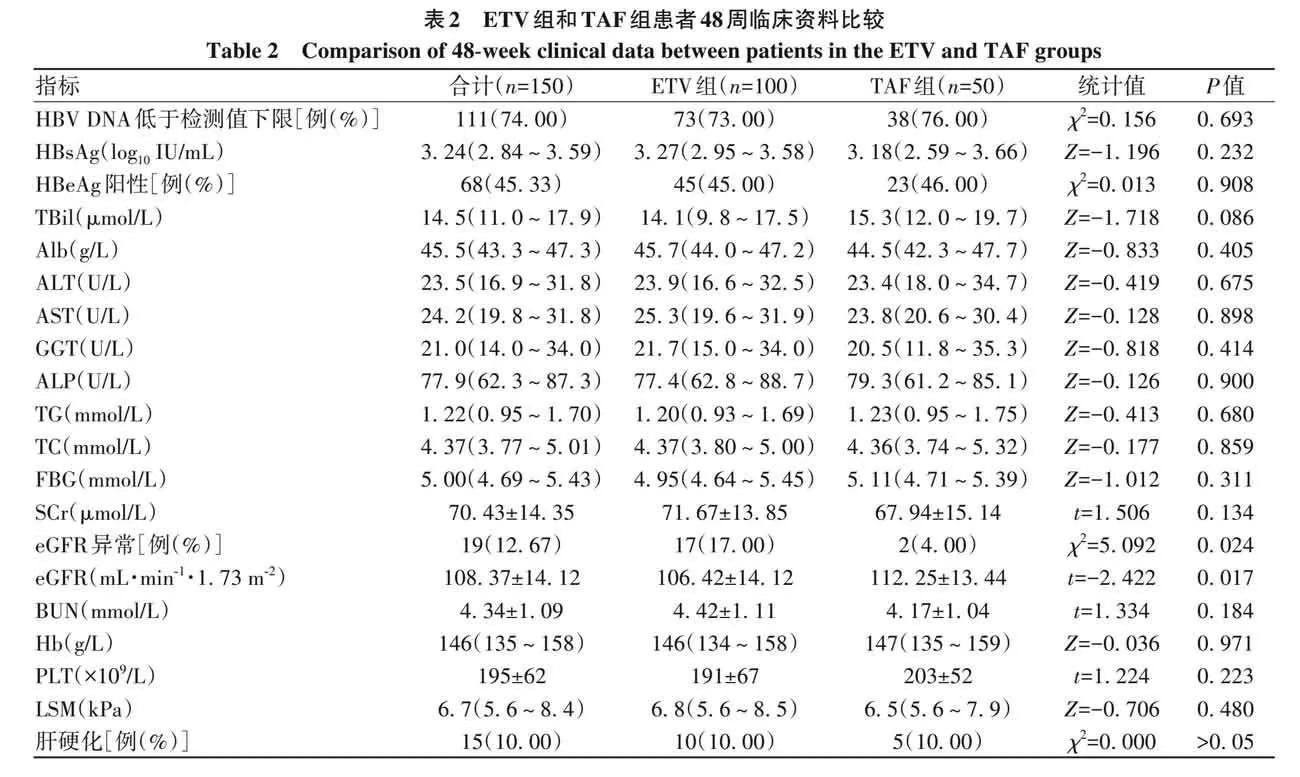

摘要: 目的 分析比较恩替卡韦(ETV)与富马酸丙酚替诺福韦(TAF)对初治慢性乙型肝炎(CHB)患者肾功能的影响。方法 回顾性分析2019年9月—2023年11月于南昌大学第一附属医院感染科门诊接受ETV或TAF治疗至少48周的167例初治CHB患者临床资料。根据患者抗病毒药物分为ETV组(n=117)和TAF组(n=50)。为均衡基线临床资料,采用倾向性评分匹配(PSM)按照2∶1比例进行匹配分析,比较两组患者48周时肾小球滤过率(eGFR)水平及肾功能异常发生率。根据患者48周eGFR水平将患者分为肾功能正常组和异常组。计量资料两组间比较采用成组t检验或Mann-Whitney U检验;计数资料组间比较采用χ 2 检验或Fisher精确检验。采用多因素Logistic回归分析发生肾功能异常的影响因素,受试者工作特征曲线(ROC曲线)评估各指标预测发生肾功能异常的效能。采用Kaplan-Meier法分析肾功能异常累积发生率,并应用Log-rank检验进行比较。采用重复测量资料的方差分析比较CHB患者抗病毒治疗期间eGFR动态变化情况。结果 PSM成功匹配150例CHB患者,其中ETV组100例,TAF组50例。基线时,ETV组和TAF组一般资料比较,差异均无统计学意义(P值均gt;0. 05),两组患者基线eGFR分别为(112. 29±9. 92) mL·min −1 ·1. 73 m −2 和(114. 72±12. 15) mL·min −1 ·1. 73 m −2 。48周时两组患者 eGFR 水平较基线均有下降,ETV 组 48 周 eGFR 明显低于 TAF 组[(106. 42±14. 12) mL·min −1 ·1. 73 m −2 vs(112. 25±13. 44) mL·min −1 ·1. 73 m −2 ,t=−2. 422,P=0. 017],肾功能异常发生率明显高于TAF组(17. 00% vs 4. 00%,χ 2 =5. 092,P=0. 024)。将患者分为肾功能正常组(n=131)与异常组(n=19)后,单因素分析结果显示,两组患者年龄(Z=−2. 039 , P=0. 041)、治疗药物(ETV/TAF)(χ 2 =5. 092 , P=0. 024)、基线 eGFR 水平(t=4. 023 , Plt;0. 001)差异均有统计学意义;多因素Logistic 回归分析显示,基线 eGFR(OR=0. 896,95%CI:0. 841~0. 955,Plt;0. 001)和治疗药物(OR=5. 589,95%CI:1. 136~27. 492,P=0. 034)是发生肾功能异常的独立影响因素。基线eGFR预测CHB患者发生肾功能异常的ROC曲线下面积为0. 781,cut-off值为105. 24 mL·min −1 ·1. 73 m −2 ,敏感度和特异度分别为73. 68%、82. 44%。Kaplan-Meier曲线分析结果显示,基线 eGFR≤105. 24 mL·min −1 ·1. 73 m −2 组患者肾功能异常累积发生率高于基线 eGFRgt;105. 24 mL·min −1 ·1. 73 m −2 组患者(χ 2 =22. 330,Plt;0. 001);ETV组患者肾功能异常累积发生率高于TAF组患者(χ 2 =4. 961,P=0. 026)。随着抗病毒治疗启动,ETV组和TAF组患者eGFR均降低(F=5. 259,Plt;0. 001),但仅在48周时ETV组eGFR水平明显低于TAF组(t=−2. 422,P=0. 017);在基线 eGFR≤105. 24 mL·min −1 ·1. 73 m −2 和基线 eGFRgt;105. 24 mL·min −1 ·1. 73 m −2 的两组患者中,eGFR 亦下降(F=5. 712,Plt;0. 001),且基线及第12、24、36、48周两组患者eGFR比较,差异均有统计学意义(t值分别为−13. 927、−9. 780、−8. 835、−9. 489、−8. 953,P值均lt;0. 001)。结论 对于ETV或TAF初治的CHB患者,ETV抗病毒治疗48周时的肾损伤风险高于TAF治疗。
关键词: 乙型肝炎, 慢性; 恩替卡韦; 富马酸丙酚替诺福韦; 肾损伤; 影响因素分析
基金项目: 江西省卫生健康委科技计划(202310304)
Changes in renal function in chronic hepatitis B patients treated initially with entecavir versus tenofoviralafenamide fumarate and related influencing factors
MA Shipeng a , YU Yanqing b , WU Xiaoping a , WANG Liang a , LIU Liping a , ZHANG Yuliang a , WAN Xin a , GE Shanfei a
a. Department of Infectious Diseases, b. Department of Pathology, The First Affiliated Hospital of Nanchang University, Nanchang330006, China
Corresponding author: GE Shanfei, geshanfei2010@163.com (ORCID: 0000-0002-5917-5863)
Abstract: Objective To investigate the influence of entecavir (ETV) versus tenofovir alafenamide fumarate (TAF) on renalfunction in previously untreated patients with chronic hepatitis B (CHB). Methods A retrospective analysis was performed for theclinical data of 167 previously untreated CHB patients who received ETV or TAF treatment for at least 48 weeks at the outpatientservice of Department of Infectious Diseases in The First Affiliated Hospital of Nanchang University from September 2019 toNovember 2023, and according to the antiviral drug used, they were divided into ETV group with 117 patients and TAF group with50 patients. In order to balance baseline clinical data, propensity score matching (PSM) was used for matching and analysis at aratio of 2∶1, and the two groups were compared in terms of estimated glomerular filtration rate (eGFR) and the incidence rate ofabnormal renal function at week 48. According to eGFR at week 48, the patients were divided into normal renal function group andabnormal renal function group. The independent-samples t test or the Mann-Whitney U test was used for comparison of continuousdata between two groups, and the chi-square test or the Fisher’s exact test was used for comparison of categorical data between twogroups. The multivariate Logistic regression analysis was used to investigate the influencing factors for abnormal renal function, andthe receiver operating characteristic (ROC) curve was used to assess the performance of each indicator in predicting abnormal renalfunction. The Kaplan-Meier method was used to analyze the cumulative incidence rate of abnormal renal function, and the log-ranktest was used for comparison. The analysis of variance with repeated measures was used to compare the dynamic changes of eGFRduring antiviral therapy in CHB patients. Results After PSM matching, there were 100 patients in the ETV group and 50 patientsin the TAF group. There were no significant differences in baseline clinical data between the ETV group and the TAF group (all Pgt;0.05), with an eGFR level of 112.29±9.92 mL/min/1.73 m 2 in the ETV group and 114.72±12.15 mL/min/1.73 m 2 in the TAF group.There was a reduction in eGFR from baseline to week 48 in both groups, and compared with the TAF group at week 48, the ETVgroup had a significantly lower eGFR (106.42±14.12 mL/min/1.73 m 2 vs 112.25±13.44 mL/min/1.73 m 2 , t=−2.422, P=0.017) anda significantly higher incidence rate of abnormal renal function (17.00% vs 4.00%, χ 2 =5.092, P=0.024). After the patients weredivided into normal renal function group with 131 patients and abnormal renal function group with 19 patients, the univariateanalysis showed that there were significant differences between the two groups in age (Z=−2.039, P=0.041), treatment drug (ETV/TAF) (χ 2 =5.092, P=0.024), and baseline eGFR level (t=4.023, Plt;0.001), and the multivariate Logistic regression analysisshowed that baseline eGFR (odds ratio [OR]=0.896, 95% confidence interval [CI]: 0.841 — 0.955, Plt;0.001) and treatment drug(OR=5.589, 95%CI: 1.136 — 27.492, P=0.034) were independent influencing factors for abnormal renal function. Baseline eGFRhad an area under the ROC curve of 0.781 in predicting abnormal renal function in CHB patients, with a cut-off value of 105.24mL/min/1.73 m 2 , a sensitivity of 73.68%, and a specificity of 82.44%. The Kaplan-Meier curve analysis showed that the patientswith baseline eGFR≤105.24 mL/min/1.73 m 2 had a significantly higher cumulative incidence rate of abnormal renal function thanthose with baseline eGFRgt;105.24 mL/min/1.73 m 2 (χ 2 =22.330, Plt;0.001), and the ETV group had a significantly highercumulative incidence rate of abnormal renal function than the TAF group (χ 2 =4.961, P=0.026). With the initiation of antiviraltherapy, both the ETV group and the TAF group had a significant reduction in eGFR (F=5.259, Plt;0.001), but the ETV grouponly had a significant lower level of eGFR than the TAF group at week 48 (t=−2.422, P=0.017); both the baseline eGFR≤105.24 mL/min/1.73 m 2 group and the baseline eGFRgt;105.24 mL/min/1.73 m 2 group had a significant reduction in eGFR (F=5.712, Plt;0.001), and there was a significant difference in eGFR between the two groups at baseline and weeks 12, 24, 36, and48 (t=−13.927, −9.780, −8.835, −9.489, and −8.953, all Plt;0.001). Conclusion For CHB patients initially treated with ETVor TAF, ETV antiviral therapy has a higher risk of renal injury than TAF therapy at week 48.
Key words: Hepatitis B, Chronic; Entecavir; Tenofovir Alafenamide; Kidney Injury; Root Cause Analysis
Research funding: Science and Technology Program of Jiangxi Provincial Health Commission (202310304)
HBV感染目前仍是全球重大公共卫生问题,据统计,全球有2. 57亿人感染HBV,我国HBV感染者达7 900万例,流行率为5. 6%[1] 。目前抗病毒药物主要包括干扰素和口服核苷(酸)类似物(NAs),因 NAs 具有较高的HBV DNA抑制率、高耐药屏障及安全性,故被推荐作为慢性乙型肝炎(CHB)患者的一线治疗药物,当前广泛使用的NAs主要有恩替卡韦(ETV)、富马酸替诺福韦二吡呋酯(TDF)、富马酸丙酚替诺福韦(TAF)、艾米替诺福韦(TMF)等[2-3] 。其中TDF存在骨质疏松及肾功能损伤的风险,用药期间需定期监测血清肌酐(SCr)、肾小球滤过率(eGFR)、血磷等指标,建议存在肾损伤及骨质疏松风险的CHB患者改用ETV或TAF抗病毒治疗[2,4-5]。然而,近期有研究[6] 显示,在使用ETV及TAF抗病毒的CHB患者中,ETV的肾损伤风险明显高于TAF。针对ETV和TAF两种药物,肾损伤风险是否存在明显差异,目前尚无定论。本研究通过观察ETV及TAF初治的CHB患者eGFR变化情况、肾功能异常发生率,比较两种药物的肾损伤风险,旨在为临床选择更优抗病毒治疗方案提供参考依据。
1 资料与方法
1. 1 研究对象 选取 2019年 9月—2023年 11月于本院感染科门诊就诊,ETV或 TAF初治至少 48周的 CHB患者。观察截止时间为 2023年 11月 30日。CHB的诊断标准符合《慢性乙型肝炎防治指南(2022年版)》[2] 。纳入标准:(1)接受ETV或TAF初治至少48周;(2)基线eGFR≥90 mL·min −1 ·1. 73 m −2 ;(3)≥18 岁的成年人。排除标准:(1)合并其他类型的急、慢性肝炎患者(如甲型、丙型、丁型、戊型肝炎,自身免疫性肝炎,酒精性肝炎,药物性肝损伤);(2)合并失代偿期肝硬化的患者;(3)合并肾脏疾病、肾毒性药物使用史、高血压、糖尿病的患者;(4)合并恶性肿瘤、HIV 感染的患者;(5)妊娠期患者;(6)资料不完整的患者。
1. 2 研究方法 根据抗病毒治疗药物将患者分为ETV组和TAF组,为均衡基线资料,按2∶1行倾向性评分匹配(PSM)。根据 48 周时患者 eGFR≥90 mL·min −1 ·1. 73 m −2或lt;90 mL·min −1 ·1. 73 m −2 进一步分为肾功能正常组和异常组。
1. 3 观察指标 收集患者的一般资料,包括性别、年龄、身体质量指数(BMI)、有无肝硬化。实验室指标:基线及第 12、24、36、48 周患者高敏 HBV DNA,HBsAg,HBeAg,血常规,肝、肾功能,血脂,血糖;eGFR(根据CKD-EPI 计算)。影像学指标:腹部彩超、肝硬度测量(LSM)等。血常规、血生化指标均在本院检验科完成。高敏 HBV DNA 定量检测采用 TaqMan 实时荧光定量PCR(美国罗氏480实时荧光定量PCR仪),检测下限为20 IU/mL。血清 HBV 标志物采用美国雅培公司 AbbottARCHITECT仪器及试剂分析。
1. 4 统计学方法 应用Rstudio按照最近邻配比法,将ETV组和TAF组患者基线差异较大的指标进行PSM;采用 SPSS 26. 0 和 MedCalc 20. 0 软件进行统计学处理,GraphPad Prism 10软件进行绘图。正态分布的计量资料以 x ˉ ±s表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P 25 ~P 75 )表示,两组间比较采用Mann-Whitney U 检验。计数资料组间比较采用 χ 2 检验或Fisher精确检验。采用多因素Logistic回归分析CHB患者发生肾功能异常的独立影响因素,运用受试者工作特征曲线(ROC曲线)评估相关因素对患者发生肾功能异常的预测价值。采用Kaplan-Meier法分析肾功能异常累积发生率,并应用Log-rank检验进行比较。采用重复测量资料的方差分析比较eGFR动态变化情况。HBV DNA及HBsAg定量进行对数转换。Plt;0. 05为差异有统计学意义。
2 结果
2. 1 一般资料 共纳入167例CHB患者,通过PSM成功匹配150例,其中男89例(59. 33%)、女61例(40. 67%),年龄 19~69 岁,BMI 平均(22. 91±3. 24)kg/m 2 。根据治疗药物分组,ETV 组 100 例,男 60 例(60. 00%)、女 40 例(40. 00%);TAF 组 50 例,男 29 例(58. 00%)、女 21 例(42. 00%)。两组患者治疗前一般资料比较,差异均无统计学意义(P值均gt;0. 05)(表1)。
2. 2 ETV组和TAF组CHB患者48周eGFR变化及肾功异常发生率比较 48周时ETV组和TAF组患者eGFR较基线均有下降,ETV组48周时的eGFR水平明显低于TAF组(Plt;0. 05)。48周时两组患者共有19例发生肾功能异常(eGFRlt;90 mL·min −1 ·1. 73 m −2 ),异常率为 12. 67%,其中ETV组有17例,异常率为17. 00%,TAF组有2例,异常率为4. 00%,两组eGFR异常率比较,差异有统计学意义(Plt;0. 05)(表2)。
2. 3 CHB 患者 48周发生肾功能异常的影响因素分析根据48周时eGFR水平,将150例CHB患者分为肾功能正常组131例(eGFR≥90 mL·min −1 ·1. 73 m −2 )和肾功能异常组19例(eGFRlt;90 mL·min −1 ·1. 73 m −2 )。单因素分析结果显示,两组患者年龄、基线eGFR及治疗药物(ETV/TAF)比较,差异均有统计学意义(P值均lt;0. 05)(表3)。将单因素分析中有统计学意义的指标纳入多因素Logistic回归分析,结果显示,基线 eGFR(OR=0. 896,95%CI:0. 841~0. 955,Plt;0. 001)、治疗药物(ETV/TAF)(OR=5. 589,95%CI:1. 136~27. 492,P=0. 034)是CHB患者发生肾功能异常的独立影响因素。
2. 4 CHB 患者发生肾功能异常影响因素的预测价值为了评估患者肾功能异常发生的独立影响因素的预测效能,将上述 Logistic 回归分析提示的基线 eGFR 进一步行ROC曲线分析,结果显示,其预测CHB患者发生肾功能异常的 ROC 曲线下面积为 0. 781,cut-off 值为105. 24 mL·min −1 ·1. 73 m −2 ,敏感度和特异度分别为73. 68%、82. 44%(图1)。
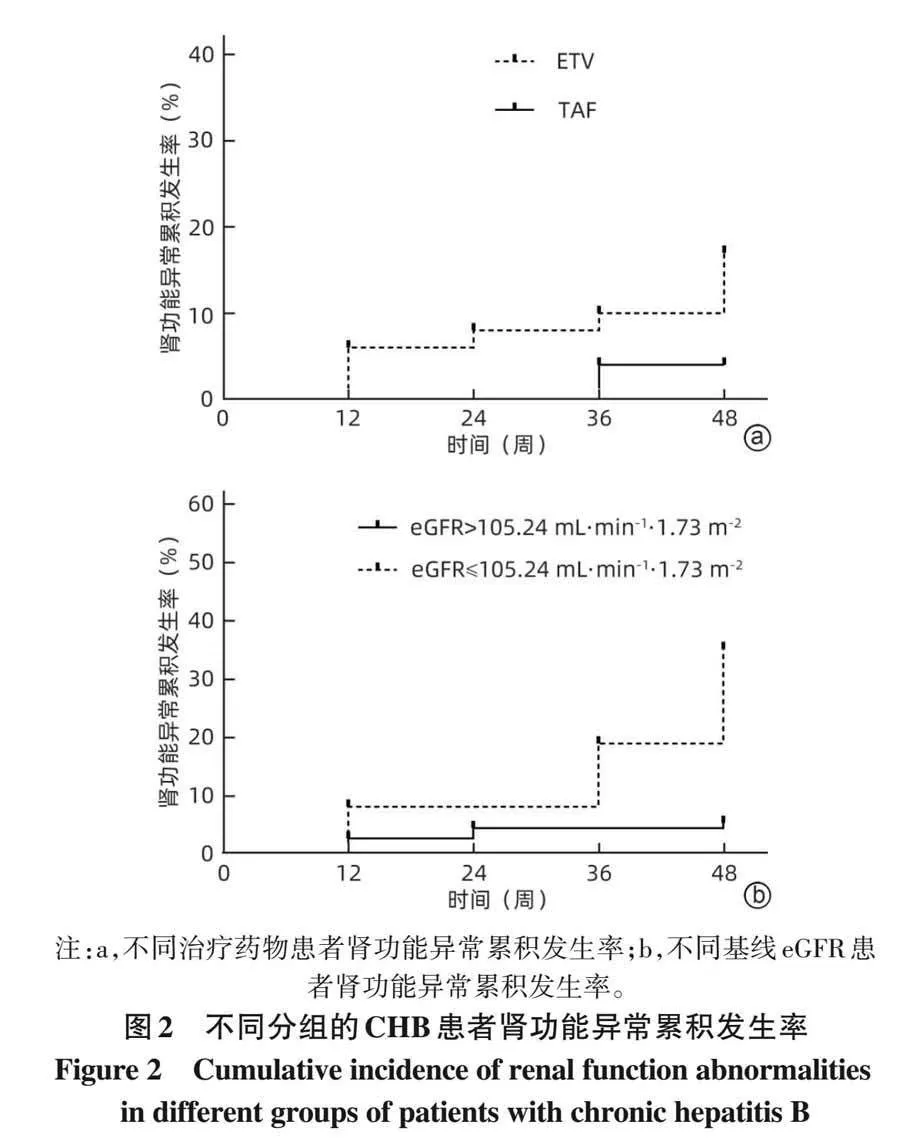
2. 5 不同治疗药物(ETV/TAF)和不同基线 eGFR患者的肾功能异常累积发生率分析 通过Kaplan-Meier曲线分析不同治疗药物(ETV/TAF)CHB患者肾功能异常的累积发生率,结果显示,随着治疗时间的延长,两组患者肾功能异常发生率逐渐升高,且ETV组高于TAF组,差异有统计学意义(χ 2 =4. 961 , P=0. 026)(图2a)。
此外,根据基线 eGFR水平将 150例 CHB患者分为基线eGFRgt;105. 24 mL·min −1 ·1. 73 m −2 组(113例)和基线eGFR≤105. 24 mL·min −1 ·1. 73 m −2 组(37例),Kaplan-Meier曲线分析结果显示,随着治疗时间的延长,两组患者肾功能异常发生率逐渐升高,但后者肾功能异常发生率高于前者,差异有统计学意义(χ 2 =22. 330,Plt;0. 001)(图2b)。
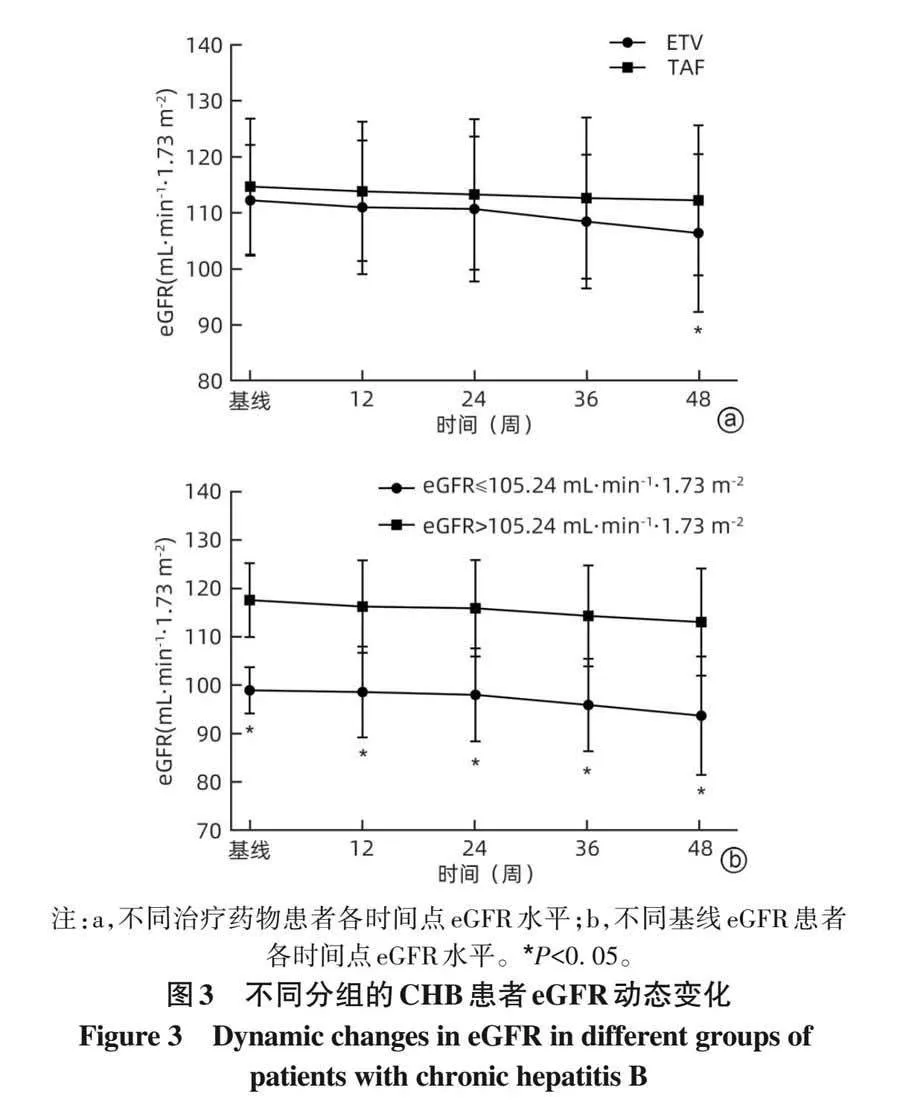
2. 6 不同治疗药物(ETV/TAF)、不同基线eGFR患者治疗期间eGFR动态变化分析 基线时,ETV组与TAF组患者的eGFR水平相当,差异无统计学意义(Pgt;0. 05);随着抗病毒治疗启动,两组患者 eGFR 均降低(F=5. 259,Plt;0. 001),比较各时间点两组患者 eGFR 水平差异,仅在48周时ETV组eGFR水平明显低于TAF组(t=−2. 422,P=0. 017)(图3a)。
随着对 CHB 患者抗病毒治疗的启动,基线 eGFR≤105. 24 mL·min −1 ·1. 73 m −2 组 和 基 线 eGFRgt;105. 24mL·min −1 ·1. 73 m −2 组患者 eGFR 均下降(F=5. 712,Plt;0. 001),且各时间点两组患者eGFR比较,差异均有统计学意义(t 值分别为−13. 927、−9. 780、−8. 835、−9. 489、−8. 953,P值均lt;0. 001)(图3b)。
3 讨论
HBV感染可引起 HBV相关性肾小球肾炎,导致肾损伤,是肾功能障碍的危险因素[7-10] 。真实世界研究 [11]表明,部分抗病毒治疗的CHB患者发生肾损伤的风险更高。因此,对于HBV感染者,尤其长期使用NAs抗病毒的CHB患者,应密切关注肾功能,选择肾毒性小、安全可靠的抗病毒药物至关重要。
目前广泛使用的口服抗病毒药物包括 ETV、TDF、TAF、TMF,其主要通过肾脏排出,可通过损伤肾小管转运蛋白、线粒体毒性、细胞凋亡等途径导致肾功能障碍[12-14] 。TDF、TAF、TMF均是替诺福韦(TFV)的前体药,TDF在血液中很快水解为TFV,随血液循环经肾脏代谢,长期使用TDF可造成肾损伤。TAF和TMF以原型存在于血液循环中,在血浆中较TDF更稳定,且直接在肝细胞中被水解为TFV,并能更有效地将活性代谢物递送至肝细胞中,故在较低的药物剂量下细胞内的TFV水平较高,从而使TAF和TMF的肾损伤风险明显低于TDF[15-18]。ETV以原型通过肾脏清除,肾脏安全性亦优于TDF[10,19] 。因此,ETV、TAF及TMF在肾损伤风险方面均低于TDF。欧洲肝病学会乙型肝炎指南[4] 建议,对于年龄gt;60 岁,eGFRlt;60 mL·min −1 ·1. 73 m −2 等有骨、肾损伤风险的人群,建议使用ETV或TAF抗病毒。美国肝病学会乙型肝炎指南[5] 建议,对于TDF引起的肾损伤及骨病,应停用TDF,换用 ETV 或 TAF。我国《慢性乙型肝炎防治指南(2022年版)》[2] 建议,对于慢性肾脏病、肾功能不全或接受肾脏替代治疗的 CHB患者,建议 ETV或 TAF抗病毒治疗。但关于ETV和TAF两种药物肾损伤风险的比较,目前尚无定论。
SCr和eGFR均为评估肾功能的指标。SCr是人体肌肉代谢产物,由肾小球滤过,随尿液排泄。eGFR是单位时间内两肾生成的超滤量,当肾功能受损时,SCr升高,eGFR下降。因SCr受性别、年龄等因素的影响,而eGFR的计算则考虑了上述相关因素的影响,所以使用eGFR评估肾功能更加准确[20-21] 。Peng 等 [22] 研究发现,在HBV相关慢加急性肝衰竭患者中,TAF的肾损伤风险明显低于 ETV。Jung等[6] 研究纳入 298 例初治的 CHB 患者,ETV组和TAF组各149例,平均随访时间近80周时发现,ETV组肾功能异常发生率高于TAF组,使用ETV抗病毒的肾损伤风险高于TAF。笔者团队前期研究[23]表明,ETV经治的CHB患者序贯或联合TAF肾功能可得到改善。本研究分析比较了150例初治的CHB患者,发现48周时ETV组较TAF组患者eGFR下降更明显,ETV组较 TAF 组发生肾功能异常的比例更高(17. 0% vs4. 0%),差异均有统计学意义(P值均lt;0. 05),这与上述研究结果基本一致,提示在 ETV或 TAF初治的 CHB患者中,长期使用ETV抗病毒治疗较TAF的肾损伤风险可能更高。此外,本研究中48周时两组患者的HBV DNA、HBsAg、ALT、AST与基线相比均有所下降,两组间差异均无统计学意义,提示ETV和TAF在病毒学应答及改善肝功能方面的疗效相当,与目前大多数研究结果[24-25]相符。
关于肾功能异常的影响因素,有研究[26-28] 表明,性别、年龄、高血压、糖尿病、肝硬化、肥胖、血脂等是发生肾功能异常的独立影响因素。本研究根据48周时eGFR水平将患者分为肾功能正常组与异常组,发现基线eGFR、治疗药物(ETV/TAF)是发生肾功能异常的独立影响因素,与以上研究存在差异,原因在于: (1)本研究剔除了合并高血压、糖尿病的CHB患者;(2)eGFR的计算已纳入了性别及年龄因素。但本研究中肝硬化、BMI、血脂不是肾功能异常的独立影响因素,可能与本研究样本量较少有关。基线eGFR预测CHB患者发生肾功能异常的ROC曲线下面积为 0. 781,敏感度和特异度分别为 73. 68%、82. 44%,cut-off 值为 105. 24 mL·min −1 ·1. 73 m −2 ,具有一定预测效能。进一步对 CHB患者 eGFR行动态分析发现,抗病毒治疗过程中 eGFR 下降,其中基线 eGFR≤105. 24 mL·min −1 ·1. 73 m −2 的患者更易发生肾功能损伤,原因可能是eGFR偏低的CHB患者药物清除更慢,更易出现药物蓄积,从而导致肾脏损伤[29]。本研究还比较了 ETV组和 TAF组 CHB患者抗病毒治疗期间 eGFR变化,发现48周时ETV组患者eGFR明显低于TAF组,而基线时两组患者eGFR水平相当,由此可见,使用ETV抗病毒治疗的肾毒性可能高于TAF治疗,对CHB患者在抗病毒治疗过程中监测eGFR的动态变化具有重要意义。
此外,早期肾损伤常表现为肾小管功能异常,相关标志物包括尿α1微球蛋白、β2微球蛋白和N-乙酰β-D氨基葡萄糖苷酶等指标,有研究[30] 表明,ETV长期治疗CHB患者存在肾小管功能损伤的风险,本研究未纳入以上指标,后期研究中将进一步比较两种药物在肾小管损伤风险方面的差异。
综上所述,本研究结果显示,ETV 或 TAF 初治的CHB患者,ETV抗病毒治疗 48周时的肾损伤风险高于TAF,长期ETV抗病毒治疗和基线eGFR水平是CHB患者48周发生肾功能异常的独立影响因素。此外,ETV和TAF在病毒学应答及改善肝功能方面的疗效相当。本研究为CHB患者选择抗病毒治疗方案提供了参考依据,但亦存在不足之处,一方面,未纳入评价肾小管损伤的相关标志物;另一方面,本研究为回顾性分析,可能存在样本量较少、随访时间较短等不足,后期有待多中心、前瞻性的大样本研究来进一步证实。
伦理学声明: 本研究方案经由南昌大学第一附属医院伦理委员会审批,批号:(2023)CDYFYYLK(01-006)。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 马仕鹏负责数据收集整理,撰写论文;余燕青、邬小萍负责指导和审阅文章;王亮、刘丽萍、张愈靓、万欣负责数据收集;葛善飞负责研究设计,指导写作思路并最后定稿。
参考文献:
[1] Polaris Observatory Collaborators. Global prevalence, cascade ofcare, and prophylaxis coverage of hepatitis B in 2022: A modellingstudy[J]. Lancet Gastroenterol Hepatol, 2023, 8(10): 879-907. DOI:10.1016/S2468-1253(23)00197-8.
[2] Chinese Society of Hepatology, Chinese Medical Association; Chi⁃nese Society of Infectious Diseases, Chinese Medical Association.Guidelines for the prevention and treatment of chronic hepatitis B(version 2022)[J]. Infect Dis Info, 2023, 36(1): 1-17. DOI: 10.3969/j.issn.1007-8134.2023.01.01.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 传染病信息, 2023, 36(1): 1-17. DOI: 10.3969/j.issn.1007-8134.2023.01.01.
[3] MASETTI C, PUGLIESE N, AGHEMO A, et al. Safety of current antivi⁃ral drugs for chronic hepatitis B[J]. Expert Opin Drug Saf, 2022, 21(7): 939-945. DOI: 10.1080/14740338.2022.2045271.
[4] European Association for the Study of the Liver. EASL 2017 ClinicalPractice Guidelines on the management of hepatitis B virus infection
[J]. J Hepatol, 2017, 67(2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
[5] TERRAULT NA, LOK ASF, MCMAHON BJ, et al. Update on preven⁃tion, diagnosis, and treatment of chronic hepatitis B: AASLD 2018hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599. DOI:10.1002/hep.29800.
[6] JUNG CY, KIM HW, AHN SH, et al. Higher risk of kidney function de⁃cline with entecavir than tenofovir alafenamide in patients withchronic hepatitis B[J]. Liver Int, 2022, 42(5): 1017-1026. DOI: 10.1111/liv.15208.
[7] KIM SE, JANG ES, KI M, et al. Chronic hepatitis B infection is signifi⁃cantly associated with chronic kidney disease: A population-based,matched case-control study[J]. J Korean Med Sci, 2018, 33(42):e264. DOI: 10.3346/jkms.2018.33.e264.
[8] FABRIZI F, CERUTTI R, RIDRUEJO E. Hepatitis B virus infection asa risk factor for chronic kidney disease[J]. Expert Rev Clin Pharma⁃col, 2019, 12(9): 867-874. DOI: 10.1080/17512433.2019.1657828.
[9] YU YN, XU LY, XU T, et al. Efficacy and safety of entecavir for hepa⁃titis B virus-associated glomerulonephritis with renal insufficiency
[J]. Clin Exp Nephrol, 2023, 27(8): 680-686. DOI: 10.1007/s10157-023-02351-z.
[10] MAK LY, HOANG J, JUN DW, et al. Longitudinal renal changes inchronic hepatitis B patients treated with entecavir versus TDF: AREAL-B study[J]. Hepatol Int, 2022, 16(1): 48-58. DOI: 10.1007/s12072-021-10271-x.
[11] LEE JS, JUNG CY, LEE JI, et al. Comparison of decline in renal func⁃tion between patients with chronic hepatitis B with or without antivi⁃ral therapy[J]. Aliment Pharmacol Ther, 2023, 58(1): 99-109. DOI:10.1111/apt.17532.
[12] RAY AS, FORDYCE MW, HITCHCOCK MJ. Tenofovir alafenamide: Anovel prodrug of tenofovir for the treatment of human immunodefi⁃ciency virus[J]. Antiviral Res, 2016, 125: 63-70. DOI: 10.1016/j.anti⁃viral.2015.11.009.
[13] YANG YM, CHOI EJ. Renal safety of tenofovir and/or entecavir in pa⁃tients with chronic HBV monoinfection[J]. Ther Clin Risk Manag,2017, 13: 1273-1285. DOI: 10.2147/TCRM.S143286.
[14] QI Q, YAO X, YANG GD, et al. Clinical application of recommendedantiviral drugs for patients with hepatitis B virus-related decompen⁃sated cirrhosis[J]. Int J Virol, 2023, 30(3): 248-250. DOI: 10.3760/cma.j.issn.1673-4092.2023.03.015.其七, 姚欣, 杨国栋, 等. 推荐用于乙肝肝硬化失代偿期病例抗病毒治疗药物的临床应用现状[J]. 国际病毒学杂志, 2023, 30(3): 248-250.DOI: 10.3760/cma.j.issn.1673-4092.2023.03.015.
[15] DA WANG F, ZHOU J, LI LQ, et al. Improved bone and renal safetyin younger tenofovir disoproxil fumarate experienced chronic hepati⁃tis B patients after switching to tenofovir alafenamide or entecavir
[J]. Ann Hepatol, 2023, 28(5): 101119. DOI: 10.1016/j.aohep.2023.101119.
[16] HOSAKA T, SUZUKI F, KOBAYASHI M, et al. Renal safety and bio⁃chemical changes for 2 years after switching to tenofovir alafen⁃amide from long-term other nucleotide analog treatment in patientswith chronic hepatitis B[J]. Hepatol Res, 2022, 52(2): 153-164. DOI:10.1111/hepr.13726.
[17] BUTI M, MARCOS-FOSCH C, ESTEBAN R. Nucleos(t)ide analoguetherapy: The role of tenofovir alafenamide[J]. Liver Int, 2021, 41(Suppl 1): 9-14. DOI: 10.1111/liv.14848.
[18] LENS S, POCURULL A. Editorial: The three tenors in HBV-TDF, TAFand now TMF[J]. Aliment Pharmacol Ther, 2022, 55(1): 120. DOI: 10.1111/apt.16668.
[19] CHON YE, PARK SY, KIM SU, et al. Long-term renal safety betweenpatients with chronic hepatitis B receiving tenofovir vs. entecavirtherapy: A multicenter study[J]. J Viral Hepat, 2022, 29(4): 289-296. DOI: 10.1111/jvh.13656.
[20] INKER LA, ENEANYA ND, CORESH J, et al. New creatinine- andcystatin C-based equations to estimate GFR without race[J]. NEngl J Med, 2021, 385(19): 1737-1749. DOI: 10.1056/NEJMoa2102953.
[21] Kidney Disease: Improving Global Outcomes (KDIGO) GlomerularDiseases Work Group. KDIGO 2021 clinical practice guideline forthe management of glomerular diseases[J]. Kidney Int, 2021, 100(4S): S1-S276. DOI: 10.1016/j.kint.2021.05.021.
[22] PENG WT, GU HM, CHENG D, et al. Tenofovir alafenamide versusentecavir for treating hepatitis B virus-related acute-on-chronic liverfailure: Real-world study[J]. Front Microbiol, 2023, 14: 1185492. DOI:10.3389/fmicb.2023.1185492.
[23] LIU LP, WU XP, CAI TP, et al. Analysis of efficacy and factors influ⁃encing sequential combination therapy with tenofovir alafenamidefumarate after treatment with entecavir in chronic hepatitis B patientswith low-level viremia[J]. Chin J Hepatol, 2023, 31(2): 118-125. DOI:10.3760/cma.j.cn501113-20221019-00507.刘丽萍, 邬小萍, 蔡天盼, 等. 恩替卡韦经治后低病毒血症的慢性乙型肝炎患者序贯联合富马酸丙酚替诺福韦治疗的疗效及影响因素分析[J].中华肝脏病杂志, 2023, 31(2): 118-125. DOI: 10.3760/cma.j.cn501113-20221019-00507.
[24] JEONG S, SHIN HP, KIM HI. Real-world single-center comparison ofthe safety and efficacy of entecavir, tenofovir disoproxil fumarate,and tenofovir alafenamide in patients with chronic hepatitis B[J]. In⁃tervirology, 2022, 65(2): 94-103. DOI: 10.1159/000519440.
[25] HAGIWARA S, NISHIDA N, UESHIMA K, et al. Comparison of effi⁃cacy and safety of entecavir and switching from entecavir to tenofo⁃vir alafenamide fumarate in chronic hepatitis B: Long-term effectsfrom a prospective study[J]. Hepatol Res, 2021, 51(7): 767-774. DOI:10.1111/hepr.13650.
[26] WANG L, XU X, ZHANG M, et al. Prevalence of chronic kidney dis⁃ease in China: Results from the sixth China chronic disease and riskfactor surveillance[J]. JAMA Intern Med, 2023, 183(4): 298-310. DOI:10.1001/jamainternmed.2022.6817.
[27] TANAKA M, AKAHANE T, KAWARATANI H, et al. Effects of enteca⁃vir and tenofovir alafenamide fumarate treatment on renal function inJapanese elderly patients with chronic hepatitis B[J]. Hepatol Res,2024, 54(3): 252-260. DOI: 10.1111/hepr.13982.
[28] BURNIER M, DAMIANAKI A. Hypertension as cardiovascular riskfactor in chronic kidney disease[J]. Circ Res, 2023, 132(8): 1050-1063. DOI: 10.1161/CIRCRESAHA.122.321762.
[29] ZOCCALI C, MALLAMACI F, de CATERINA R. Pharmacokinetic rel⁃evance of glomerular hyperfiltration for drug dosing[J]. Clin KidneyJ, 2023, 16(10): 1580-1586. DOI: 10.1093/ckj/sfad079.
[30] CHE YM, LI A, WANG L, et al. Influence of long-term use of enteca⁃vir on renal tubular function in patients with chronic hepatitis B[J]. JClin Hepatol, 2023, 39(6): 1313-1317. DOI: 10.3969/j.issn.1001-5256.2023.06.010.
车媛梅, 李嫒, 王亮, 等. 长期使用恩替卡韦对慢性乙型肝炎患者肾小管功能的影响[J]. 临床肝胆病杂志, 2023, 39(6): 1313-1317. DOI: 10.3969/j.issn.1001-5256.2023.06.010.
收稿日期:2024-05-28;录用日期:2024-06-17
本文编辑:葛俊
