蛇床子素对大鼠皮肤创面愈合和血管生成的影响及机制
2025-02-15费曦艳王丹江娟何新芳张恩景费舒奇



关键词蛇床子素;超音刺猬信号通路;创面愈合;皮肤;血管生成
皮肤创面愈合是由多种细胞因子、生长因子及多种细胞参与的一种病理生理进程,需要经过止血、血管生成、炎症反应、肉芽组织形成、纤维增殖或基质形成、再上皮化等过程[1]。皮肤创面愈合能够使皮肤保持完整性,然而在感染、过度炎症、严重缺血甚至部分疾病的影响下,创面愈合的过程受到干扰,使得愈合时间明显延长,严重影响了患者的身心健康[2]。研究发现,促进伤口的血管生成是加速皮肤创面愈合的有效策略之一[3]。常见的促进伤口血管生成的药物有血管内皮生长因子类药物(如贝伐珠单抗、阿柏西普等)、血管生成素类药物(如马西替坦、利奥西呱)、前列环素类药物(如前列地尔、依前列醇)等,但这些药物会导致高血压、出血、血栓等副作用。因此,开发新的安全有效的药物以促进皮肤创面愈合和血管生成,已成为临床研究的热点和重点。
蛇床子素(osthole,OST)是提取自中药蛇床子的一种天然化合物,具有抗炎、抗过敏、抗肿瘤、保护肝脏、保护神经、保护骨关节、改善骨质、改善免疫功能等作用[4]。已有研究发现,OST能减轻皮肤炎症、修复皮肤屏障,在组胺诱导的人角质形成细胞和成纤维细胞炎症过程中,改善了细胞迁移和细胞屏障功能[5]。还有研究发现,OST可促进血管生成,且其衍生物能够加快皮肤伤口愈合[6―7]。超音刺猬(sonichedgehog,SHH)信号通路与胚胎发育、细胞自我更新和干细胞群维持密切相关,其被激活能够促进皮肤创面愈合和血管形成[8]。基于此,本研究拟建立全层皮肤缺损伤口模型大鼠,从SHH信号通路角度出发,研究OST对模型大鼠皮肤血管生成和创面愈合的影响及机制,以期为OST的临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括RX50型光学显微镜[舜宇光学科技(集团)有限公司],AMR-100型酶标仪(杭州奥盛仪器有限公司),CFXDuet型实时荧光定量聚合酶链式反应(real-timefluorescencequantitativepolymerasechainreaction,RT-qPCR)仪(美国Bio-Rad公司),500-151-30型游标卡尺(苏州天音腾达机电工程有限公司),Tanon5200型凝胶图像处理系统(上海天能科技有限公司)。
1.2 主要药品与试剂
OST对照品(批号S2337,纯度99.99%)购自美国SelleckChemical公司;SHH抑制剂环巴胺对照品(批号C4116,纯度≥98%)购自美国Sigma公司;苏木素-伊红(HE)染色试剂盒、Masson染色试剂盒(批号分别为D006-1-4、D026-1-1)均购自南京建成生物科技有限公司;血管生成素1(angiopoietin-1,Ang-1)酶联免疫吸附测定(ELISA)试剂盒(批号SEKR-0055)购自北京索莱宝科技有限公司;碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bFGF)ELISA试剂盒(批号D731030-0096)购自生工生物工程(上海)股份有限公司;BCA蛋白定量试剂盒、Trizol试剂(批号分别为FD2001、FD8872)均购自杭州弗德生物科技有限公司;兔源血管内皮生长因子A(vascularendothelialgrowthfactorA,VEGFA)、SHH、血管内皮生长因子受体2(vascularendothelialgrowthfactorreceptor-2,VEGFR-2)、神经胶质瘤相关癌基因同源蛋白1(glioma-associatedoncogenehomolog-1,GLI1)、GAPDH一抗和辣根过氧化物酶标记的羊抗兔二抗(批号分别为ab214424、ab308225、ab11939、ab273018、ab181602、ab6721)均购自美国Abcam公司。
1.3 实验动物
本研究所用动物为SPF级SD大鼠,共72只,体重200~250g,雄性,7~8周龄,由湖北贝恩特生物科技有限公司提供[动物生产许可证号为SCXK(鄂)2021-0027]。实验前所有大鼠在温度23~25℃、相对湿度40%~60%的动物房中分笼饲养,自由饮水、摄食,适应性饲养7d后用于实验。本研究的动物实验方案已通过武汉华联科生物技术有限公司动物伦理委员会的审核(伦理号为HLK-20220719)。
2 方法
2.1 大鼠全层皮肤缺损伤口模型的构建
参考文献方法,构建大鼠全层皮肤缺损伤口模型[9―10]。将60只大鼠腹腔注射2%戊巴比妥钠(45mg/kg)麻醉,背部脱毛、消毒,备皮面积为2cm2。大鼠固定后在背部脊柱一侧标记一个圆形切口,切口平行于脊柱,沿标记线切除全层皮肤,深至筋膜层,形成创面。次日,肉眼可见创面少许渗血,且无感染,则表明造模成功。
2.2 动物分组与给药
本研究共造模成功60只大鼠,采用随机数字表法将其分为模型组(即Model组),低、中、高剂量OST组(即OST-L、OST-M、OST-H组,20、30、40mg/kgOST[11])和高剂量OST+SHH抑制剂环巴胺组(即OST-H+环巴胺组,40mg/kgOST+10mg/kg环巴胺[12]),每组12只;另选取12只大鼠为对照组(仅剃除皮肤毛发,不造模)。OST-L组、OST-M组、OST-H组大鼠分别腹腔注射20、30、40mg/kgOST;OST-H+环巴胺组在腹腔注射40mg/kgOST前30min,腹腔注射10mg/kg环巴胺;每天给药1次,给药体积均为10mL/kg,连续14d。Model组和对照组大鼠腹腔注射等量生理盐水。
2.3 大鼠创面愈合率的计算
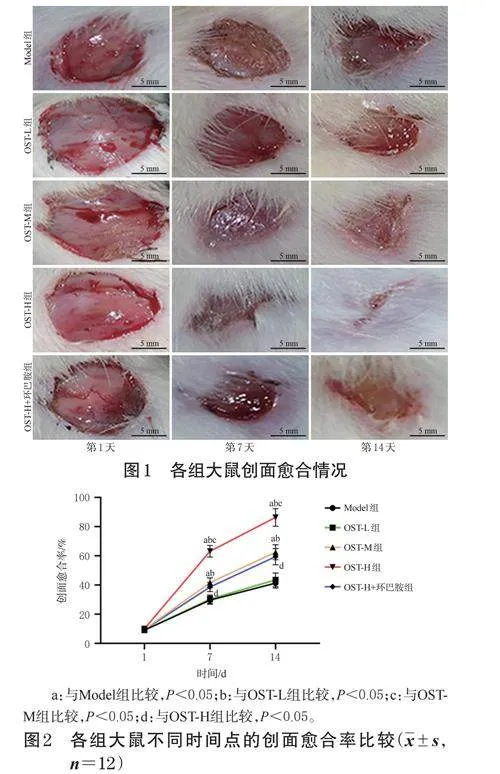
在给药第1、7、14天时观察大鼠创面愈合情况,用游标卡尺测量创面直径,并进行拍照;采用ImageJ软件计算大鼠的创面愈合率,创面愈合率=(用药前创面面积-用药后创面面积)/用药前创面面积×100%。
2.4 大鼠创面组织的病理学形态观察
采用HE染色法观察。末次给药后,所有大鼠脱颈处死,每组随机选取6只大鼠,切除创面组织,固定于多聚甲醛中,组织脱水后制成石蜡切片,一部分切片行HE染色,另一部分备用。取HE染色的切片,于光学显微镜下观察创面组织的病理学变化。
2.5 大鼠创面组织胶原蛋白沉积情况观察
采用Masson染色法观察。取“2.4”项下剩余的创面组织切片,根据Masson染色试剂盒说明书方法进行染色,于光学显微镜下观察创面组织形态并拍照。采用ImageJ软件计算胶原蛋白相对表达量,胶原蛋白相对表达量=(蓝染的胶原纤维面积/视野总面积)×100%。
2.6 大鼠创面组织中Ang-1、bFGF水平检测
采用ELISA法检测。将每组剩余6只大鼠处死,剖取创面组织,一部分置于冰上加入裂解液进行裂解,另一部分冻存于-80℃条件下,待用。将制备的创面组织匀浆,根据ELISA试剂盒说明书方法操作,检测大鼠创面组织中Ang-1、bFGF水平。
2.7 大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量检测
采用RT-qPCR法检测。取“2.6”项下冻存的创面组织适量,用Trizol试剂提取总RNA,并反转录为cDNA进行扩增。扩增体系为:4μLcDNA,25μLSYBRGreenPCRMasterMix,正反向引物对各1μL,ddH2O19μL,总体积为50μL。扩增条件为:聚合酶活化10min,94℃变性15s,55℃退火30s,72℃延伸30s,45次循环。本研究所用引物由生工生物工程(上海)股份有限公司设计合成,序列信息如表1所示。以β-actin为内参,采用2-ΔΔCt法计算VEGFA、VEGFR-2mRNA的相对表达量。
2.8 大鼠创面组织中VEGFA、VEGFR-2、SHH、GLI1蛋白表达检测
采用Westernblot法检测。取“2.6”项下冻存的创面组织适量,用RIPA裂解液提取总蛋白,采用BCA法测定蛋白浓度后,进行变性处理。取变性后的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,以5%牛血清蛋白溶液封闭2h,加入VEGFA、VEGFR-2、SHH、GLI1、GAPDH一抗(稀释比例均为1∶1000)于4℃过夜孵育;加入相应二抗(稀释比例为1∶5000)于室温孵育2h,采用ECL试剂显色,经凝胶成像后,采用ImageJ软件进行分析,以GAPDH为内参进行归一化。
2.9 统计学方法
采用GraphPadPrism7.0软件对数据进行统计分析。实验数据以x±s表示,多组间比较采用单因素方差分析,进一步两两比较行LSD-t检验。检验水准α=0.05。
3 结果
3.1 OST对大鼠创面愈合率的影响
与Model组比较,OST-M组、OST-H组大鼠给药第7天和第14天的创面愈合率均显著升高(P<0.05);与OST-L组比较,OST-M组、OST-H组大鼠给药第7天和第14天的创面愈合率均显著升高(P<0.05),且具有剂量依赖性(P<0.05);与OST-H组比较,OST-H+环巴胺组大鼠给药第7天和第14天的创面愈合率均显著降低(P<0.05)。结果见图1和图2。
3.2 OST对大鼠创面组织病理学变化的影响
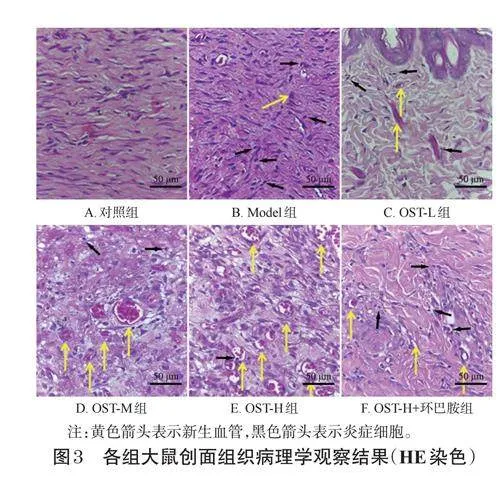
对照组大鼠皮肤组织表皮完整。Model组大鼠创面组织再上皮化不明显,新生血管数较少,肉芽组织出现水肿,炎症细胞浸润严重。与Model组相比,OST-L组、OST-M组、OST-H组大鼠创面组织再上皮化明显,炎症细胞浸润和肉芽组织水肿减轻,新生血管数增多,其中OST-H组大鼠的创面组织损伤明显减轻。与OST-H组相比,OST-H+环巴胺组大鼠创面组织再上皮化不明显,炎症细胞浸润加重,新生血管数减少。结果见图3。
3.3 OST对大鼠创面组织胶原蛋白沉积的影响
对照组大鼠皮肤组织胶原纤维和胶原蛋白含量丰富,排列紧密,胶原蛋白相对表达量为(45.76±2.15)%。与对照组相比,Model组大鼠创面组织的胶原纤维、胶原蛋白沉积减少,胶原蛋白相对表达量[(5.35±0.80)%]显著降低(P<0.05)。与Model组相比,OST-L组、OST-M组和OST-H组大鼠创面组织的胶原纤维、胶原蛋白沉积增多,胶原蛋白相对表达量[(12.06±1.14)%、(20.87±1.59)%、(34.52±2.06)%]均显著升高(P<0.05),且具有剂量依赖性(P<0.05)。与OST-H组相比,OST-H+环巴胺组大鼠创面组织的胶原纤维、胶原蛋白沉积减少,胶原蛋白相对表达量[(8.21±1.05)%]显著降低(P<0.05)。结果见图4。
3.4 OST对大鼠创面组织中Ang-1、bFGF水平的影响
与对照组相比,Model组大鼠创面组织中Ang-1、bFGF水平均显著升高(P<0.05);与Model组相比,OST-M组、OST-H组大鼠创面组织中Ang-1、bFGF水平均显著升高(P<0.05);与OST-L组相比,OST-M组、OST-H组大鼠创面组织中Ang-1、bFGF水平均显著升高(P<0.05),且具有剂量依赖性(P<0.05);与OST-H组相比,OST-H+环巴胺组大鼠创面组织中Ang-1、bFGF水平均显著降低(P<0.05)。结果见图5。
3.5 OST对大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量的影响
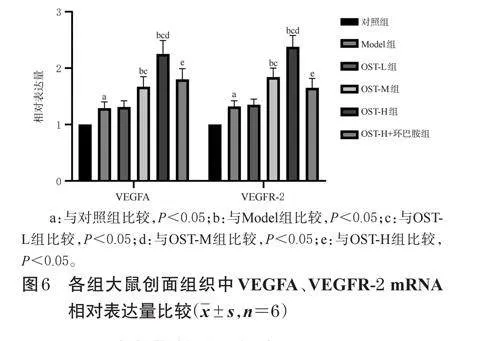
与对照组相比,Model组大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量均显著升高(P<0.05);与Model组相比,OST-M组、OST-H组大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量均显著升高(P<0.05);与OST-L组相比,OST-M组、OST-H组大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量均显著升高(P<0.05),且具有剂量依赖性(P<0.05);与OST-H组相比,OST-H+环巴胺组大鼠创面组织中VEGFA、VEGFR-2mRNA相对表达量均显著降低(P<0.05)。结果见图6。
3.6 OST对大鼠创面组织中VEGFA、VEGFR-2、SHH、GLI1蛋白表达的影响
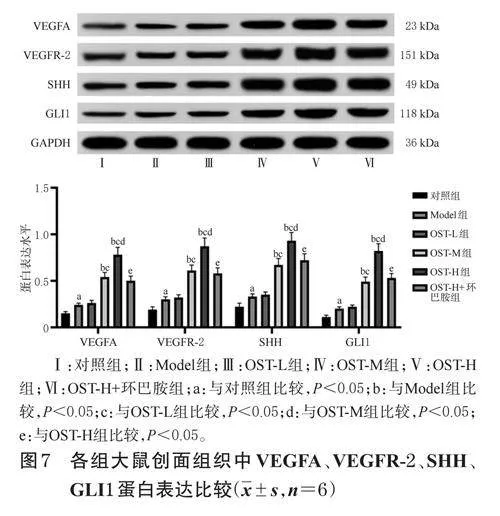
与对照组相比,Model组大鼠创面组织中VEGFA、VEGFR-2、SHH、GLI1蛋白表达水平均显著升高(P<0.05);与Model组相比,OST-M组、OST-H组大鼠创面组织中上述蛋白表达水平均显著升高(P<0.05);与OST-L组相比,OST-M组、OST-H组大鼠创面组织中上述蛋白表达水平均显著升高(P<0.05),且具有剂量依赖性(P<0.05);与OST-H组相比,OST-H+环巴胺组大鼠创面组织中上述蛋白表达水平均显著降低(P<0.05)。结果见图7。
4 讨论
临床研究发现,皮肤创面愈合需要经过凝血期、炎症期、增殖期和重塑期:在创面形成初期,毛细血管内血液流入创面,形成凝血块覆盖在创面表层;在炎症期,巨噬细胞、中性粒细胞在创面聚集并吞噬病原体,同时伴随大量肉芽组织形成,成纤维细胞逐渐迁移,胶原蛋白沉积增多[13]。血管网形成和血管再生在创面愈合中非常关键,新生血管为创面组织细胞提供氧气和营养;Ang-1、VEGFA是血管生成的重要调节因子,能够促进血管内皮细胞增殖和血管生成,其中VEGFA可参与芽生血管形成[14]。bFGF是从脑组织与垂体抽提物中发现的具有促进成纤维细胞生长的因子,同时还可增强血管内皮生长因子的分泌,促进内皮细胞与成纤维细胞的增殖,从而促进血管新生和修复[15]。VEGFR-2是生长因子受体,具有促进表皮细胞生长和分化的作用[16]。
OST是蛇床子的活性成分,Kordulewska等[5]研究发现其在皮肤创面愈合过程中具有潜在作用:在组胺诱导的人角质形成细胞和成纤维细胞炎症过程中,OST降低了白细胞介素1β、肿瘤坏死因子α水平,改善了细胞迁移和细胞屏障功能。本研究结果显示,Model组大鼠创面新生血管数较少,肉芽组织出现水肿,炎症细胞浸润严重;创面组织的胶原纤维、胶原蛋白沉积减少;创面组织中Ang-1、bFGF水平和VEGFA、VEGFR-2mRNA及蛋白表达水平均升高,与李学锋[17]的研究一致,说明大鼠皮肤遭受创伤后自体修复机制被激活。经OST干预后,大鼠皮肤创面愈合率和创面组织中Ang-1、bFGF水平以及VEGFA、VEGFR-2mRNA和蛋白表达水平均进一步升高。这说明OST可通过上调血管生成相关因子水平,促进大鼠创面愈合和血管生成,从而加快机体对创面损伤的修复作用。有报道显示,OST具有抑制原发性肝癌、鼻咽癌等肿瘤血管生成的作用[6,18];此外,OST虽然不能直接促进人脐静脉内皮细胞的血管生成,但具有诱导骨髓间充质干细胞成骨-血管生成耦合的能力[19]。这与本研究中OST促进创面血管生成的结果不相符,推测导致其发挥不同作用的原因可能与药物的作用效果受到其所处的生理或病理环境的影响有关[6,18―19]。
SHH信号通路在血管生成过程中发挥着重要作用,其通过调控下游分子GLI1影响血管生成[8]。朱美霖等[20]研究发现,在急性脑缺血大鼠中,SHH信号通路激活剂Purmorphamine可以激活缺血半暗带中SHH信号通路并促进血管新生,而环巴胺可以通过抑制SHH信号通路来抑制血管新生。孙浩等[21]研究发现,实验室自制的毛囊再生乳膏能够通过调控毛囊生长发育过程中的Wnt信号通路和SHH信号通路促进创面愈合时的毛囊再生。既往研究显示,正常小鼠皮肤损伤后,SHH蛋白表达升高,说明皮肤受损会刺激SHH信号通路活化[22]。本研究结果显示,经OST干预后,大鼠创面组织中SHH、GLI1蛋白表达水平相比对照组升高。进一步使用SHH抑制剂环巴胺干预后发现,大鼠创面组织中SHH、GLI1蛋白表达水平降低,这说明环巴胺减弱了OST的作用效果,提示OST可能通过激活SHH信号通路促进大鼠皮肤血管生成和创面愈合。
综上所述,OST可促进大鼠皮肤创面愈合和血管生成,其机制可能与激活SHH信号通路有关。但本研究仍有一些不足,如未设置单独的SHH信号通路激活剂组、缺少相关体外细胞水平的研究、机制不够全面等,还需进一步探究。此外,OST促进大鼠创面愈合的最佳给药剂量和给药途径(全身给药或局部皮肤给药)仍需深入分析。
