胃癌药物治疗专家共识
2025-02-15重庆市医学会肿瘤学分会化疗学组,重庆市医药生物技术协会肿瘤罕见病疑难病专委会


关键词胃癌;抗肿瘤药物;化疗;免疫治疗;靶向治疗;手术;专家共识
胃癌(gastriccancer,GC)是全世界发病率较高的肿瘤之一,患者的5年生存率仅约20%[1]。我国胃癌的发病人数和病死人数均居世界首位,分别约占43.9%和48.6%[2]。据2019-2021年中国肿瘤生存数据统计,我国胃癌5年标化相对生存率为35.2%[3]。靶向、免疫治疗等新型治疗模式的出现,一定程度上改善了患者的预后。但由于胃癌异质性强、生物学行为差、整体预后不良,因此,规范化药物治疗具有十分重要的作用。为提高医务人员对胃癌的规范化用药,为临床医师提供指导性用药参考,进而延长患者生存时间,改善患者生存质量,经临床专家编写和审定,最终形成《胃癌药物治疗专家共识》(以下简称共识)。
1 共识制定方法
本共识由重庆市医学会肿瘤学分会化疗学组和重庆市医药生物技术协会肿瘤罕见病疑难病专委会共同发起,由重庆大学附属肿瘤医院肿瘤内科作为牵头单位,组织重庆市内49家医院的73名临床专家编写和审定。所有参编专家均具有10年以上肿瘤专科工作经历,其中高级职称占比86.3%,博士占比67.8%。
本共识采用名义群体法,由重庆大学附属肿瘤医院肿瘤内科专家组成员共同讨论确定编写大纲。编写组专家针对大纲涉及内容进行系统检索,参考文献通过PubMed、WebofScience、Embase、CochraneLibrary、中国知网、万方数据库等数据库及国际会议途径获取,检索时间为建库至2024年5月14日。通过对文献进行分析、归纳及总结,并根据我国现状、临床需求和研究证据初步拟定推荐建议。编写及审定专家采用线上和线下相结合的会议形式经过多轮讨论,对推荐建议进行修订,以投票形式确定最终共识内容和推荐等级。本共识推荐等级分级标准见表1。
2 共识内容
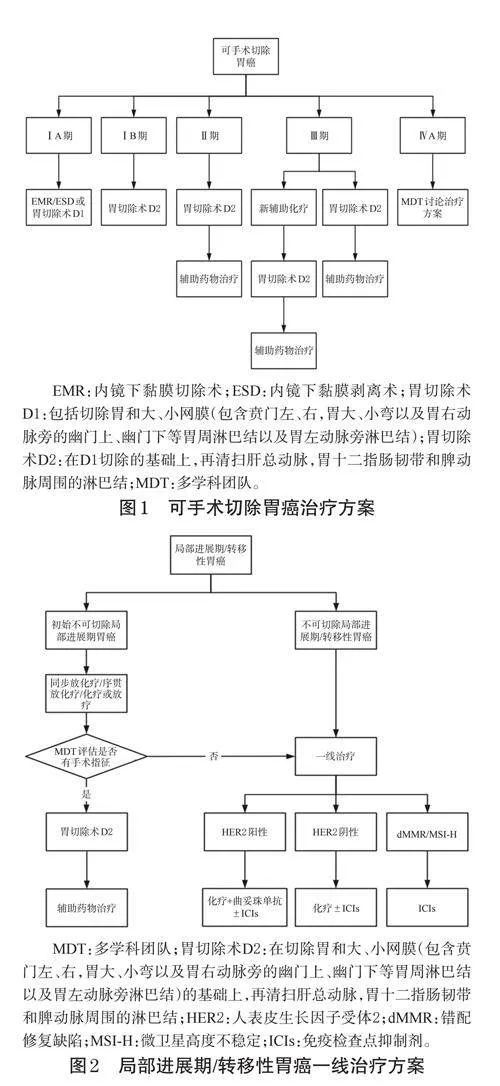
本共识内容包括胃癌的围手术期药物治疗、晚期转移性胃癌一线药物治疗、晚期转移性胃癌二线药物治疗、晚期胃癌三线及三线以上药物治疗、胃癌腹膜转移的药物治疗等部分组成。本共识中的肿瘤分期参考国际胃癌研究协会第8版TNM分期,共识内容所涉及的胃癌部位不包括胃食管结合部(gastroesophagealjunction,GEJ)。胃癌治疗流程图见图1~图4。
2.1 围手术期药物治疗
2.1.1 围手术期新辅助药物治疗
胃癌围手术期新辅助药物治疗是为了使肿瘤缩小、降低肿瘤分期、提高胃癌根治率、延长患者生存时间、提高患者的生存质量。韩国的PRODIGY研究是一项Ⅲ期临床研究,纳入了Ⅱ~ⅢC期的胃癌患者,使用多西他赛+奥沙利铂+替吉奥(DOS)作为新辅助化疗对比单药替吉奥(S-1)辅助化疗,结果显示DOS新辅助化疗提升了患者的3年无进展生存(progression-freesurvival,PFS)率,但其中亚组分析发现Ⅱ期患者获益不显著[4]。我国Ⅲ期临床研究RESOLVE纳入cT4aN+M0或cT4bNxM0胃癌患者,结果显示与卡培他滨+奥沙利铂(XELOX)相比,使用新辅助S-1+奥沙利铂(SOX)化疗的患者有更高的3年无疾病生存(disease-freesurvival,DFS)率(62.2%vs.54.7%,P=0.045)和5年总生存(overallsurvival,OS)率(60.0%vs.52.1%,P=0.049)[5]。MATCH研究对比了DOS和SOX用于新辅助治疗,结果表明DOS方案化疗提高了胃癌患者的主要病理缓解(majorpathologicresponse,MPR)率(25.4%vs.11.8%,P=0.035)、R0切除率(78.9%vs.61.8%,P=0.024),但3年PFS率(52.3%vs.35.0%,P=0.065)和3年OS率(57.5%vs.49.2%,P=0.114)差异无统计学意义[6]。FLOT4-AIO研究报道了多西他赛+奥沙利铂+氟尿嘧啶+亚叶酸钙(FLOT)对比表柔比星+顺铂+氟尿嘧啶(ECF)/希罗达(ECX)用于新辅助治疗,结果表明前者提高了9%的5年OS率,中位生存期(mOS)延长了15个月[7]。对于仅有腹腔游离癌细胞学阳性(CY1P0)的患者,一项系统性综述结果显示经新辅助治疗后细胞学转阴的患者OS得到改善(HR=0.64,P<0.0001)。一项Meta分析结果显示腹腔化疗联合手术对比单纯手术,可提高CY1P0患者的5年生存率[8]。而对于肉眼可见的腹膜转移患者(P1),化疗很难消灭所有的微转移灶[9]。因此,若无明显化疗禁忌,除P1的Ⅲ期患者均应考虑行新辅助化疗。
ICIs联合治疗在新辅助治疗中显现出一定的应用前景。KEYNOTE-585研究对比了帕博利珠单抗联合化疗与安慰剂联合化疗,结果显示ICIs联合化疗显著地提高了患者的病理完全缓解(pathologicalcompleteremission,pCR)率(P<0.05),也可改善患者的无事件生存期(event-freesurvival,EFS),但差异无统计学意义[10]。MATTERHORN研究证实与安慰剂相比,度伐利尤单抗联合FLOT方案新辅助治疗可显著改善患者的pCR率(19%vs.7%,P<0.00001),且提高了达到pT0期和pN0期的患者比例,但目前EFS数据尚未公布[11]。DRAGONIV/AHEAD-G208研究显示,阿帕替尼、卡瑞利珠单抗联合SOX化疗较单纯化疗组pCR率显著得到了提升(18.3%vs.5.0%,P<0.0001),且在所有亚组中均有获益[12]。
此外,对于dMMR/MSI-H的局部进展期可切除胃癌患者,GERCORNEONIPIGA研究使用纳武利尤单抗联合伊匹木单抗作为新辅助治疗方案,pCR率达到58.6%[13]。INFINITY研究中,MSI-H的可切除胃癌患者使用曲美木单抗联合度伐利尤单抗作为新辅助治疗方案,pCR率为60%、MPR率为80%[14]。DANTE研究纳入了可手术的胃癌患者,使用阿替利珠单抗联合FLOT化疗作为新辅助治疗方案,MSI-H亚组患者的pCR率为63%[15]。因此,对于dMMR/MSI-H的可切除胃癌患者,目前多个Ⅰ~Ⅱ期研究结果初步显示了免疫治疗作为新辅助治疗的有效性。
共识意见1(专家推荐率:93.2%;推荐等级:2级):无手术禁忌的Ⅱ期胃癌患者建议直接手术,不推荐进行新辅助治疗;Ⅲ期患者(P1除外)应考虑行新辅助化疗,方案可选择DOS、SOX、FLOT、XELOX、氟尿嘧啶+亚叶酸钙+奥沙利铂(FOLFOX),也可考虑参加免疫联合新辅助治疗的临床研究;对于CY1P0的腹膜转移患者可考虑联合腹腔灌注化疗;对于dMMR/MSI-H可切除的局部进展期胃癌患者,新辅助治疗推荐免疫联合治疗。
2.1.2 围手术期术后辅助药物治疗
胃癌围手术期术后辅助治疗的目的是通过消灭残留癌细胞来降低术后复发率、延长患者的生存时间。2006年,ACTS-GC试验证实胃癌D2根治术后Ⅱ期或Ⅲ期患者S-1单药辅助化疗3年OS率为80.1%,而未行术后辅助化疗的3年OS率仅为70.1%,使S-1单药在日本成为胃癌辅助化疗的标准方案[16]。2012年,韩国CLASSIC试验结果显示,XELOX方案术后辅助化疗6个月可延长Ⅱ/Ⅲ期胃癌患者的无复发生存期(recurrence-freesurvival,RFS)[17]。我国的Ⅲ期RESOLVE研究显示,对于cT4aN+M0或者cT4bNanyM0胃癌患者,D2根治术后接受8个周期XELOX或SOX辅助化疗患者的3年DFS率分别为51.1%和56.5%,但两组患者差异无统计学意义,其5年OS率及DFS率差异也无统计学意义[5]。
JACCROGC-07研究是一项对比Ⅲ期胃癌患者R0切除术后给予S-1单药治疗1年和S-1+多西他赛治疗的Ⅲ期临床试验。其结果表明,术后给予S-1口服1年+多西他赛治疗7个周期可改善患者的3年RFS率(65.9%vs.49.5%,P<0.001)[18]。因此,推荐S-1+多西他赛双药方案作为Ⅲ期胃癌患者术后辅助化疗方案之一,S-1单药方案可作为某些患者希望避免发生多西他赛相关不良事件(例如脱发)的推荐方案。Ⅲ期试验ARTIST2的结果显示,对于D2根治术后pⅡ/Ⅲ期胃癌患者,与S-1单药持续1年比较,术后辅助化疗使用SOX方案6个月可显著延长患者的DFS(HR=0.692,P=0.042)[19]。因此,对于pⅡ/Ⅲ期胃癌患者根治术后推荐使用包含S-1单药或联合方案进行辅助化疗,对pⅢ期患者优先推荐S-1联合方案治疗。
ATTRACTION-5研究证实胃癌D2根治术或更广泛的淋巴结清扫后的Ⅲ期胃癌患者行辅助纳武利尤单抗+化疗与安慰剂+化疗的3年RFS率分别为68.4%和65.3%,无复发生存的风险比为0.90(P=0.44);但在亚组分析中细胞程序性死亡-配体1(programmedcelldeathligand1,PD-L1)肿瘤细胞阳性比例分数(tumorproportionscore,TPS)≥1%的患者能够在纳武利尤单抗+化疗中显著获益(HR=0.33)[20]。因此,对于PD-L1表达阳性的患者,PD-1单抗联合治疗对降低复发风险具有重要临床意义。
专家共识2(专家推荐率:94.5%;推荐等级:2级):辅助化疗适用于胃癌D2根治术后病理分期为Ⅱ期及Ⅲ~ⅣA期的患者;Ⅱ期患者推荐S-1单药辅助化疗,或两药联合方案辅助化疗;Ⅲ~ⅣA期胃癌患者推荐SOX、S-1+多西他赛、氟尿嘧啶类药物+铂类等两药联合方案;两药联合治疗推荐时限为6个月,单药化疗推荐时限为1年;对于PD-L1表达阳性的Ⅲ期患者,术后可考虑免疫联合化疗。
2.1.3 新辅助+辅助药物治疗
新近研究表明,与单纯新辅助或者辅助治疗相比,新辅助治疗+辅助治疗胃癌能提高手术R0切除率,改善术后生存时间,且不增加安全方面的风险。RESOLVE研究旨在比较D2根治术后使用XELOX或SOX方案与围手术期使用SOX方案的疗效和安全性[5]。该研究2023年公布的5年随访结果显示,对于cT4aN+M0或T4bN0M0局部进展期胃癌患者,与XELOX方案辅助治疗相比,围手术期的新辅助+辅助治疗方案(3个周期SOX新辅助化疗+5个周期SOX方案辅助化疗+3个周期S-1单药维持治疗)可改善患者5年OS率(60.0%vs.52.1%,P=0.049),显著降低21%的死亡风险。基于此,围手术期SOX方案序贯S-1单药维持治疗可作为局部进展期胃癌患者的新选择。另外,同期报道的PRODIGY研究显示,对于cT2~3N+M0或T4NanyM0的局部进展期胃癌,与S-1单药辅助化疗相比,术前3个周期DOS新辅助化疗加上术后8个周期S-1单药可将PFS提高29%,5年PFS率分别为60.6%和56%,8年PFS率分别为55.8%和43.2%[4]。
专家共识3(专家推荐率:86.3%;推荐等级:2级):对于cT4aN+M0或T4bN0M0局部进展期胃癌患者,可推荐围手术期SOX方案序贯S-1单药维持治疗;对于cT2~3N+M0或T4NanyM0的局部进展期胃癌患者,可推荐术前3个周期DOS方案新辅助化疗加术后8个周期S-1单药化疗。
2.2 晚期转移性胃癌一线药物治疗
晚期转移性胃癌的一线治疗,需根据患者的HER2、MMR/MSI状态、PD-L1、紧密连接蛋白18.2(Claudin18.2,CLDN18.2)等表达情况选择相应的全身药物治疗;根据病情可选择联合姑息性手术、放疗、介入等局部或者营养治疗等来获得更好的生存期和生存质量。
2.2.1 HER2阳性患者
HER2阳性指免疫组织化学(immunohistochemistry,IHC)3+或者IHC2+且免疫荧光原位杂交检测HER2扩增阳性。KEYNOTE-811研究结果提示,对于PD-L1联合阳性分数(combinedpositivescore,CPS)≥1(以下简称为PD-L1CPS)的HER2阳性胃癌患者,帕博利珠单抗+曲妥珠单抗+化疗[奥沙利铂/顺铂+5-氟尿嘧啶(5-fluorouracil,5-FU)/卡培他滨]的疗效优于曲妥珠单抗+化疗,能延长mPFS(10.9个月vs.7.3个月,HR=0.71)和mOS(20.0个月vs.15.7个月,HR=0.81);而对于PD-L1CPS<1的患者,该方案则无获益[21]。ToGA研究结果显示,对初治HER2阳性的晚期转移性胃腺癌患者,曲妥珠单抗+5-FU/卡培他滨+顺铂较单纯化疗显著增加了生存获益(mOS:13.8个月vs.11.1个月,P=0.00046)[22]。EVIDENCE研究提示,对于HER2阳性转移性胃癌患者,曲妥珠单抗联合化疗方案[XELOX、顺铂+氟尿嘧啶(PF)、顺铂+卡培他滨、多西他赛/紫杉醇+铂类+氟尿嘧啶类]中,曲妥珠单抗与XELOX方案的联合应用疗效最佳,mOS达34.6个月[23]。
专家共识4(专家推荐率:91.8%;推荐等级:2级):HER2阳性的晚期胃癌的一线治疗,PD-L1CPS≥1时,推荐帕博利珠单抗+曲妥珠单抗+奥沙利铂/顺铂+5-FU/卡培他滨方案;PD-L1CPS<1时,推荐曲妥珠单抗+奥沙利铂/顺铂+5-FU/卡培他滨方案。
2.2.2 HER2阴性患者
(1)对于PD-L1CPS≥5或肿瘤区域阳性(tumorareapositivity,TAP)评分≥5%的患者,GEMSTONE-303、CheckMate-649、ORIENT-16等多项临床研究结果证实给予化疗联合免疫治疗,可以提高患者的mPFS和mOS。2023年欧洲肿瘤内科学会(EuropeanSocietyforMedicalOncology,ESMO)公布的GEMSTONE-303研究结果提示,舒格利单抗+XELOX可显著改善患者的mPFS(7.62个月vs.6.08个月,P<0.0001)和mOS(15.64个月vs.12.65个月,P=0.0060),且PD-L1CPS评分越高的患者获益越明显。CheckMate-649研究结果显示,在PD-L1CPS≥5的亚组分析中,FOLFOX/XELOX方案联合纳武利尤单抗较单纯化疗延长了患者的mPFS(7.7个月vs.6.05个月,P<0.0001)和mOS(14.4个月vs.11.1个月,P<0.0001)[24]。ORIENT-16研究表明,对于PD-L1CPS≥5的患者,XELOX+信迪利单抗对比单纯化疗显著延长了其mPFS(7.7个月vs.5.8个月,P=0.0002)和mOS(18.4个月vs.12.9个月,P=0.0023),将客观缓解率(objectiveresponserate,ORR)从48.4%提高至58.2%;对于PD-L1CPS≥10的患者,也可选择XELOX/PF联合帕博利珠单抗治疗[25]。KEYNOTE-859研究结果显示,XELOX/PF联合帕博利珠单抗组的mOS比化疗联合安慰剂组更长(12.9个月vs.11.5个月,P<0.0001),其中PD-L1CPS≥10的患者OS获益更为显著(15.7个月vs.11.8个月,P<0.0001)[26]。RATIONALE-305研究结果显示,替雷利珠单抗+XELOX/PF对比单纯化疗显著延长了PD-L1TAP评分≥5%的患者的mPFS(7.2个月vs.5.9个月,P<0.001)和mOS(17.2个月vs.12.6个月,P=0.006),且在各亚组中使用替雷利珠单抗联合化疗均能获益[27]。
(2)PD-L1CPS<5或不能检出的患者,免疫联合化疗未显示出治疗优势。CheckMate-649研究结果显示,PD-L1CPS<5的亚组中,纳武利尤单抗联合化疗对比单纯化疗没有为患者带来生存获益(mOS:HR=0.950,mPFS:HR=0.95)[24]。ORIENT-16研究结果显示,在PDL1CPS<5的亚组中,信迪利单抗联合化疗组的mOS为11.7个月,而单纯化疗组为12.0个月[25]。因此,针对PDL1CPS<5或不能检出的患者,建议选择以化疗为主的治疗方案。一线化疗方案通常选择奥沙利铂/顺铂+5-FU或者紫杉醇+5-FU;多西他赛+顺铂+5-FU(DCF/mDCF)三药联合方案只适合于体能状况好且肿瘤负荷较大的患者;体能状况较差的患者可选择氟尿嘧啶或紫杉醇类单药方案[28]。GO2研究结果显示,减量的XELOX方案疗效不劣于标准剂量组,且不良反应发生率较低,为70岁以上老年体弱的胃癌患者提供了减量化疗的依据[29]。
(3)对于CLDN18.2阳性且HER2阴性的患者,SPOTLIGHT研究显示,佐妥昔单抗联合氟尿嘧啶+亚叶酸钙+奥沙利铂(mFOLFOX6)与单纯化疗相比能为患者带来生存获益(mPFS:10.61个月vs.8.67个月,P=0.0066;mOS:18.23个月vs.15.54个月,P=0.0053)[30]。GLOW研究[31]结果显示,佐妥昔单抗联合XELOX组的mPFS及mOS显著高于单纯化疗组(mPFS:8.21个月vs.6.80个月,P=0.0007;mOS:14.39个月vs.12.16个月,P=0.0118)[31]。但佐妥昔单抗在我国暂未获批上市,且CLDN18.2表达通过免疫组化检测,目前尚无统一的阳性判读标准,故推荐CLDN18.2阳性且HER2阴性的患者可参加相关临床研究治疗。
专家共识5(专家推荐率:100%;推荐等级:1级):HER2阴性晚期胃癌的一线治疗,PD-L1CPS≥5或TAP评分≥5%时,推荐XELOX或PF方案化疗联合ICIs;PD-L1CPS<5、TAP评分<5%或不能检出的患者,推荐以化疗为主的治疗方案。
2.2.3 dMMR/MSI-H患者
dMMR/MSI-H胃癌约占晚期胃癌的6%[32]。KEYNOTE-062Ⅲ期研究结果显示,在MSI-H/PD-L1CPS≥1胃癌亚组的50例患者中,接受帕博利珠单抗组mOS未达到,而化疗组mOS为8.5个月,提示免疫单药疗效优于单纯化疗,长期生存获益明显[33]。CheckMate-649Ⅲ期研究结果提示,在MSI-H亚组中,纳武利尤单抗联合化疗对比单纯化疗可改善患者的mOS(38.7个月vs.12.3个月,HR=0.34)[24]。NOLIMIT研究为一项Ⅱ期研究,评价了纳武利尤单抗联合低剂量伊匹木单抗作为MSI-H晚期胃腺癌或GEJ腺癌一线治疗的疗效,纳入了29例患者,ORR为62.1%,疾病控制率(diseasecontrolrate,DCR)达到79.3%,mPFS为13.8个月,mOS未达到[34]。
专家共识6(专家推荐率:84.9%;推荐等级:2级):对于dMMR/MSI-H晚期胃癌患者,推荐帕博利珠单抗单药或纳武利尤单抗联合化疗/伊匹木单抗治疗。
2.3 晚期转移性胃癌二线药物治疗
德国肿瘤内科学会开展的一项Ⅲ期临床试验评估了伊立替康作为晚期胃癌患者二线治疗方案的疗效[35]。该研究结果表明,与最佳对症支持治疗相比,伊立替康延长了患者mOS(4.0个月vs.2.4个月,P=0.012)。此外,COUGAR-02研究证实了多西他赛在延长晚期胃癌患者二线治疗后的mOS方面的优越性(5.2个月vs.3.6个月,P=0.01)[36]。在WJOG4007G的Ⅲ期研究中,紫杉类药物与伊立替康在晚期胃癌二线治疗的疗效对比中显示出相当的疗效(mPFS:3.6个月vs.2.3个月,P=0.33;mOS:9.5个月vs.8.4个月,P=0.38)[37]。BIRIP研究是一项Ⅲ期临床试验,旨在评估伊立替康联合顺铂与伊立替康单药治疗在一线治疗失败后的晚期胃癌患者中的疗效[38]。该研究结果显示,联合治疗方案在提高患者的mPFS方面优于单药治疗(3.8个月vs.2.8个月,P=0.0398),然而,mOS在两组间的差异无统计学意义(10.7个月vs.10.1个月,P=0.9823)。
在REGARDⅢ期临床试验中,研究者对雷莫西尤单抗作为晚期胃腺癌或GEJ腺癌患者的二线治疗方案进行了评估。结果显示,与安慰剂相比,雷莫西尤单抗能显著延长患者的mOS(5.2个月vs.3.8个月,P=0.0473)[39]。RAINBOW研究是一项全球多中心的Ⅲ期研究,探讨了雷莫西尤单抗与紫杉醇联合治疗方案在治疗对铂类和氟尿嘧啶类药物一线治疗无效的转移性或局部晚期胃腺癌及GEJ腺癌患者中的疗效[40]。该研究结果显示,与单独使用紫杉醇相比,雷莫西尤单抗的加入显著提升了患者的mPFS(4.4个月vs.2.9个月,P<0.0001)和mOS(9.63个月vs.7.36个月,P=0.0169)。同时,RAINBOW-AsiaⅢ期研究中90%的患者来自我国,结果显示雷莫西尤单抗联合紫杉醇较紫杉醇单药显著延长患者的mPFS[41]。该项研究的结果与RAINBOW研究相一致,显示出显著的生存获益和良好的耐受性。
FRUTIGAⅢ期研究旨在评价呋喹替尼联合紫杉醇对比安慰剂联合紫杉醇在接受含氟尿嘧啶或铂类一线化疗后失败的晚期胃腺癌或GEJ腺癌患者中的疗效以及患者的安全性[42]。结果显示呋喹替尼联合紫杉醇显著提高了患者的mPFS(5.55个月vs.2.73个月,P<0.0001)和mOS(9.56个月vs.7.85个月,P=0.0233)。
NCT03903705是一项旨在评估呋喹替尼与信迪利单抗联合疗法在初治或经治的晚期胃腺癌及GEJ腺癌患者中疗效的临床研究[43]。该研究结果显示,该联合疗法的ORR达到了72.2%、DCR达到了100%,中位缓解持续时间(mediandurationofresponse,mDoR)为10.3个月、mPFS为11.0个月。
对于HER2阳性的晚期胃癌患者的二线治疗,JFMC45-1102Ⅱ期临床试验结果显示,在既往治疗失败且未曾接受过曲妥珠单抗治疗的患者群体中,曲妥珠单抗与紫杉醇联合疗法的mOS达到了17.1个月,而mPFS为5.1个月,ORR为37%[44]。DESTINY-Gastric02Ⅱ期研究评价了德曲妥珠单抗(trastuzumabderuxtecan)治疗HER2阳性且经一线含曲妥珠单抗方案治疗失败的胃癌患者的疗效,结果显示该治疗方案的ORR为41.8%,mPFS为5.6个月[45]。
一项Ⅱ期前瞻性、多中心临床试验对恩沃利单抗在标准治疗方案无效的dMMR/MSI-H晚期实体瘤患者中的疗效进行了评估,共纳入18例二线及以上胃癌患者,结果显示ORR为55.6%,12个月的OS率为83.3%[46]。RATIONALE209研究纳入了74例标准治疗失败的MSI-H/dMMR晚期恶性肿瘤患者,结果显示接受替雷利珠单抗治疗的患者群体ORR达到34.9%,其中8例胃癌患者有1例达到完全缓解(completeremission,CR)和4例达到部分缓解(partialremission,PR)[47]。另一项前瞻性临床研究则纳入了68例对标准治疗无效的MSI-H/dMMR晚期恶性肿瘤患者予以斯鲁利单抗治疗,结果显示ORR为39.7%,12个月的DoR率达到了92.1%、OS率达到了74.5%[48];其中3例接受过二线治疗的胃癌受试者中位随访时间为7.16个月,1例达到PR。
专家共识7(专家推荐率:87.7%;推荐等级:2级):晚期胃癌患者二线治疗,推荐紫杉醇联合雷莫西尤单抗/呋喹替尼,亦可选择呋喹替尼联合信迪利单抗或紫杉类/伊立替康单药治疗;对于HER2阳性的晚期胃癌患者,如之前未接受过曲妥珠单抗治疗,可考虑曲妥珠单抗与紫杉醇的联合疗法;经一线含曲妥珠单抗方案治疗失败的胃癌患者可考虑德曲妥珠单抗治疗。对于dMMR/MSIH的晚期胃癌患者,如既往未接受过PD-1或PD-L1抑制剂治疗,可推荐使用恩沃利单抗、替雷利珠单抗或斯鲁利单抗。
2.4 晚期胃癌三线及三线以上药物治疗
晚期胃癌进展迅速、预后差,三线治疗选择有限,后线治疗以靶向治疗、免疫治疗、单药化疗或者最佳支持治疗为主。
一项Ⅱ期研究C008纳入125例二线及以上标准治疗失败的HER2IHC2+/3+晚期胃癌患者,研究结果提示维迪西妥单抗组的ORR为24.8%,中位OS达到7.9个月[49]。另一项Ⅲ期临床研究显示甲磺酸阿帕替尼较安慰剂组在三线治疗中显著延长了晚期胃癌患者的mPFS(2.6个月vs.1.8个月,P<0.001)及mOS(6.5个月vs.4.7个月,P=0.015)[50]。DESTINY-Gastric01是一项研究德曲妥珠单抗用于经二线及以上治疗失败的HER2阳性晚期胃癌或GEJ腺癌患者的Ⅱ期试验,共纳入187例患者,主要为韩国和日本人群,结果显示德曲妥珠单抗组较化疗组的ORR(51.3%vs.14.3%,P<0.0001)和mPFS(5.6个月vs.3.5个月,P=0.0003)显著提升[51]。该项研究结果初次验证了德曲妥珠单抗在晚期胃癌后线治疗中获益。另一项在我国开展的单臂Ⅱ期临床试验DESTINYGastric06评价了德曲妥珠单抗在既往二线治疗进展的HER2阳性局部晚期或转移性胃癌或GEJ腺癌的安全性和疗效,结果显示HER2阳性胃癌或GEJ腺癌患者的mDoR、mPFS和mOS分别为7.9个月、5.7个月和10.2个月,提示德曲妥珠单抗在我国人群中同样可以延长晚期胃癌患者的生存时间,且安全性良好[52]。最新的一项Ⅰ期研究共纳入113例经二线及以上治疗失败的CLDN18.2阳性晚期胃或GEJ癌患者,结果显示抗体药物偶联物(antibody-drugconjugate,ADC)药物CMG901治疗后总体ORR为33%,DCR为70%,同时安全性可耐受[53]。
在胃癌三线治疗中,免疫检查点抑制剂的应用也有前瞻性研究结果支持,其中,ATTRACTION-2研究结果显示,相较于安慰剂,纳武利尤单抗能延长胃癌患者的mOS(5.26个月vs.4.14个月,P<0.0001)[54]。
TAGSⅢ期研究评价了曲氟尿苷替匹嘧啶(trifluridineandtipiracilhydrochloride,TAS-102)用于经治二线及以上治疗失败的复发或转移性胃癌和GEJ腺癌的疗效,研究结果显示,TAS-102相较安慰剂延长了患者的mOS(5.7个月vs.3.6个月,P=0.0003)和mPFS(2.0个月vs.1.7个月,P<0.0001)[55]。
专家共识8(专家推荐率:83.6%;推荐等级:2级):晚期胃癌三线治疗根据患者体能状况评分和既往用药来综合确定,靶向治疗可选择阿帕替尼,HER2阳性患者也可选择维迪西妥单抗、德曲妥珠单抗;既往未经免疫治疗的患者推荐纳武利尤单抗单药治疗;化疗可选择TAS-102。
2.5 胃癌腹膜转移的药物治疗
胃癌腹膜转移目前的标准治疗方案是全身化疗[56]。研究已证实采用全身化疗效果明显优于最佳支持疗法,且氟尿嘧啶类联合铂类的两药化疗方案比单药化疗效果更为显著,副作用也小于三药治疗方案[57]。Ⅲ期随机对照SPIRITS研究亚组分析显示,一线使用替吉奥联合顺铂方案(SP)与替吉奥单药相比,显著延长了晚期胃癌患者mOS(13.0个月vs.11.0个月,P=0.04);亚组结果显示,SP方案对腹膜转移的患者疗效更好(HR=0.52,P=0.02)[58]。一项Ⅲ期G-SOX临床试验对SOX方案和SP方案的疗效及安全性进行了对比探究,分组研究结果表明对于有腹膜转移的患者,SOX治疗方案表现出更佳的疗效(P=0.032),同时也显示出较高的安全性[59]。RATIONALE-305研究显示,替雷利珠单抗联合化疗显著延长了PD-L1阳性(TAP评分≥5%)局部晚期不可切除或转移性胃癌患者的mOS(17.2个月vs.12.6个月,HR=0.74,P=0.006);亚组分析显示对于腹膜转移的患者,替雷利珠单抗联合化疗组的总生存期均优于单纯化疗组(HR=0.80)[27]。这为晚期胃癌腹膜转移患者的全身治疗提供了新的选择。
腹腔化疗是治疗胃癌腹膜转移的关键策略,包括术前腹腔化疗(intraperitonealchemotherapy,IPC)以及术中广泛腹腔灌洗(extensiveintraoperativeperitoneallavage,EIPL)。一项Meta分析表明,手术联合IPC治疗较单纯手术可有效提高5年生存率(RR=3.10)、降低复发风险(OR=0.45),而在IPC联合EIPL治疗方案中,获益进一步增加(RR=6.19,OR=0.13)[60]。日本PHOENIX-GC研究比较了胃癌腹膜转移患者的一线治疗,该研究分为SP全身化疗组和替吉奥+紫杉醇全身化疗联合紫杉醇腹腔灌注(IP)组,结果IP组未能显示总体人群的生存获益(mOS:17.7个月vs.15.2个月,P=0.08);但是将腹水因素进行校正后发现,IP组生存获益显著(mOS:17.7个月vs.14.3个月,P=0.022),且IP组的腹腔游离癌细胞(freecancercell,FCC)转阴的比例明显高于SP组(76%vs.33%)[61]。紫杉醇分子量大,属于脂溶性药品,通过淋巴系统吸收较为缓慢,治疗后腹腔不易出现粘连,因此该药可实现多次腹腔内给药,是较理想的腹腔内化疗药物。目前国内外众多的研究结果也证实,5-FU、顺铂、紫杉醇、多西他赛以及奥沙利铂对于胃癌恶性腹腔积液有一定疗效[62―66]。腹腔灌注化疗可以联合应用贝伐珠单抗[67]和溶瘤病毒[68―69]、铜绿假单胞菌、红色诺卡氏菌细胞壁骨架[70]等生物制剂增加疗效。综上,推荐腹腔灌注治疗作为全身系统化疗的补充治疗方案,对合并有症状的腹水,可考虑腹水引流和腹腔灌注化疗。
专家共识9(专家推荐率:76.7%;推荐等级:2级):对于体能状况良好的胃癌腹膜转移患者,可选择联合化疗方案;对体能状况评分较差的患者予以单药化疗。腹腔灌注化疗可作为全身系统化疗的补充治疗方案,腹腔化疗常用的药物包括紫杉醇、多西他赛、顺铂和奥沙利铂等。
3 结语
在肿瘤精准诊疗时代,胃癌的药物治疗即化疗、免疫治疗、靶向治疗等具有重要的地位及作用。然而,临床上常用药物的疗效有限,远未满足治疗需求。因此,未来需要探索创新药物,优化药物使用模式,同时结合其他治疗方式如放疗、介入、灌注、中医中药等,以提高患者的疗效。
胃癌作为全身性疾病,病因及机制复杂、异质性强,不同病理类型、不同分期的胃癌治疗原则也不一样,因此全程管理至关重要,在每一个治疗节点都需要多学科团队(multidisciplinaryteam,MDT)共同参与指导临床用药。随着基础与临床转化研究的发展,胃癌新型药物治疗领域,特别是针对新型靶点的药物的临床研究正在进行,如针对HER2靶点的ADC药物率先带来突破,其次,CLDN18.2ADC药物的初步探索带来有希望的临床获益,而靶向人滋养层细胞表面抗原2(trophoblastcellsurfaceantigen2,TROP2)、表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)、人表皮生长因子受体3(humanepidermalgrowthfactorreceptor3,HER3)等分子的ADC药物也在胃癌领域积极探索中,未来可期。参与上述相关临床研究有可能使患者获得新型的治疗方法,为患者带来新的希望。
