2型糖尿病男性患者系统性炎症指标与骨密度的关系
2025-02-15魏思澄于岁于瑛李华峰张琪唐与晓王秋灵于晓


摘要:目的评估2型糖尿病(T2DM)男性患者系统性炎症指标与骨密度(BMD)的关系。方法261例男性T2DM患者依据诊断标准分为骨量正常组(96例)、骨量减少组(111例)以及骨质疏松组(54例),比较3组系统性炎症指标和骨代谢指标的差异。多因素有序Logistic回归分析男性T2DM患者骨量正常向骨质疏松进展的影响因素。受试者工作特征(ROC)曲线评价炎症指标对T2DM男性患者骨质疏松的预测价值。分析炎症指标与患者不同部位BMD及骨转换指标(BTM)的相关性。结果骨质疏松组中血小板计数(PLT)、血小板与淋巴细胞计数比值(PLR)、全身免疫炎症指数(SII)、中性粒细胞与淋巴细胞计数比值(NLR)明显高于骨量正常组(P<0.05)。多因素有序Logistic回归分析发现PLR与SII升高为T2DM男性患者从骨量正常进展为骨质疏松过程中的危险因素。ROC曲线显示PLR预测骨量减少的曲线下面积(AUC)为0.590,截断值为96.67;SII的AUC为0.613,截断值为307.9;二者联合AUC为0.612;但两指标对预测骨质疏松方面无明显价值。在骨质疏松和骨量减少患者中,SII、PLR、PLT与腰椎L1-4 BMD及左髋关节BMD值均呈负相关(P<0.05);SII与左股骨颈BMD值也呈负相关(P<0.05)。结论炎症指标PLR、SII对男性T2DM患者从骨量正常进展为骨量减少和骨质疏松具有一定的预测价值。
关键词:糖尿病,2型;骨质疏松;骨密度;系统性炎症指标;血小板与淋巴细胞计数比值;全身免疫炎症指数;男性
中图分类号:R589.5,R681.4文献标志码:A DOI:10.11958/20241148
Correlation between systemic inflammation markers and bone mineral density in"ale patients with type 2 diabetes
WEI Sicheng1,YU Sui1,2△,YU Ying1,LI Huafeng2,ZHANG Qi2,TANG Yuxiao2,WANG Qiuling2,YU Xiao2
1 The Second Clinical Medical College of Binzhou Medical University,Yantai 264000,China;2 Department of Endocrinology and Metabolic Diseases,the Affiliated Hospital of Qingdao University,Yantai Yuhuangding Hospital
△Corresponding Author E-mail:yusuiyhd@163.com
Abstract:Objective To evaluate the relationship between systemic inflammation makers and bone mineral density(BMD)in male patients with type 2 diabetes(T2DM).Methods A total of 261 male patients with T2DM were selected and divided into three groups based on diagnostic criteria:the normal bone mass group(96 cases),the reduced bone mass group(111 cases)and the osteoporosis group(54 cases).Differences in systemic inflammation markers and bone metabolic markers were compared between the three groups.Multivariate ordered Logistic regression analysis was used to investigate factors influencing the progression from normal bone mass to osteoporosis in male patients with T2DM.Receiver operating characteristic(ROC)curves were used to evaluate the predictive value of inflammatory markers for osteoporosis in male patients with T2DM.Correlation analysis was conducted to investigate the correlation between inflammatory markers and BMD and bone turnover markers(BTM)in male patients with T2DM.Results Platelet count(PLT),platelet-to-lymphocyte ratio(PLR),systemic inflammatory index(SII)and neutrophil-to-lymphocyte ratio(NLR)were significantly higher in the osteoporosis group than those in the normal bone mass group(P<0.05).Multivariate ordered Logistic regression analysis showed that PLR and SII were risk factors for the progression from normal bone mass to osteoporosis in male patients with T2DM(P<0.05).The area under the ROC curve of PLR was 0.590,and the cut-off value was 96.67.The area under the curve of SII was 0.613,with a cut-off value of 307.9,and the area under the combined curve of the above two indicators was 0.612.In patients with osteoporosis and osteopenia,SII,PLR and PLT were negatively correlated with L1-4 BMD and left hip BMD(P<0.05).SII was also negatively correlated with left femoral neck BMD(P<0.05).Conclusion Inflammatorymarkers PLR and SII have predictive values for the progression from normal bone mass to bone loss and osteoporosis in male patients with T2DM.
Key words:diabetes mellitus,type 2;osteoporosis;bone density;systemic inflammation markers;PLR;SII;male
随着社会发展和生活方式转变,糖尿病和骨质疏松(osteoporosis,OP)患病率呈上升趋势。2018年的慢性病调查显示,中国成年人糖尿病患病率高达12.4%[1]。2型糖尿病(T2DM)患者属于骨质疏松的高危人群,与一般人群相比,其发生骨质疏松性骨折的风险更高。我国50岁以上和65岁以上男性人群OP患病率分别为6.0%和10.7%,50岁以上男性人群骨量减少患病率为46.9%[2],与女性相比,男性骨质疏松性骨折致死率更高[3]。炎症与T2DM、OP的发病紧密相关。系统性炎症指标涵盖全身免疫炎症指数(systemic immune-inflammation index,SII)、血小板与淋巴细胞计数比值(platelet-to-lymphocyte ratio,PLR)、中性粒细胞与淋巴细胞计数比值(neutrophil-to-lymphocyte ratio,NLR)及单核细胞与淋巴细胞计数比值(monocyte to lymphocyte ratio,MLR),能够反映机体的免疫炎症状态。这些指标具有经济、快速的优点,是近年来比较热门的炎症标志物。研究表明其与冠心病、肾小管损伤、慢性阻塞性肺疾病等多种疾病相关[4-5]。尽管关于男性患者骨密度(bone mineral density,BMD)与系统性炎症指标的相关性研究较少,但已有研究表明,炎症指标可能与OP进展有关,可作为潜在的生物标志物[6]。本研究旨在探讨男性T2DM患者BMD与系统性炎症指标的相关性,评估这些指标在预测疾病进展中的作用。
1对象与方法
1.1研究对象筛选2021年1月—2024年5月在青岛大学附属烟台毓璜顶医院内分泌与代谢病科住院的男性T2DM患者261例。纳入标准:(1)年龄≥50岁;(2)符合《中国2型糖尿病防治指南(2020年版)》T2DM诊断标准。排除标准:(1)合并糖尿病酮症酸中毒、高渗性高血糖综合征等糖尿病急性并发症;(2)糖尿病肾病Ⅳ期及以上、糖尿病视网膜病变、急性心肌梗死、脑梗死、糖尿病足等严重慢性并发症;(3)合并甲状腺功能异常等内分泌疾病;(4)慢性胃肠疾病,肝肾功能不全,感染性疾病;(5)曾长期服用糖皮质激素等可能影响骨代谢药物者;(6)血液病、结缔组织疾病、恶性肿瘤和其他严重慢性疾病。根据BMD检测结果,将患者分为骨量正常组(96例)、骨量减少组(111例)和骨质疏松组(54例)。本研究通过烟台毓璜顶医院伦理委员会审核批准(批准号:2024-369),患者或家属签署知情同意书。
1.2研究方法
1.2.1基本信息采集采集患者年龄、糖尿病病程、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)、病史等。
1.2.2实验室指标检测患者禁食8 h后,于第2天空腹状态采集外周静脉血,运用全自动生化仪检测中性粒细胞计数(NEU)、淋巴细胞计数(LYM)、单核细胞计数(MONO)、血小板计数(PLT)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、血尿酸(UA)、空腹血糖(FBG)、血钙、血磷。高效液相色谱法检测糖化血红蛋白(HbA1c)。电化学发光法检测空腹C肽、25羟基维生素D[25(OH)D]以及骨代谢指标(bone turnover markers,BTM),包括骨钙素(osteocalcin,OC)、β-胶原特殊序列(β‑caroxyl terminal peptide,β-CTX)、总I型胶原氨基端延长肽(type I procollagen N-terminal proeptide,P1NP)、甲状旁腺素(parathyroid hormone,PTH)。系统性炎症指标计算:NLR=NEU/LYM,SII=PLT×NEU/LYM,MLR=MONO/LYM,PLR=PLT/LYM。
1.2.3 BMD测定采用GE lunar iDXA双能X线骨密度测量仪。检测区域包括L1—L4椎体、左侧股骨颈和左侧髋关节。根据T值来判断骨质疏松:T值≥-1.0 SD为骨量正常,-2.5 SD≤T值≤-1.0 SD为骨量减少,T值≤-2.5 SD为骨质疏松。
1.3统计学方法采用SPSS 25.0软件进行数据分析,正态分布的计量资料以x±s表示。2组间均数比较采用独立样本t检验;多组间均数比较采用单因素方差分析,若方差不齐,则采用Welch校正,并用LSD-t法进行多重比较。非正态分布的数据以M(P25,P75)表示,2组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验,事后多重比较采用Bonferroni法进行校正。定性资料使用例(%)表示,组间比较采用χ2检验,事后两两比较通过Bonferroni法校正。将基线资料有差异的指标纳入多因素有序Logistic回归分析。绘制受试者工作特征(ROC)曲线评价炎症指标对OP的预测效能。Spearman相关分析各项炎症指标与BMD的相关性。双侧P<0.05为差异有统计学意义。
2结果
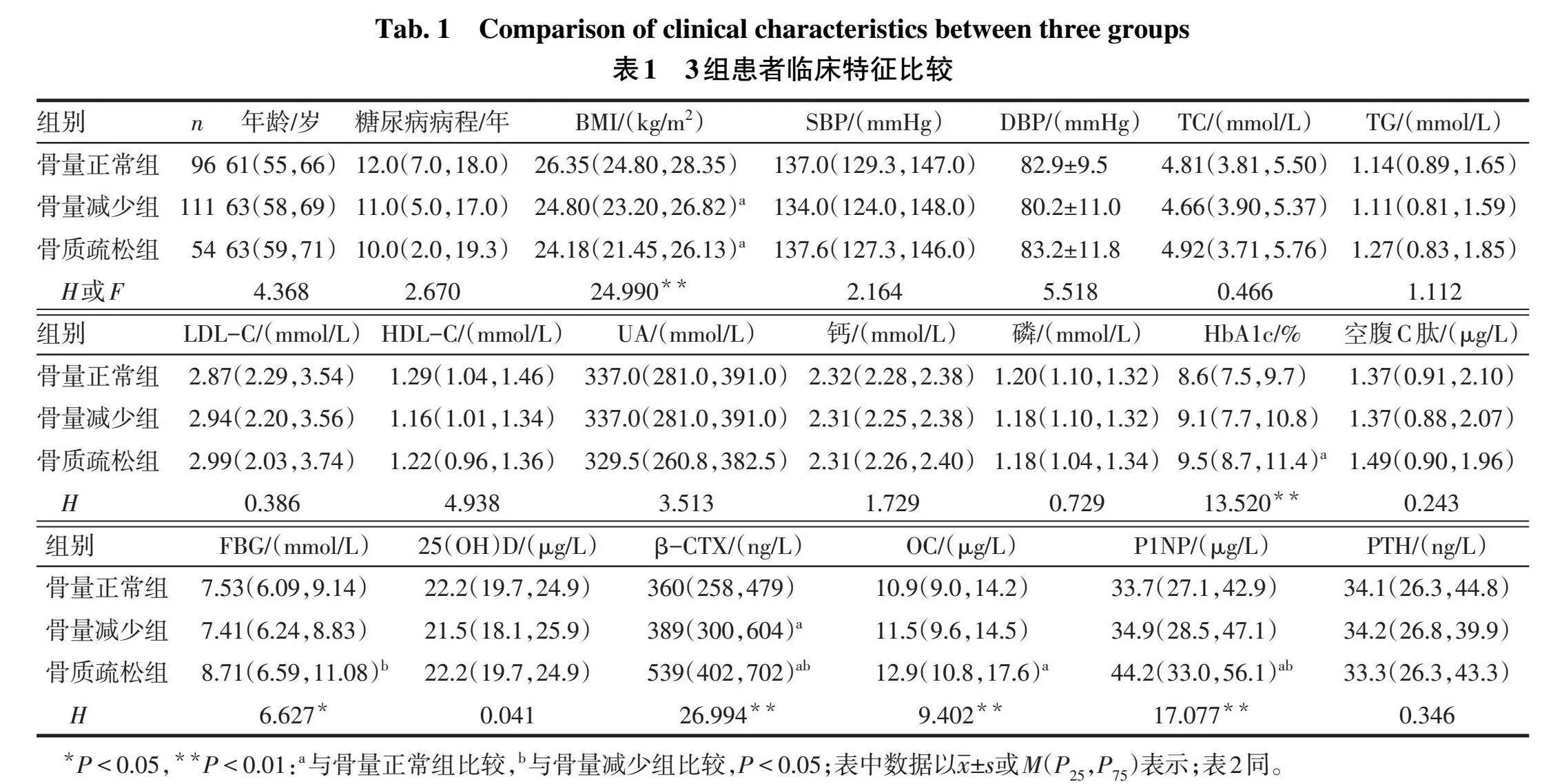
2.1 3组患者临床特征比较与骨量正常组相比,骨质疏松组和骨量减少组的BMI均明显下降(Plt;0.05),而骨质疏松组HbA1c、β-CTX、OC、P1NP均明显升高(P<0.05),骨量减少组的β-CTX亦明显升高(P<0.05);与骨量减少组比较,骨质疏松组FBG、β-CTX及P1NP均明显升高(P<0.05),见表1。
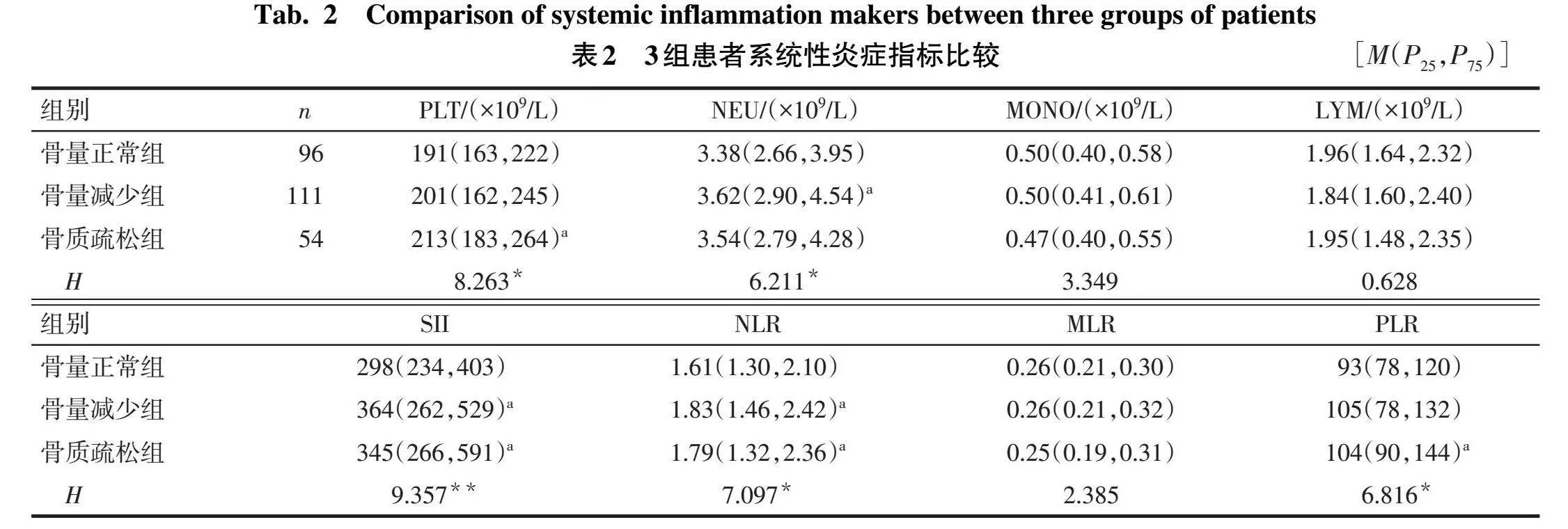
2.2 3组患者系统性炎症指标比较与骨量正常组相比,骨质疏松组的PLT、SII、NLR、PLR均明显升高(P<0.05),骨量减少组的NEU、SII、NLR亦明显升高(P<0.05);骨量减少组与骨质疏松组上述炎症指标差异均无统计学意义(P>0.05),见表2。
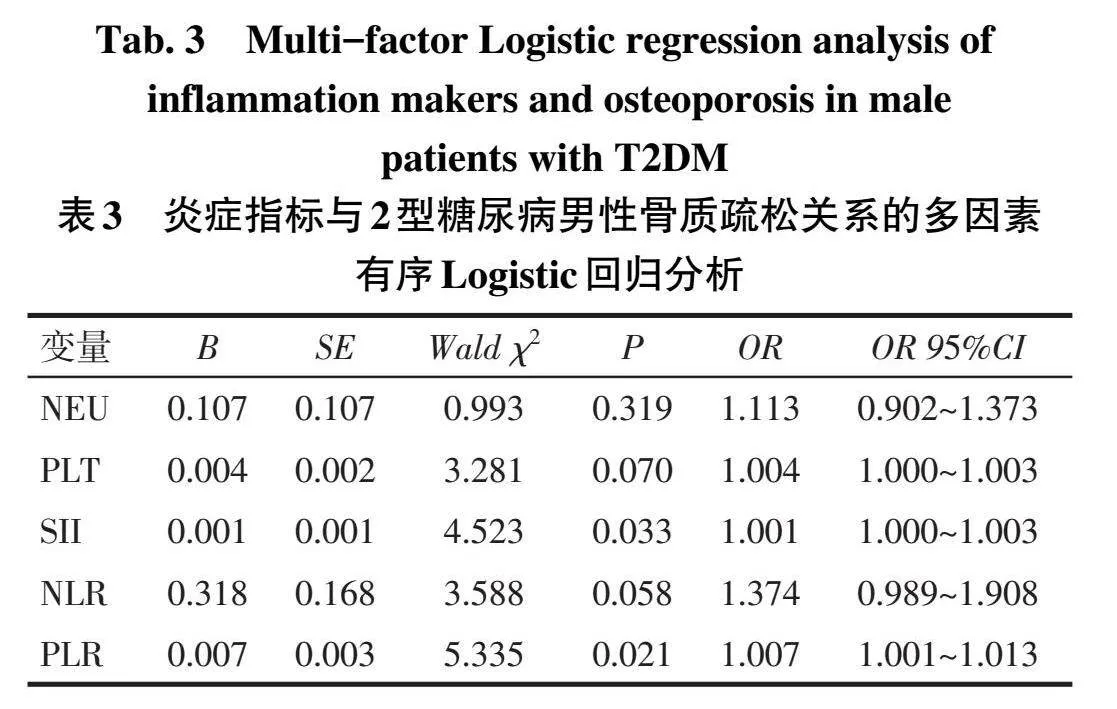
2.3男性T2DM患者OP的影响因素分析将在单因素分析中存在统计学意义的指标以及PLT、NEU、SII、NLR、PLR等作为自变量,因变量为骨量正常、骨量减少、骨质疏松(赋值情况:骨量正常=0,骨量减少=1,骨质疏松=2),把自变量及因变量代入多因素有序Logistic回归方程中。结果显示SII与PLR升高为T2DM男性患者从骨量正常进展为骨质疏松过程中的独立危险因素,见表3。
2.4 SII及PLR对骨量减少和骨质疏松的预测价值ROC曲线可见SII及PLR无论单独还是联合分析对骨质疏松的预测价值均较低(P>0.05),见图1。但SII及PLR单独或联合分析对骨量正常进展为骨量减少患者有一定的预测价值(P<0.05),SII的曲线下面积(AUC)为0.613,截断值为307.9,敏感度及特异度分别为67.2%、55.2%;PLR的AUC为0.590,截断值为96.67,敏感度及特异度分别为63.0%、55.2%;二者联合AUC为0.612,见图2。
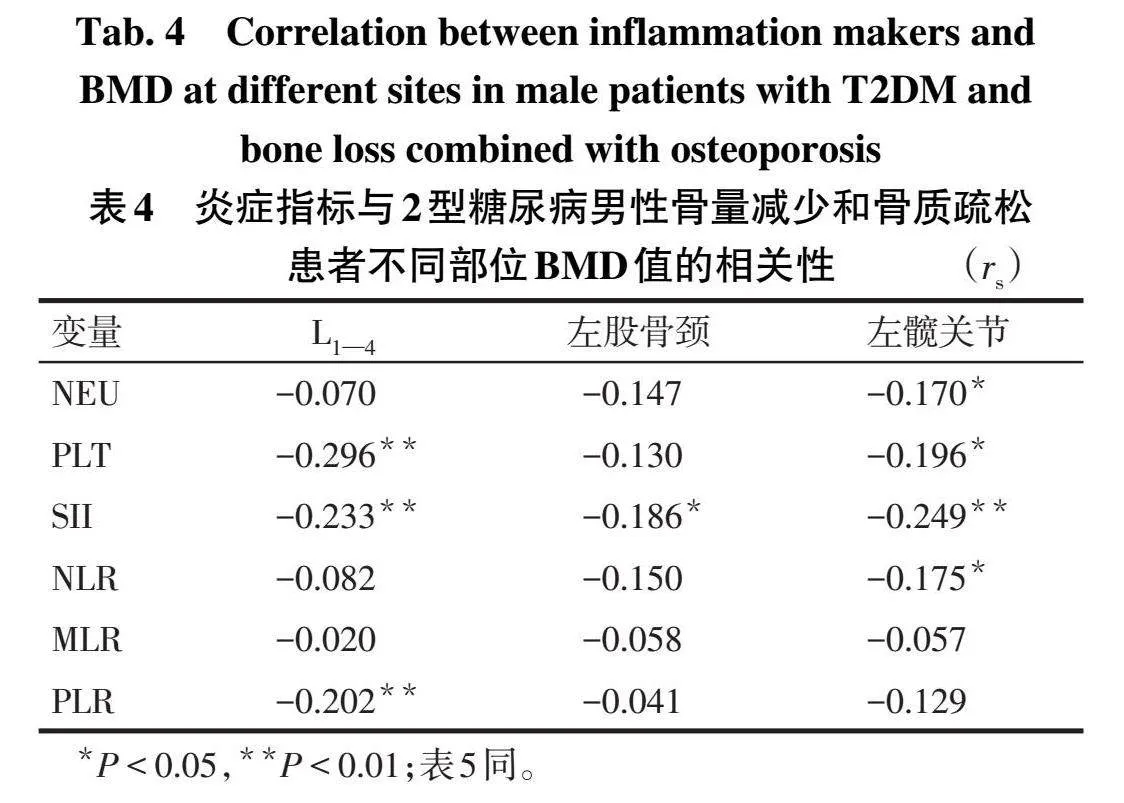
2.5炎症指标与不同部位BMD值的相关性在骨质疏松和骨量减少患者中,PLT、SII、PLR与L1—4BMD呈负相关;SII与左股骨颈BMD值呈负相关;NEU、PLT、SII、NLR与左髋关节BMD值均呈负相关,见表4。
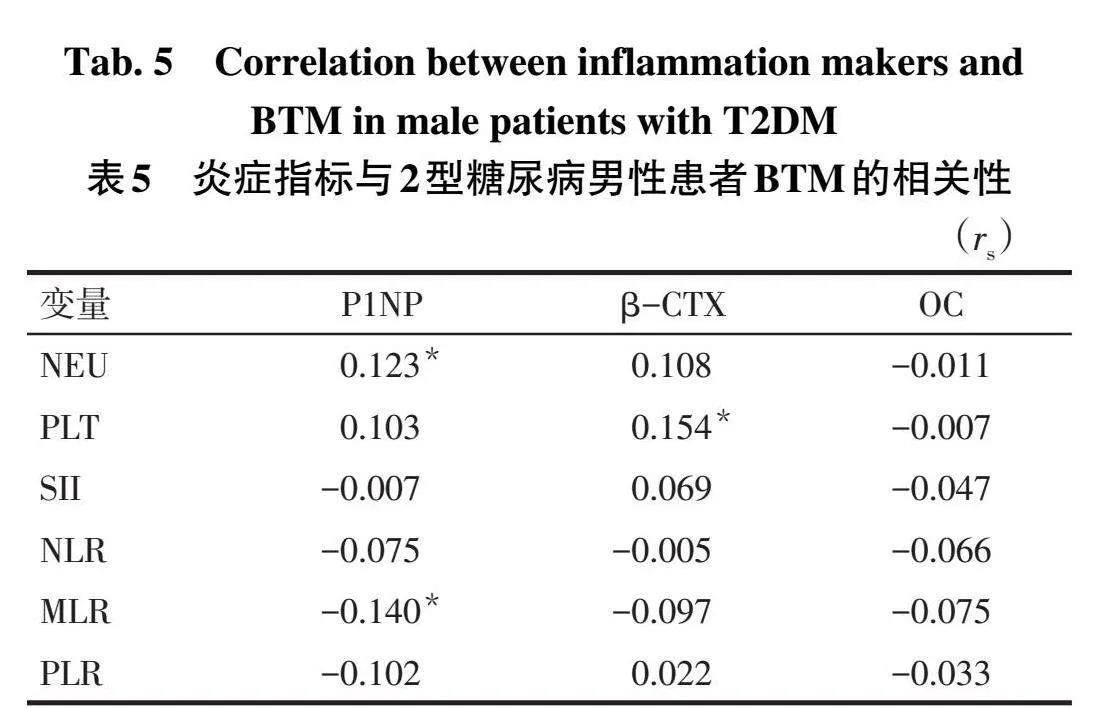
2.6炎症指标与BTM的相关性分析在3组比较中有统计学意义的炎症指标与BTM(P1NP、OC、β-CTX)的相关性,结果显示NEU与P1NP呈正相关,PLT与β-CTX呈正相关,MLR与P1NP呈负相关(P<0.05),OC与各炎症指标均无相关性。见表5。
3讨论
男性人群发生骨质疏松主要是由于年龄增长的相关因素所导致,其中炎症是重要的影响因素。多种炎症因子,如白细胞介素(IL)-6、IL-1、IL-3、肿瘤坏死因子α(TNF-α)、IL-10和IL-8等在骨质疏松的发病机制中扮演重要角色[7-8]。炎症因子总体上改变了骨吸收与骨形成的平衡,如IL-1和IL-6可以促进骨吸收,TNF-α可以抑制骨形成,并在某些阶段刺激骨吸收[7]。有研究表明,尽管T2DM患者为低骨转换状态,其骨密度可能正常,但骨微结构和骨材料强度性能的改变可能导致对负载和应力的抵抗力降低,从而显著增加骨折的风险[9-10]。因此,T2DM患者具有独特的骨骼特征。
新型炎症指标,如NLR、SII、PLR等反映了机体的全身性免疫状态。近年来,一些研究已经证实这些炎症指标对绝经后骨质疏松以及合并T2DM女性患者骨质疏松的诊断及骨质疏松性骨折的预测价值,但研究结果不尽相同。Trifan等[11]研究发现较高的SII水平增加了绝经后女性骨质疏松症和脆性骨折的发生风险,并且可以作为诊断OP的有力指标。Li等[12]研究则发现MLR与T2DM绝经后女性骨质疏松相关。冯红红等[13]研究显示SII、NLR、PLR、MLR在T2DM骨质疏松组与骨量正常组有明显差异,但该研究中男性患者数量极少。目前对于男性群体以及合并T2DM的男性患者系统性炎症指标与BMD的关系研究非常少。周泽霖等[6]观察到男性原发性骨质疏松症患者表现出较高的SII、NLR、PLR、MLR水平以及红细胞沉降率,这些炎症指标的异常升高对男性原发性骨质疏松症的诊断具有重要的参考价值。Chen等[14]研究发现PLR与腰椎BMD呈负相关,且按性别进行亚组分析发现,男性PLR水平与腰椎BMD呈负相关,而在女性中则未发现。
本研究发现,T2DM男性骨质疏松组患者的PLT、PLR、SII、NLR均明显高于骨量正常组,但未发现MLR在骨质疏松组与骨量正常组有差异。PLT是巨核细胞来源的细胞质片段,在骨稳态、骨形成和骨吸收中起重要作用[15-17],但其影响骨代谢的确切机制尚不明确。有研究发现它可以通过促进促炎因子(IL-1、IL-6等)的生成,启动并加剧炎症,促进骨吸收[18];活化的血小板还可以通过前列腺素RANKL依赖的机制影响破骨细胞的形成[19]。还有一些研究强调了PLT对骨形成的支持作用,其中血小板衍生生长因子通过影响细胞增殖、趋化分化和细胞外基质合成促进骨形成[20]。本研究显示PLT与β-CTX呈正相关,但与P1NP及OC均无相关性,提示PLT在T2DM男性患者中对骨代谢的影响可能与骨吸收的增强有关。冯红红等[13]也发现NLR、SII与β-CTX呈正相关,与P1NP无相关性,但本研究中PLR、SII、NLR均未显示出与BTM的相关性。本研究还发现SII和NLR在骨量减少组亦明显高于骨量正常组,且PLT、PLR、SII、NLR等4项炎症指标在骨质疏松与骨量减少组均无明显差异。进一步的有序Logistic回归分析与ROC曲线结果证实SII和PLR是T2DM男性骨质疏松疾病进展过程中的独立影响因素,且对从骨量正常进展为骨量减少和骨质疏松具有一定的预测价值。本研究中SII、PLT、PLR与T2DM男性骨质疏松和骨量减少两组患者BMD值的负相关关系对上述研究结果提供了进一步的支持。但笔者并未发现SII和PLR对骨质疏松有预测价值。目前临床上应用的双能X射线骨密度仪(DXA)及骨折风险评估工具经常会低估T2DM患者的骨折风险。本研究发现SII及PLR这两个指标在T2DM男性骨量减少患者中已经有所增高,提示这2个炎症指标未来或许可以作为评估T2DM男性患者骨折高风险的依据。值得注意的是,NEU在骨量减少组也明显高于骨量正常组,且与左髋关节BMD呈负相关。有研究显示NEU可以通过多种机制影响破骨细胞、成骨细胞和间充质干细胞而导致骨质疏松[21]。Li等[22]研究也发现NEU可以降低雄性小鼠的骨量。但本研究通过回归分析未显示出NEU对骨质疏松疾病及其进展的危害,未来或许可以加大样本量进一步验证。相较于DXA法,通过简单的血常规检测即可获取PLT、PLR、SII和NLR等炎症指标,这些指标不仅经济实惠,而且易于操作,可通过这些系统性炎症指标,连同患者的年龄、BMI、血糖等风险因素进行早期的OP及T2DM其他相关并发症的筛查和风险评估。
综上所述,本研究发现男性T2DM患者的BMD与多项系统性炎症指标呈负相关,结合系统性炎症指标的可获得性及其经济性,建议在临床诊疗中可以将系统性炎症指标作为男性T2DM患者发生骨质疏松的预警指标以及评估骨折高风险的参考值之一。然而,本研究尚有一定的局限性,如SII、PLR来源于血细胞,容易受多种因素的影响,存在一定的不稳定性,故临床单独使用它们预测疾病尚需进一步确认。
参考文献
[1]WANG L,PENG W,ZHAO Z,et al.Prevalence and treatment of diabetes in China,2013-2018[J].JAMA,2021,326(24):2498-2506.doi:10.1001/jama.2021.22208.
[2]中华医学会骨质疏松和骨矿盐疾病分会.中国骨质疏松症流行病学调查及“健康骨骼”专项行动结果发布[J].中华骨质疏松和骨矿盐疾病杂志,2019,12(4):317-318.Osteoporosis and Bone Mineral Salt Disease Branch,Chinese Medical Association.Epidemiological survey of osteoporosis in china and release of results of the“Healthy Bones”special action[J].Chin J Osteoporos Bone Miner Res,2019,12(4):317-318.doi:10.3969/j.issn.1674-2591.2019.04.001.
[3]VILACA T,EASTELL R,SCHINI M.Osteoporosis in men[J].Lancet Diabetes Endocrinol,2022,10(4):273-283.doi:10.1016/S2213-8587(22)00012-2.
[4]姜莹莹,王靖宇,孔岩,等.中性粒细胞/淋巴细胞比值与2型糖尿病患者肾小管损伤的相关性研究[J].天津医药,2022,50(1):83-87.JIANG Y Y,WANG J Y,KONG Y,et al.Correlation between neutrophil/lymphocyte ratio and renal tubular injury in patients with type 2 diabetes mellitus[J].Tianjin Med J,2022,50(1):83-87.doi:10.11958/20211431.
[5]屠昌明,田园,汪鹏程,等.SII、RAR与AECOPD患者病情严重程度及并发呼吸衰竭的关系[J].天津医药,2024,52(12):1317-1321.TU C M,TIAN Y,WANG P C,et al.Relationship between SII,RAR and severity of disease and respiratory failure in patients with AECOPD[J].Tianjin Med J,2024,52(12):1317-1321.doi:10.11958/20241172.
[6]周泽霖,尚奇,卓航,等.男性原发骨质疏松症骨密度与新型炎症指标的相关性[J].中国骨质疏松杂志,2023,29(5):636-640,646.ZHOU Z L,SHANG Q,ZHUO H,et al.Correlation between bone mineral density and new inflammatory markers in male primary osteoporosis[J].Chin J Osteoporos,2023,29(5):636-640.doi:10.3969/j.issn.1006-7108.2023.05.003.
[7]KANY S,VOLLRATH J T,RELJA B.Cytokines in inflammatory disease[J].Int J Mol Sci,2019,20(23):6008.doi:10.3390/ijms20236008.
[8]ZHANG W,ZHAO W,LI W,et al.The imbalance of cytokines and lower levels of tregs in elderly male primary osteoporosis[J].Front Endocrinol(Lausanne),2022,13:779264.doi:10.3389/fendo.2022.779264.
[9]SHEU A,GREENFIELD J R,WHITE C P,et al.Assessment and treatment of osteoporosis and fractures in type 2 diabetes[J].Trends Endocrinol Metab,2022,33(5):333-344.doi:10.1016/j.tem.2022.02.006.
[10]PRASAD T N,ARJUNAN D,PAL R,et al.Diabetes andosteoporosis[J].Indian J Orthop,2023,57(Suppl 1):209-217.
[11]TRIFAN G,TESTAI F D.Systemic Immune-Inflammation(SII)index predicts poor outcome after spontaneous supratentorial intracerebral hemorrhage[J].J Stroke Cerebrovasc Dis,2020,29(9):105057.doi:10.1016/j.jstrokecerebrovasdis.2020.105057.
[12]LI H,ZHANG X,ZHANG Q,et al.The relationship between the monocyte-to-lymphocyte ratio and osteoporosis in postmenopausal females with T2DM:a retrospective study in Chinese population[J].Front Endocrinol(Lausanne),2023,14:1112534.doi:10.3389/fendo.2023.1112534.
[13]冯红红,高飞.新型炎症因子与原发性骨质疏松症的研究进展[J].中国骨质疏松杂志,2022,28(1):152-156.FENG H H,GAO F.Research progress on novel inflammatory factors and primary osteoporosis[J].Chin J Osteoporos,2022,28(1):152-156.doi:10.3969/j.issn.1006-7108.2022.01.031.
[14]CHEN S,SUN X,JIN J,et al.Association between inflammatory markers and bone mineral density:a cross-sectional study from NHANES 2007–2010[J].J Orthop Surg Res,2023,18(1):305.doi:10.1186/s13018-023-03795-5.
[15]KARNIK S J,NAZZAL M K,KACENA M A,et al.Megakaryocyte secreted factors regulate bone marrow niche cells during skeletal homeostasis,aging,and disease[J].Calcif Tissue Int,2023,113(1):83-95.doi:10.1007/s00223-023-01095-y.
[16]STAVNICHUK M,KOMAROVA S V.Megakaryocyte-bone cell
interactions:lessons from mouse models of experimental myelofibrosis and related disorders[J].Am J Physiol Cell Physiol,2022,322(2):C177-C184.doi:10.1152/ajpcell.00328.2021.
[17]JIANG Y,ZHU Y,SHAO Y,et al.Platelet-derived apoptotic vesicles promote bone regeneration via golgi phosphoprotein 2(GOLPH2)-AKT signaling axis[J].ACS Nano,2023,17(24):25070-25090.doi:10.1021/acsnano.3c07717.
[18]刘洋,王文波.富血小板血浆在骨修复中的机制及应用[J].临床与病理杂志,2019,39(9):2041-2046.LIU Y,WANG W B.Mechanism and application of platelet-rich plasma in bone repair[J].J Clin Pathol Res,2019,39(9):2041-2046.doi:10.3978/j.issn.2095-6959.2019.09.031.
[19]KUMAR A,MAHENDRA J,MAHENDRA L,et al.Synergistic effect of biphasic calcium phosphate and platelet-rich fibrin attenuate markers for inflammation and osteoclast differentiation bysuppressing NF-κB/MAPK signaling pathway in chronic periodontitis[J].Molecules,2021,26(21):6578.doi:10.3390/molecules26216578.
[20]SALAMANNA F,MAGLIO M,SARTORI M,et al.Platelet features and derivatives in osteoporosis:a rational and systematic review on the best evidence[J].Int J Mol Sci,2020,21(5):1762.doi:10.3390/ijms21051762.
[21]FRASE D,LEE C,NACHIAPPAN C,et al.The inflammatory contribution of B-lymphocytes and neutrophils in progression to osteoporosis[J].Cells,2023,12(13):1744.doi:10.3390/cells12131744.
[22]LI J,YAO Z,LIU X,et al.TGFβ1+CCR5+neutrophil subset increases in bone marrow and causes age-related osteoporosis in male mice[J].Nat Commun,2023,14(4):159.doi:10.1038/s41467-023-35801-z.
(2024-08-20收稿2024-11-05修回)
(本文编辑胡小宁)