血清APOC1和Klotho表达对肾癌后腹腔镜下肾部分切除术患者预后的预测价值
2025-02-15吴亚蒙李亮亮王彦刚邢德福


摘要:目的探讨载脂蛋白C1(APOC1)和Klotho表达预测肾癌后腹腔镜下肾部分切除术患者预后的临床价值。方法选择确诊为肾癌并行后腹腔镜肾部分切除术的患者80例,根据预后情况分为预后良好组(61例)和预后不良组(19例),另择健康体检者78例为对照组。收集一般临床资料,采用荧光定量聚合酶链式反应(qRT-PCR)检测血清APOC1、Klotho表达。采用Pearson法分析患者血清APOC1与Klotho水平的相关性,Cox回归分析影响患者预后的因素,受试者工作特征(ROC)曲线评估APOC1、Klotho水平对患者预后的预测效能。结果预后不良组和预后良好组临床分期和病理分级差异有统计学意义(P<0.05)。对照组、预后良好组和预后不良组血清APOC1表达水平依次升高,Klotho表达水平依次降低(P<0.05)。患者血清APOC1与Klotho表达水平呈负相关(r=-0.577,P<0.001)。Cox回归分析结果显示,Klotho表达水平降低、APOC1表达水平升高、病理分级2级、临床分期Ⅱ期是导致患者预后不良的独立危险因素(P<0.05)。ROC曲线结果显示,血清APOC1、Klotho联合预测肾癌患者术后预后不良的临床价值优于单一指标(P<0.05)。结论肾癌后腹腔镜下肾部分切除术预后不良患者血清APOC1水平升高,Klotho水平降低,二者联合对患者预后具有较高的临床价值。
关键词:肾肿瘤;载脂蛋白C1;Klotho;后腹腔镜肾部分切除术;预后
中图分类号:R737.11文献标志码:A DOI:10.11958/20240969
Predictive value of serum APOC1 and Klotho expression for prognosis in patients undergoing laparoscopic partial nephrectomy for renal cancer
WU Yameng,LI Liangliang,WANG Yangang,XING Defu
Department of Urology,Anhui Medical University Affiliated Fuyang Hospital,Fuyang 236000,China
Abstract:Objective To explore the clinical value of apolipoprotein C1(APOC1)and Klotho expression levels in predicting the prognosis of patients with renal cancer after laparoscopic partial nephrectomy.Methods Eighty patients diagnosed as renal cell carcinoma and underwent laparoscopic partial nephrectomy were collected as the study subjects.According to the prognosis,patients were separated into the good prognosis group(61 cases)and the poor prognosis group(19 cases).Seventy-eight healthy individuals underwent physical examination were collected as the control group.The general clinical data of the subjects were collected,and serum levels of APOC1 and Klotho were tested and analyzed in three groups.Pearson method was applied to analyze the correlation between serum APOC1 and Klotho levels in patients.Cox regression was applied to analyze factors affecting the prognosis of patients.Receiver operating characteristic(ROC)curve was applied to analyze the predictive efficacy of APOC1 and Klotho levels on the prognosis of patients.Results There were significant differences in clinical stage and pathological grade between the poor prognosis group and the good prognosis group(Plt;0.05).Compared with the control group,the serum APOC1 levels were significantly increased in the good prognosis group and the poor prognosis group(P<0.05),while the Klotho expression levels were obviously reduced(P<0.05).And the serum APOC1 level in the control group,the poor prognosis group and the good prognosis group was increased successively(Plt;0.05),while the serum Klotho level was obviously decreased successively(P<0.05).The serum APOC1 expression level of patients was negatively correlated with Klotho level(r=-0.577,P<0.001).The Cox regression results showed that decreased expression level of Klotho and elevated expression level of APOC1,pathologic grading 2 and clinical staging stageⅡwere all independent risk factors for poor prognosis(P<0.05).The area under the curve(AUC)of serum APOC1 and Klotho levels,and their combined application in predicting poor postoperative prognosis in renal cancer patients was 0.863,0.850 and 0.953,respectively,and the clinical value of combination of the two in predicting the prognosis of patients was superiorto that of APOC1 and Klotho alone.Conclusion Patients with poor prognosis after retroperitoneal laparoscopic partial nephrectomy have a obvious increase in serum levels of APOC1 and a obvious decrease in serum level of Klotho.The combination of the two has high clinical significance in predicting the prognosis of patients with retroperitoneal laparoscopic partial nephrectomy.
Key words:kidney neoplasms;apolipoprotein C1;Klotho;retroperitoneal laparoscopic partial nephrectomy for renal cancer;prognosis
肾癌具有高发病率、高致死率等特点,是十大恶性肿瘤之一。腹腔镜肾部分切除术具有失血少、恢复快、并发症少等优点,近几年已经成为传统开放式肾部分切除术的替代方法[1]。但对于该术式,患者预后存在较大差异[2],并且尚缺乏预测预后的有效指标。载脂蛋白C1(Apolipoprotein C1,APOC1)是载脂蛋白C家族中最小的载脂蛋白,参与胆固醇代谢、膜重建、神经元凋亡和重组等多种生物学过程,且APOC1在多种癌症的发生和发展中发挥重要作用[3]。已有研究证明,抗衰老因子Klotho具有抗炎、抗纤维化和抗氧化特性,在肾脏疾病中发挥了关键作用[4],同时可抑制肾癌的进展[5]。目前关于APOC1和Klotho表达与肾癌后腹腔镜下肾部分切除术患者预后的关系尚未明确。本研究通过检测后腹腔镜肾部分切除术患者血清APOC1、Klotho表达,探讨APOC1、Klotho预测患者预后的临床价值。
1对象与方法
1.1研究对象选取2018年10月—2020年6月于我院泌尿外科确诊为肾癌并行后腹腔镜肾部分切除术的患者80例,其中男53例,女27例,年龄42~75岁,平均(61.52±11.44)岁。肾癌参照《2016版WHO肾脏肿瘤新分类解读》[6]的相关诊断标准,并经实验室、影像学、病理学确诊。纳入标准:(1)首次发病,行后腹腔镜肾部分切除术。(2)临床资料完整。(3)生存期≥6个月。(4)符合肾肿瘤保留肾单位手术(Nephron sparing surgery,NSS)适应证,并顺利完成手术者。排除标准:(1)精神系统疾病。(2)有意识障碍。(3)冠心病、肺炎等其他器质性疾病。(4)其他恶性肿瘤。(5)肝肾功能不全者。另选择本院同期健康体检者78例为对照组,其中男45例,女33例,年龄43~78岁,平均(61.53±10.95)岁。肾癌患者行后腹腔镜肾部分切除术后对其进行3年随访,根据预后情况分为预后良好组(无复发、远处转移等情况,61例)和预后不良组(出现肾癌复发11例、转移5例、死亡3例,19例)。所有研究对象均知情同意,本研究经过医院伦理委员会批准(BY201805-003)。
1.2方法
1.2.1一般资料收集收集并记录入组患者的年龄、性别、病程、肿瘤类型、病理分级、TNM分期等指标。
1.2.2血液学指标采集肾癌患者术前(对照组为体检当日)空腹静脉血3~5 mL,血液静置30 min后以3 000 r/min离心获得血清,置于-80℃下保存备用。采用酶联免疫吸附试验检测血清血肌酐(Scr)、尿素氮(BUN)水平,试剂盒购自南京卡米洛生物公司(货号:2H-KMLJh315349,2H-KMLJh315447),操作严格遵循试剂盒说明书。
1.2.3荧光定量聚合酶链式反应(qRT-PCR)检测血清APOC1、Klotho表达取部分血清样本,使用TRIzol试剂(上海源叶生物科技有限公司)提取血清总RNA。采用反转录试剂盒(北京伊塔生物科技有限公司)将总RNA反转录为cDNA,并进行定量分析。引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。qRT-PCR反应体系20µL:10.0µL SYBR Green Master Mix(北京伊塔生物科技有限公司)、2.0µL cDNA、0.5µL上游引物、0.5µL下游引物和7.0µL无RNA酶水。反应条件:97.5℃8 min;97.5℃30 s,60℃20 s,72.5℃10 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算APOC1、Klotho相对表达量。
1.3统计学方法采用SPSS 27.0软件对数据进行分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;计数资料采用例或例(%)表示,组间比较采用χ2检验;采用Pearson法分析血清APOC1和Klotho水平的相关性;采用Cox回归分析影响后腹腔镜肾部分切除术患者预后的因素;采用受试者工作特征(ROC)曲线分析APOC1、Klotho表达对患者预后的预测效能,曲线下面积(AUC)比较行Delong检验。P<0.05为差异有统计学意义。
2结果
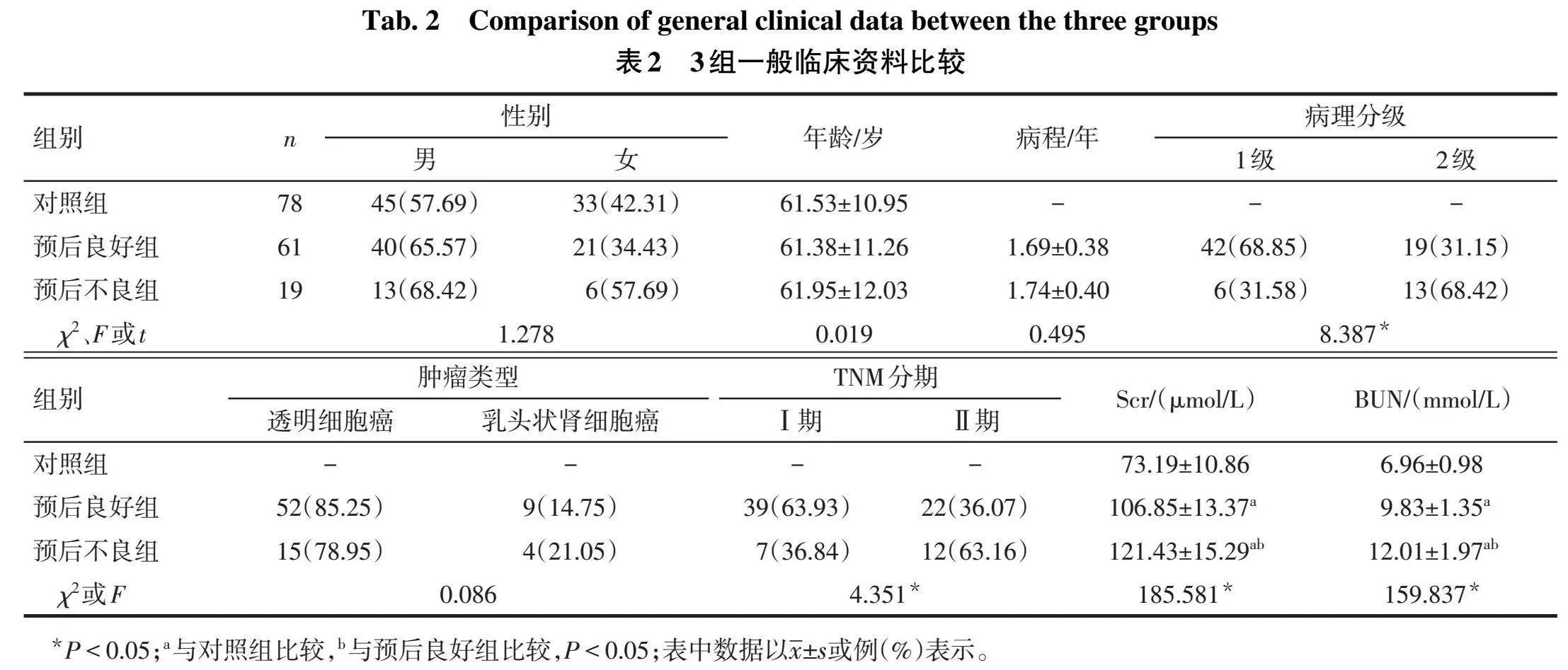
2.1 3组一般资料比较预后良好组、预后不良组和对照组的性别、年龄差异均无统计学意义;预后良好组和预后不良组患者的病程及肿瘤类型差异无统计学意义。与对照组相比,预后良好组和预后不良组Scr和BUN水平呈现不同程度的升高(P<0.05);与预后良好组相比,预后不良组病理分级为2级、TNM分期Ⅱ期占比较高(P<0.05),见表2。
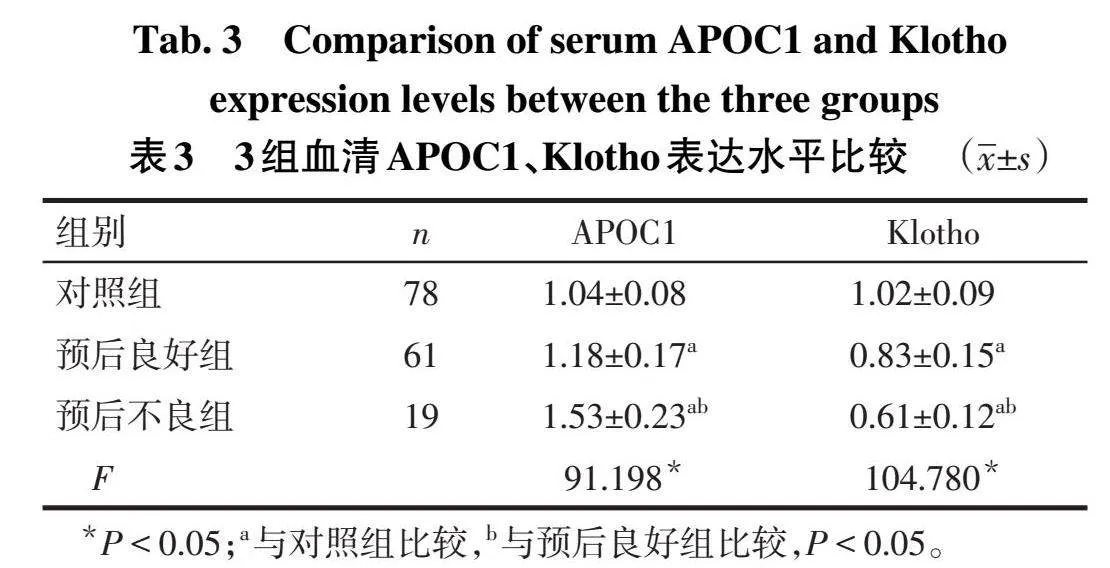
2.2 3组血清APOC1、Klotho表达水平比较对照组、预后良好组和预后不良组血清APOC1水平依次升高,Klotho水平依次降低(P<0.05),见表3。
2.3血清APOC1、Klotho表达水平相关性腹腔镜肾部分切除术患者血清APOC1(1.53±0.46)与Klotho表达水平(0.78±0.21)呈负相关(r=-0.577,Plt;0.001)。
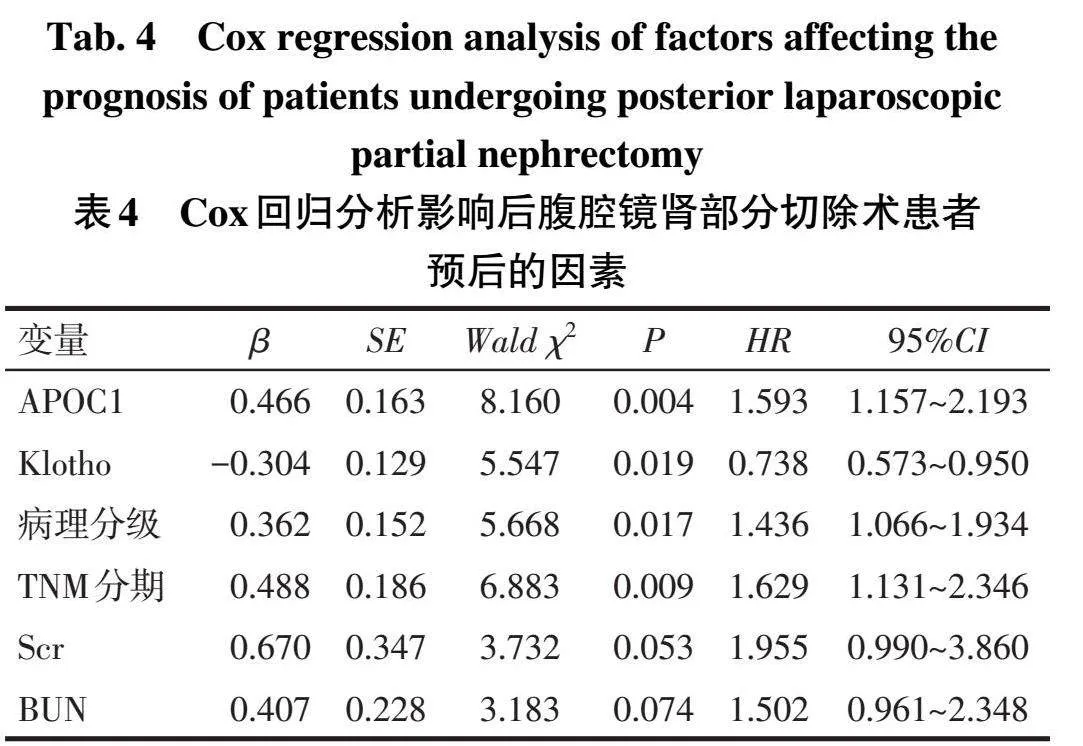
2.4后腹腔镜肾部分切除术患者预后的影响因素分析以肾癌患者行后腹腔镜肾部分切除术后的预后情况为因变量(预后不良=1,预后良好=0),以血清APOC1、Klotho表达水平和表2单因素分析结果中表现出显著性差异的指标病理分级(1级=1,2级=2)、TNM分期(Ⅰ期=1,Ⅱ期=2)、Scr、BUN为自变量,构建Cox回归模型。结果显示,Klotho表达水平降低、APOC1表达水平升高、病理分级2级、TNM分期Ⅱ期是导致患者预后不良的独立危险因素(Plt;0.05),见表4。
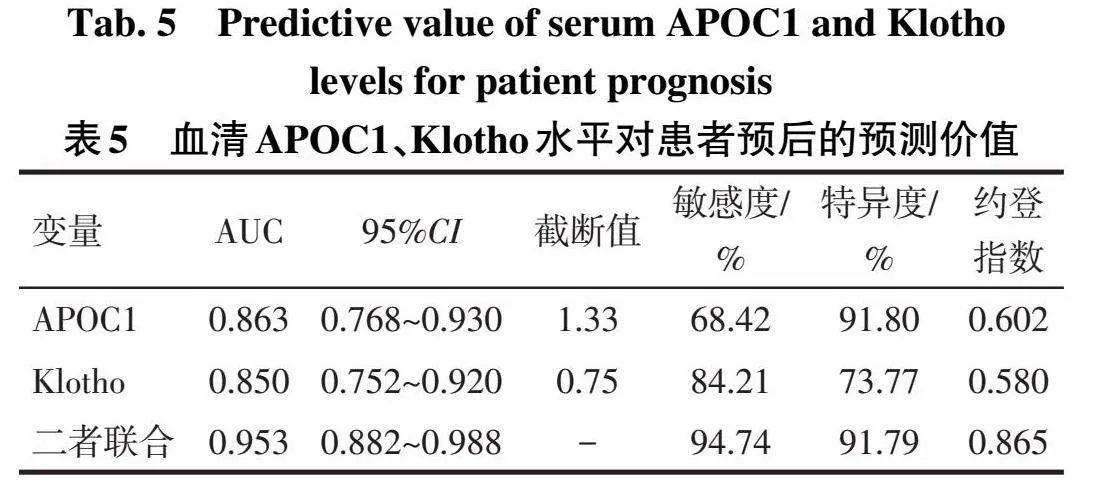
2.5血清APOC1、Klotho表达对后腹腔镜肾部分切除术后预后的预测价值以肾癌患者行后腹腔镜肾部分切除术后的预后作为状态变量(预后不良=1,预后良好=0),APOC1、Klotho表达水平为检验变量,绘制ROC曲线评价血清APOC1、Klotho水平对患者预后的预测效能。结果显示,血清APOC1、Klotho联合预测肾癌患者术后预后不良的临床价值优于APOC1、Klotho单独检测(Z分别为2.545、2.045,Plt;0.05),见表5、图1。
3讨论
肾癌发病率约占所有新发癌症的4.1%,术后预防复发或转移是提高患者生存期的关键,因此,寻找特异性指标预测患者术后预后十分重要[7-8]。APOC1是载脂蛋白C家族成员之一,主要由肝脏合成,也可由皮肤、肺和肠道等其他器官合成[9]。APOC1存在于乳糜粒、极低密度脂蛋白和高密度脂蛋白中,作为一种能够在不同类型的脂蛋白间转移的载脂蛋白,在维持脂质稳态及血浆脂蛋白(如高密度脂蛋白、低密度脂蛋白等)代谢中起重要作用,其还被证实可抑制血浆中胆管酯转移蛋白[10-11]。有研究表明,APOC1参与膜重建、胆固醇分解代谢、树突状细胞凋亡和重组等多种生物学过程[4],且被认为与2型糖尿病、糖尿病肾病、阿尔茨海默病和肾小球硬化的发生有关[9,12]。另外,越来越多的证据表明,APOC1参与癌症的发生和发展。例如,APOC1在胃癌[13]、结直肠癌[14]中高表达,其高表达与患者预后不良有关。本研究结果显示,预后不良组血清APOC1表达水平显著高于预后良好组,且APOC1表达水平升高是导致后腹腔镜肾部分切除术患者预后不良的独立危险因素,提示APOC1水平升高与后腹腔镜肾部分切除术患者预后不良有关,这可能与APOC1参与树突状细胞的凋亡和重组等生理过程有关;ROC曲线结果显示,APOC1预测后腹腔镜肾部分切除术患者预后不良的AUC为0.863,敏感度为68.42%,特异度为91.80%,提示APOC1可作为临床预测该类患者预后的辅助指标。
Klotho基因主要在肾脏和大脑组织中表达,可产生膜结合受体和体液调节因子[15]。研究表明,小鼠缺乏Klotho基因时,会出现类似于人动脉粥样硬化、癌症和骨质疏松症的症状,随后的临床研究也发现了类似于Klotho缺乏症的功能障碍,特别是在癌症、心血管和肾脏疾病方面[16]。有研究表明,Klotho作为一种肿瘤抑制因子,在肝细胞癌、胰腺癌、乳腺癌和肺癌等肿瘤进展中发挥重要作用[17-19]。此外,由于Klotho具有抗炎、抗纤维化、抗衰老和抗氧化的特性,亦对多种肾脏疾病的进展有重要影响[5]。Gigante等[5]研究发现,肾癌组织中Klotho表达水平显著低于正常组织,且低表达的Klotho参与癌症的发生和转移过程。本研究结果显示,预后良好组和预后不良组患者血清Klotho表达水平显著低于对照组,且Klotho表达水平降低是后腹腔镜肾部分切除术患者预后不良的独立危险因素,提示患者术后Klotho水平降低会在一定程度上导致其预后不良,Klotho具有抑癌、抗炎等作用;ROC曲线结果显示,Klotho可作为临床预测该类患者预后的辅助指标。
此外,本研究中患者血清APOC1与Klotho表达水平呈负相关,且ROC曲线分析发现二者联合预测预后的效能优于单独检测,提示临床上可将该两指标纳入检测范围并用于预后判断,以利于患者的及时治疗和预后改善。
综上所述,后腹腔镜肾部分切除术后发生预后不良患者的血清APOC1水平升高,Klotho水平降低,二者呈负相关,且二者联合对预后具有较高的预测价值。后续将扩大样本量进一步验证此结论,并探讨APOC1、Klotho影响后腹腔镜肾部分切除术患者预后的具体作用机制。
参考文献
[1]KALAPARA A A,FRYDENBERG M.The role of open radical nephrectomy in contemporary management of renal cell carcinoma[J].Transl Androl Urol,2020,9(6):3123-3139.doi:10.21037/tau-19-327.
[2]王晨青,索杰,罗晓辉,等.血清TNF-α、IFN-γ表达对后腹腔镜肾癌部分切除术患者预后的预测价值[J].海南医学,2021,32(1):49-52.WANG C Q,SUO J,LUO X H,et al.Value of serum TNF-αand IFN-γexpression in predicting the prognosis of patients undergoing retroperitonealpartial renal resection[J].Hainan Med J,2021,32(1):49-52.doi:10.3969/j.issn.1003-6350.2021.01.013.
[3]YAN Y,ZHOU Y,WANG K,et al.Apolipoprotein C1(APOC1),a candidate diagnostic serum biomarker for breast cancer identified by serum proteomics study[J].Crit Rev Eukaryot Gene Expr,2022,32(4):1-9.doi:10.1615/CritRevEukaryotGeneExpr.2021040967.
[4]LIU J,WANG H,LIU Q,et al.Klotho exerts protection in chronic kidney disease associated with regulating inflammatory response and lipid metabolism[J].Cell Biosci,2024,14(1):97-101.doi:10.1186/s13578-024-01226-4.
[5]GIGANTE M,LUCARELLI G,DIVELLA C,et al.Soluble serumαKlotho is a potential predictive marker of disease progression in clear cell renal cell carcinoma[J].Medicine(Baltimore),2015,94(45):e1917-e1925.doi:10.1097/MD.0000000000001917.
[6]饶秋,夏秋媛,周晓军,等.2016版WHO肾脏肿瘤新分类解读[J].中华病理学杂志,2016,45(7):435-441.RAO Q,XIA Q Y,ZHOU X J,et al.Interpretation of the 2016 edition of the new WHO classification of renal tumors[J].Chin J Pathol,2016,45(7):435-441.doi:10.3760/cmajissn.0529-5807.2016.07.002.
[7]ROSIELLO G,LARCHER A,MONTORSI F,et al.Renal cancer:overdiagnosis and overtreatment[J].World J Urol,2021,39(8):2821-2823.doi:10.1007/s00345-021-03798-z.
[8]LI M,CHENG L,ZHANG H,et al.Laparoscopic and robotic-assisted partial nephrectomy:an overview of hot issues[J].Urol Int,2020,104(9/10):669-677.doi:10.1159/000508519.
[9]XIAO H,XU Y.Overexpression of apolipoprotein C1(APOC1)in clear cell renal cell carcinoma and its prognostic significance[J].Med Sci Monit,2021,27:e929347-e929357.doi:10.12659/MSM.929347.
[10]FUIOR E V,AFENCU A V.Apolipoprotein C1:its pleiotropic effects in lipid metabolism and beyond[J].Int J Mol Sci,2019,20(23):5939-5963.doi:10.3390/ijms20235939.
[11]NAYAK A,SALT G,VERMA S K,et al.Proteomics approach to identify biomarkers in neurodegenerative diseases[J].Int Rev Neurobiol,2015,121:59-86.doi:10.1016/bs.irn.2015.05.003.
[12]BUS P,PIERNEEF L,BOR R,et al.Apolipoprotein C-I plays arole in the pathogenesis of glomerulosclerosis[J].J Pathol,2017,241(5):589-599.doi:10.1002/path.4859.
[13]YI J,REN L,WU J,et al.Apolipoprotein C1(APOC1)as a novel diagnostic and prognostic biomarker for gastric cancer[J].Ann Transl Med,2019,7(16):380-390.doi:10.1111/1759-7714.12117.
[14]REN H,CHEN Z,YANG L,et al.Apolipoprotein C1(APOC1)promotes tumor progression via MAPK signaling pathways in colorectal cancer[J].Cancer Manag Res,2019,11:4917-4930.doi:10.2147/CMAR.S192529.
[15]LIM K,GROEN A,MOLOSTVOV G,et al.α-Klotho expression in human tissues[J].J Clin Endocrinol Metab,2015,100(10):E1308-E1318.doi:10.1210/jc.2015-1800.
[16]QIAO Y,LIU F,PENG Y,et al.Association of serum Klotho levels with cancer and cancer mortality:evidence from national health andnutrition examination survey[J].Cancer Med,2023,12(2):1922-1934.doi:10.1002/cam4.5027.
[17]KURO O M.The Klotho proteins in health and disease[J].Nat Rev Nephrol,2019,15(1):27-44.doi:0.1038/s41581-018-0078-3.
[18]MARTIN-NUNEZ E,DONATE-CORREA J,FERRI C,et al.Association between serum levels of Klotho and inflammatory cytokines in cardiovascular disease:a case-control study[J].Aging(Albany NY),2020,12(2):1952-1964.doi:10.18632/aging.102734.
[19]MENCKE R,OLAUSON H,HILLEBRANDS J L.Effects of Klotho on fibrosis and cancer:arenal focus on mechanisms and therapeutic strategies[J].Adv Drug Deliv Rev,2017,121:85-100.doi:10.1016/j.addr.2017.07.009.
(2024-08-01收稿2024-10-11修回)
(本文编辑陈丽洁)