紫花前胡苷缓解神经病理性疼痛的机制探讨
2025-02-15刘鸿雁李雅晨盛格格朱海丽吴基良







摘要:目的探究紫花前胡苷(Nod)在神经病理性疼痛(NP)中的作用及机制。方法筛选并分析NP数据初级躯体感觉皮层(S1)内差异性表达基因及数据集与线粒体数据之间的重叠基因,重叠基因相互作用网络并筛选核心基因。27只小鼠随机分为假手术组、模型组及给药组(9只/组);模型组及给药组构建坐骨神经慢性压迫损伤模型,给药组腹腔注射Nod 10 mg/kg连续1周;检测小鼠痛觉行为学和运动能力的改变;HE染色、尼氏染色检测小鼠S1区脑组织神经损伤和炎症的影响;蛋白免疫印迹分析S1脑区白细胞介素(IL)-1β、即早基因(c-Fos)、泛醇-细胞色素C还原酶复合体Ⅲ亚基(Uqcrq)和泛醌氧化还原酶亚基(Ndufb5)的表达水平;分子对接探究Nod的作用靶点。将PC12细胞分为对照组、IL-1β组(1µmol/L IL-1β处理)和IL-1β+Nod组(1µmol/L IL-1β+1µmol/L Nod处理),检测各组线粒体膜电位。结果NP数据集GSE180627中S1脑区包含293个差异性表达基因,线粒体数据包含1 082个基因,重叠基因共34个,氧化磷酸化和电子传递链相关基因被富集,蛋白相互作用网络显示核心基因包括电子传递链相关蛋白Ndufb5、Uqcrq、Ndufs8、Ndufa7、Ndufa3、Cox6b1和Mrps33。与模型组相比,给药组小鼠机械缩足阈值、热缩足反射潜伏期、转棒停留时间增加,S1组织炎症浸润细胞数量和神经元中尼氏小体数量减少,神经元c-Fos和IL-1β表达水平降低,Uqcrq和Ndufb5的表达水平升高(P<0.05)。分子对接显示Nod可结合Uqcrq和Ndufb5。与IL-1β组细胞相比,IL-1β+Nod组细胞线粒体膜电位荧光信号增强(P<0.05)。结论Nod可改善小鼠的痛觉行为,其机制涉及改善S1内线粒体损伤。
关键词:前胡苷;线粒体;炎症;神经病理性疼痛;初级躯体感觉皮层
中图分类号:R965文献标志码:A DOI:10.11958/20240971
Mechanism of nodakenin in relieving neuropathic pain
LIU Hongyan,LI Yachen,SHENG Gege,ZHU Haili,WU Jiliang△
School of Pharmacy,Hubei University of Science and Technology,Xianning 437100,China
△Corresponding Author E-mail:Xywjl@163.com
Abstract:Objective To investigate the effect and mechanism of nodakenin(Nod)in neuropathic pain(NP).Methods Differential expression genes in the primary somatsensory cortex(S1)of NP data and overlapping genes between the dataset and mitochondrial data were screened and analyzed.Overlapping gene interaction networks were overlapped and core genes were screened.A total of 27 mice were randomly divided into the sham operation group,the model group and the drug administration group(9 mice/group).The chronic compression injury model of sciatic nerve was constructed in the model group and the drug administration group.Nod 10 mg/kg was intraperitoneally injected into the drug administration group for 1 week.Changes of pain behavior and motor ability in mice were detected.HE staining and Nissl staining were used to detect effects of nerve injury and inflammation on brain tissue of S1 region of mice.The expression levels of interleukin-1β,early gene(c-Fos),panthenol-cytochrome c reductase complex III subunit(Uqcrq)and ubiquinone oxidoreductase subunit(Nduf)b5 in S1 brain region were analyzed by Western blot assay.Molecular docking was used to study the target of Nod.PC12 cells were divided into the control group,the IL-1βgroup(1µmol/L IL-1βtreatment)and the IL-1β+Nod group(1µmol/L IL-1β+1µmol/L Nod treatment),and mitochondrial membrane potential was detected in each group.Results In the NP dataset GSE180627,S1 brain region contained 293 differentially expressed genes,and the mitochondrial data contained 1 082 genes.There were 34 overlapping genes,and genes related to oxidative phosphorylation and electron transport chain were enriched.The protein interaction network showed that core genes included electron transport chain related proteins Ndufb5,Uqcrq,Ndufs8,Ndufa7,Ndufa3,Cox6b1 and Mrps33.Compared with the model group,themechanical foot shrinkage threshold,thermal foot shrinkage reflex latency and rod rotation residence time of mice were increased in the drug administration group,the number of inflammatory infiltrating cells in S1 tissue and the number of Nislet bodies in neurons,expression levels of c-Fos and IL-1βin neurons were decreased,and expression levels of Uqcrq and Ndufb5 were increased(P<0.05).Molecular docking showed that Nod could bind Uqcrq and Ndufb5.Compared with the IL-1βgroup,the fluorescence signal of mitochondrial membrane potential was enhanced in the IL-1β+Nod group(P<0.05).Conclusion Nodakenin can improve pain behavior in mice,and its mechanism involves ameliorating mitochondrial damage in S1.
Key words:Nodakenin;mitochondria;inflammation;neuropathicpain;primary somatosensory cortex
神经病理性疼痛(neuropathicpain,NP)是由神经系统损伤或疾病导致的疼痛,影响全球7%~10%的人口,其病程长,治疗困难,严重影响患者生活质量[1]。初级躯体感觉皮层(primary somatosensory cortex,S1)是感觉信号中心,在NP进程中神经元自发放电、同步活动和低频震荡均增加[2-3],同时星形胶质细胞被激活且活性增强[4]。线粒体通过影响腺苷三磷酸(ATP)生成、钙离子水平和过氧化物产生等方式调节神经元和胶质细胞的功能[5]。在坐骨神经损伤和化疗神经损伤等多种NP动物模型中检测到线粒体形态和功能异常[6-8];且70%的线粒体疾病患者伴随有慢性疼痛[9]。因此,靶向改善S1中线粒体功能可作为治疗NP的策略。紫花前胡苷(Nodakenin,Nod)是从当归根中提取的一种香豆素,具有抗炎、抗氧化、抗过敏、改善认知等功效。研究显示,Nod可通过抑制核因子-κB信号缓解炎性疼痛[10];抑制线粒体分裂并减弱过氧化物信号来改善炎症反应[11]。但Nod在NP中的作用及机制尚不明确。本研究通过构建坐骨神经慢性压迫损伤(chronic constriction injury of the sciatic nerve,CCI)模型检测动物痛觉行为变化,分析S1内线粒体相关蛋白表达变化,为Nod在NP中的应用提供实验依据。
1材料与方法
1.1细胞、主要试剂与仪器鼠肾上腺嗜铬细胞瘤神经细胞(PC-12)购自广州艾迪基因科技有限责任公司,在添加10%胎牛血清的1640培养基中并置于5%CO2、37℃的培养箱中培养,培养基每2日更换1次。Nod购自上海源叶生物科技有限公司。一抗兔多克隆抗体即早基因(Fos proto-oncogene,c-fos)和白细胞介素-1β(IL-1β)购自江苏亲科生物有限公司;兔多克隆抗体泛醇-细胞色素C还原酶复合体Ⅲ亚基(Uqcrq)和泛醌氧化还原酶亚基B5(Ndufb5)购自江苏亲科生物研究中心有限公司;辣根过氧化物酶标记的羊抗兔IgG二抗购自武汉爱博泰克生物科技有限公司。Mito-Tracker Red CMXRos染色试剂盒购自上海碧云天生物技术有限公司;1640培养基购自赛默飞世尔科技有限公司。von Frey纤维(Stoelting,美国),转棒疲劳仪(北京众实迪创,中国),荧光显微镜(Olympus,日本),冷冻台式微型离心机(Eppendorf,德国),显影仪(Invitrogen,美国)。
1.2实验动物27只雄性6~8周龄C57BL/6小鼠,体质量(20±2)g,购自江苏华创信诺医药科技有限公司,动物生产许可证号:SCXK(苏)2020-0009;动物使用许可证号:SYXK(鄂)2023-0071。小鼠在标准SPF级动物房中正常饲养,提供充足的水和饲料。本研究经湖北科技学院实验动物伦理委员会批准(2023-03-104)。
1.3方法
1.3.1数据收集通过GEO数据库收集神经病理性疼痛的数据,数据集编号为GSE180627,分析S1内差异性表达基因;下载线粒体基因数据库MitoCarta3.0;韦恩图、GO(Gene Ontology)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析数据集与线粒体数据之间的重叠基因;STRING数据库和Cytoscape分析重叠基因的蛋白相互作用网络并筛选核心基因。
1.3.2模型建立及分组处理将小鼠采用随机数字表法分为3组:假手术组、模型组和给药组,每组9只。通过麻醉小鼠、剔毛、消毒、剪开皮肤,钝性分离肌肉,暴露坐骨神经并结扎完成CCI模型构建,以用于表征NP。假手术组仅分离筋膜不结扎神经。建模6周后,给药组在模型组基础上腹腔注射10 mg/kg Nod连续1周;模型组小鼠注射同等体积的DMSO和0.9%氯化钠混合液。
1.3.3机械性刺激缩足阈值(paw withdrawal mechaical threshold,PWT)检测待小鼠适应环境30 min后,用von Frey纤维剌激小鼠后足底正中部。若出现舔足或抬足等行为则视为阳性反应,反之则视为阴性反应。若出现阳性反应,则用相邻较低一级力度纤维再次刺激;若出现阴性反应,则用相邻较高一级力度再次刺激,测试出现阳性反应的最小刺激强度,6次后记录并计算各组小鼠PWT。
1.3.4热缩足反射潜伏期(thermal withdrawal threshold,TWL)检测将小鼠置于PL-200型热刺激仪适应,用光照(45~65℃)刺激小鼠足底,观察小鼠出现舔足缩足时间,测试3次,每次间隔15 min,记录并计算TWL。
1.3.5转棒停留时间检测实验前3 d小鼠以固定速度4 r/min训练3次,每次10 min。实验时转速为10 r/min,持续10 s,增加速度至20 r/min,持续30 s;记录转棒停留时间。
1.3.6组织形态学分析小鼠深度麻醉后用4%多聚甲醛固定,处死并分离脑组织。脑组织经脱水、石蜡包埋后切成4µm切片。切片按照HE试剂盒或尼氏试剂盒标准操作染色。置于显微镜下观察并拍照,Image J软件分析。
1.3.7蛋白免疫印迹检测炎性因子和线粒体相关蛋白表达取小鼠脑组织,用含蛋白酶抑制剂的裂解液裂解,4℃、12 000×g离心20 min。收集上清液,使用BCA蛋白浓度试剂盒对蛋白浓度进行定量分析。收集的蛋白样品经SDS-PAGE分离后,转移至聚偏二氟乙烯膜上。5%脱脂奶粉室温封闭1 h,在4℃条件下c-fos(1∶1 000)、IL-1β(1∶1 000)、Uqcrq(1∶1 000)、Ndufb5(1∶1 000)一抗孵育过夜,洗膜3次,每次10 min。山羊抗兔二抗(1∶5 000)在室温下孵育1 h。洗膜3次,每次10 min。采用LAS500凝胶成像系统扫描观察,Image J软件分析条带灰度值。
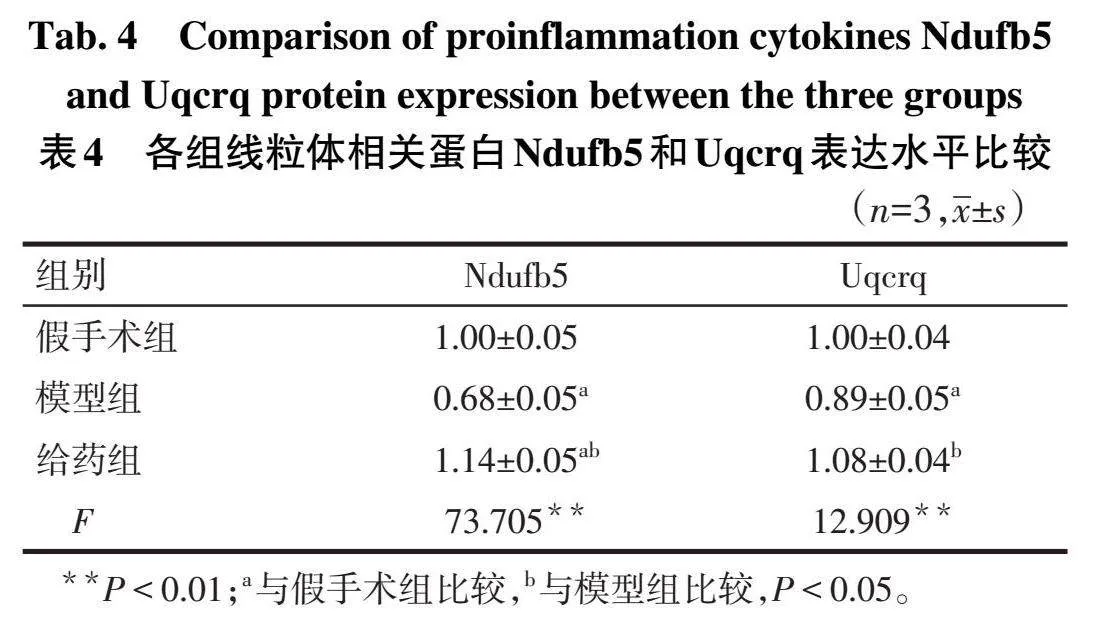
1.3.8分子对接检测药物分子能与靶点紧密结合。经PDB数据库下载Uqcrq(ID为5XTH)和Ndufb5(ID为8J9H)结构;Pubchem数据库下载Nod结构;Autodock对接Nod与Uqcrq和Ndufb5;PyMOL可视化对接结果。
1.3.9线粒体膜电位检测将PC12细胞接种于24孔板,分为对照组、IL-1β组和IL-1β+Nod组。待细胞贴壁形态正常后,IL-1β组和IL-1β+Nod组使用IL-1β(1µmol/L)处理6 h,后者加Nod(1µmol/L)处理24 h,使用Mito-Tracker Red CMXRos染色试剂盒检测细胞线粒体膜电位,细胞分组给药处理完毕后,加入Mito-Tracker Red CMXRos工作液(200 nmol/L),37℃避光孵育30 min后去除工作液,37℃避光染核10 min,在荧光显微镜下观察拍照。使用Image J软件分析细胞的荧光强度。
1.4统计学方法采用SPSS 26.0软件进行数据分析,符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey法。以P<0.05为差异有统计学意义。
2结果
2.1 NP及线粒体相关基因表达分析NP数据集GSE180627中S1脑区包含293个差异性表达基因,线粒体数据包含1 082个基因,两个数据集的重叠基因共34个。34个重叠基因通过使用GO和KEGG进行富集分析,发现氧化磷酸化和电子传递链相关基因被富集。蛋白相互作用(PPI)网络显示核心基因包括电子传递链相关蛋白Ndufb5、Uqcrq、Ndufs8、Ndufa7、Ndufa3、Cox6b1和Mrps33,见图1。
2.2 Nod对小鼠疼痛相关行为的影响与假手术组相比,模型组小鼠PWT、TWL、转棒停留时间均下降(P<0.05)。与模型组相比,给药组PWT、TWL和转棒停留时间增加(P<0.05),见表1。
2.3 Nod对S1脑组织神经损伤和炎症的影响HE染色结果显示,与假手术组相比,模型组S1组织炎症浸润细胞数量升高(P<0.05);与模型组相比,给药组炎症浸润细胞数量降低(P<0.05),见图2、表2。尼氏染色结果显示,与假手术组相比,模型组S1组织神经元中尼氏小体数量增加(P<0.05);与模型组相比,给药组小鼠S1组织神经元中尼氏小体数量降低(P<0.05),见图3、表2。
2.4 Nod对S1脑组织炎症因子的影响蛋白免疫印迹结果显示,与假手术组相比,模型组S1中神经元c-Fos和IL-1β表达水平升高(P<0.05);与模型组相比,给药组S1中神经元c-Fos和IL-1β表达水平降低(P<0.05),见图4、表3。
2.5 Nod对线粒体相关蛋白的影响分子对接结果显示,Nod可与Uqcrq和Ndufb5结合,能量分别为-6.8 kcal/mol(1 kcal=4.184 kJ)和-6.5 kcal/mol。免疫印迹结果显示,与假手术组相比,模型组S1中线粒体相关蛋白Uqcrq和Ndufb5表达水平降低(Plt;0.05);与模型组相比,给药组Uqcrq和Ndufb5的表达水平增加(P<0.05),见图5、表4。
2.6 Nod对线粒体膜电位的影响对照组、IL-1β组和IL-1β+Nod组线粒体膜电位荧光信号强度分别为1.00±0.01、0.68±0.02和1.13±0.02,组间比较差异有统计学意义(n=3,F=303.962,P<0.01)。与对照组相比,IL-1β组细胞线粒体膜电位荧光信号减弱(P<0.05);与IL-1β组相比,IL-1β+Nod组细胞线粒体膜电位荧光信号增强(P<0.05),见图6。
3讨论
CCI模型是一种广泛使用的慢性NP的周围神经损伤模型,操作简单且稳定;疼痛过敏反应常采用测定PWT和TWL的方法,这两种方法成熟、可靠且可定量,使用广泛[12]。本研究发现模型组小鼠表现为机械痛和热痛异常且运动能力受损。神经元功能改变和神经胶质介导神经炎症发生是NP发生发展的重要病理机制[13]。尼氏小体是神经元特征性结构之一,是神经元内的嗜碱性颗粒群,其大小和数量可反映神经元合成蛋白质功能的程度。原癌基因c-Fos是神经系统广泛存在的一种即刻早期基因,其编码的c-Fos蛋白常被用来表征神经元功能活动,在神经元受到损伤或刺激后被激活[14]。本研究中模型组S1皮层尼氏小体和c-Fos表达均上调,表明其神经元活动和功能受损。IL-1β是一种关键的炎性因子,可激活小胶质细胞和星形胶质细胞,导致中枢神经系统内其他促炎和趋化介质的下游合成增加,从而在大多数中枢神经系统相关疾病中发挥作用[15]。本研究中模型组S1皮层炎症细胞浸润和IL-1β表达增加,表明其神经炎症被激活。研究表明,Nod可促进神经元发生并发挥改善神经元功能的作用,且在炎症痛小鼠模型中可降低IL-1β表达水平并缓解炎症痛[16]。本研究中,与模型组相比,给药组的上述疼痛相关行为和运动能力改善,S1脑组织神经损伤和炎症改善,表明Nod可发挥神经保护性作用,可作为多种神经系统疾病的潜在药物。
神经元和胶质细胞的功能高度依赖ATP和线粒体氧化磷酸化过程。研究发现,NP进程中小鼠伴随有线粒体形态和功能损伤[17]。Ndufb5是线粒体呼吸传递链复合物Ⅰ的亚基,位于线粒体内膜,是氧化磷酸化的第一步,负责还原型烟酰胺腺嘌呤二核苷酸氧化、泛醌还原及将质子跨内膜泵出线粒体基质,有助于ATP的产生[18]。Ndufb过表达可增加呼吸复合物组装、增强线粒体代谢、减轻过氧化物产生并改善线粒体功能[19]。Ndufb5可参与驱动逆向电子传递并维持小胶质细胞的激活,在癌痛和炎性痛等动物模型中表达降低,被激活后可降低炎症反应和活性氧水平并缓解痛觉过敏[20-21]。Uqcrq是呼吸传递链复合物Ⅲ的一个亚基,负责将电子从泛醇转移到细胞色素C,并有助于电化学质子梯度的生成[22]。Uqcrq缺乏会导致细胞色素C增加并激活含半胱氨酸的天冬氨酸蛋白水解酶级联信号,引发神经元凋亡[23]。本研究发现,在模型组小鼠S1中线粒体呼吸传递链相关蛋白Ndufb5和Uqcrq表达水平降低。Nod可降低线粒体介导的活性氧信号,减轻炎症反应[16]。本研究使用分子对接预测Nod与Ndufb5和Uqcrq的结合,结果显示结合能量为-6.8 kcal/mol和-6.5 kcal/mol,表示两者结合为中等强度。同时研究发现,Nod可上调Ndufb5和Uqcrq表达水平,在细胞水平升高线粒体膜电位,改善线粒体功能。笔者推测,Nod可能通过上调线粒体呼吸传递链相关蛋白表达水平,激活线粒体功能,缓解S1皮层神经损伤,从而在NP中发挥作用。
综上所述,Nod可改善小鼠的S1内线粒体功能,进而缓解NP。本研究有助于揭示NP的发病机制,并为Nod在疼痛中的应用提供支持。
参考文献
[1]BIELEWICZ J,KAMIENIAK M,SZYMONIUK M,et al.Diagnosis and management of neuropathic pain in spine diseases[J].J Clin Med,2023,12(4):1380.doi:10.3390/jcm12041380.
[2]ZIEGLER K,FOLKARD R,GONZALEZ A J,et al.Primary somatosensory cortex bidirectionally modulates sensory gain and nociceptive behavior in a layer-specific manner[J].Nat Commun,2023,14(1):2999.doi:10.1038/s41467-023-38798-7.
[3]CHEN C,SUN L,ADLER A,et al.Synchronized activity of sensory neurons initiates cortical synchrony in a model of neuropathic pain[J].Nat Commun,2023,14(1):689.doi:10.1038/s41467-023-36093-z.
[4]JI R R,DONNELLY C R,NEDERGAARD M.Astrocytes in chronic pain and itch[J].Nat Rev Neurosci,2019,20(11):667-685.doi:10.1038/s41583-019-0218-1.
[5]HAYNES P R,PYFROM E S,LI Y,et al.A neuron-glia lipid metabolic cycle couples daily sleep to mitochondrial homeostasis[J].Nat Neurosci,2024,27(4):666-678.doi:10.1038/s41593-023-01568-1.
[6]DOYLE T M,SALVEMINI D.Mini-review:mitochondrial dysfunction and chemotherapy-induced neuropathic pain[J].Neurosci Lett,2021,760:136087.doi:10.1016/j.neulet.2021.136087.
[7]赵佳佳,万文军,杨荷雨,等.ANA-12靶向抑制BDNF/TrkB信号缓解奥沙利铂诱导化疗大鼠的痛觉行为[J].天津医药,2023,51(1):35-40.ZHAO J J,WAN W J,YANG H Y,et al.ANA-12 relieves oxaliplatin-induced chemotherapy pain in rats by targetly inhibiting BDNF/TrkB signal[J].Tianjin Med J,2023,51(1):35-40.doi:10.11958/20220518.
[8]袁满,冯子瀚,谢敏,等.大黄素对骨关节炎模型小鼠痛觉行为的调节机制[J].天津医药,2024,52(6):572-577.YUAN M,FENG Z H,XIE M,et al.Mechanism of emodin modulating pain behavior in mouse model of osteoarthritis[J].Tianjin Med J,2024,52(6):572-577.doi:10.11958/20240056.
[9]SILVA SANTOS RIBEIRO P,WILLEMEN H,EIJKELKAMP N.Mitochondria and sensory processing in inflammatory and neuropathic pain[J].Front Pain Res(Lausanne),2022,3:1013577.doi:10.3389/fpain.2022.1013577.
[10]LIN Y,CHEN Y,ZENG J,et al.Nodakenetin alleviates inflammatory pain hypersensitivity by suppressing NF-κB signal pathway[J].Neuroimmunomodulation,2022,29(4):486-492.doi:10.1159/000525690.
[11]YI N,MI Y,XU X,et al.Nodakenin attenuates cartilage degradation and inflammatory responses in a mice model of knee osteoarthritis by regulating mitochondrial Drp1/ROS/NLRP3 axis[J].Int Immunopharmacol,2022,113(Pt A):109349.doi:10.1016/j.intimp.2022.109349.
[12]康美美,王蓉.CCI和SNI神经病理性疼痛动物模型的认知功能研究进展[J].神经疾病与精神卫生,2021,21(11):761-764.KANG M M,WANG R.Research progress on the cognitive function of CCI and SNI neuropathic pain models[J].Journal of Neuroscience and Mental Health,2021,21(11):761-764.doi:10.3969/j.issn.1009-6574.2021.11.001.
[13]梁彦虎,李雪松,苑龙,等.CXCL1/CXCR2与神经性疼痛的相关机制及研究进展[J].中国临床实用医学,2019,10(1):72-74.LIANG Y H,LI X S,YUAN L,et al.The mechanism and research progress of CXCL1/CXCR2 and neuropathic pain[J].China Clinical Practical Medicine,2019,10(1):72-74.doi:10.3760/cma.j.issn.1673-8799.2019.01.023.
[14]孙晓敏,张萌,迟宜嘉,等.禁锢应激对小鼠焦虑相关脑区c-Fos表达的影响[J].青岛大学学报(医学版),2020,56(2):177-180.SUN X M,ZHANG M,CHI Y J,et al.Effect of repeated restraint stress on the expression of c-Fos in anxiety-related brain regions in mice[J].Journal of Qingdao University(Medical Sciences),2020,56(2):177-180.doi:10.11712/jms.2096-5532.2020.56.067.
[15]LOPEZ-RODRIGUEZ A B,HENNESSY E,MURRAY C L,et al.Acute systemic inflammation exacerbates neuroinflammation in Alzheimer′s disease:IL-1βdrives amplified responses in primed astrocytes and neuronal network dysfunction[J].AlzheimersDement,2021,17(10):1735-1755.doi:10.1002/alz.12341.
[16]LI J,WANG L,TAN R,et al.Nodakenin alleviated obstructivenephropathy through blunting Snail1 induced fibrosis[J].J Cell Mol Med,2020,24(17):9752-9763.doi:10.1111/jcmm.15539.
[17]MU Y,MEI Y,CHEN Y,et al.Perisciatic nerve dexmedetomidine alleviates spinal oxidative stress and improves peripheral mitochondrial dynamic equilibrium in a neuropathic pain mouse model in an AMPK-dependent manner[J].Dis Markers,2022,2022:6889676.doi:10.1155/2022/6889676.
[18]BRIDGES H R,BLAZA J N,YIN Z,et al.Structural basis of mammalian respiratory complex I inhibition by medicinal biguanides[J].Science,2023,379(6630):351-357.doi:10.1126/science.ade3332.
[19]ZHANG R,HOU T,CHENG H,et al.NDUFAB1 protects against obesity and insulin resistance by enhancing mitochondrial metabolism[J].FASEB J,2019,33(12):13310-13322.doi:10.1096/fj.201901117RR.
[20]PERUZZOTTI-JAMETTI L,WILLIS C M,KRZAK G,et al.Mitochondrial complex I activity in microglia sustains neuroinflammation[J].Nature,2024,628(8006):195-203.doi:10.1038/s41586-024-07167-9.
[21]GUO C,YUE Y,WANG B,et al.Anemoside B4 alleviates arthritis pain via suppressing ferroptosis-mediated inflammation[J].J Cell Mol Med,2024,28(4):e18136.doi:10.1111/jcmm.18136.
[22]PANGA V,KALLOR A A,NAIR A,et al.Mitochondrial dysfunction in rheumatoid arthritis:a comprehensive analysis by integrating gene expression,protein-protein interactions and gene ontology data[J].PLoS One,2019,14(11):e0224632.doi:10.1371/journal.pone.0224632.
[23]HUNG Y C,HUANG K L,CHEN P L,et al.UQCRC1 engages cytochrome c for neuronalapoptotic cell death[J].Cell Rep,2021,36(12):109729.doi:10.1016/j.celrep.2021.109729.
(2024-07-19收稿2024-10-25修回)
(本文编辑李志芸)